外源2,4-表油菜素内酯对NaCl胁迫下燕麦幼苗光合特性的影响
寇江涛
(1.宜春学院 生命科学与资源环境学院,江西 宜春 336000;2.江西省作物生长发育调控重点实验室,江西 宜春 336000)
光合作用是植物生长发育和产量形成的基础,也因此成为植物抗盐生理研究的热点问题[1]。盐胁迫下,植物光合反应中心功能受损,光合色素合成受阻,进而降低碳同化效率和光合同化产物的积累[2]。同时,盐胁迫还抑制植物叶片中叶绿素的生物合成,并破坏叶绿体中捕光色素蛋白复合体的机能,使得植物叶片PSⅡ功能被抑制,光合电子传递受阻[3],导致植物的光合效率降低,最终抑制植物的生长和发育[4]。
油菜素内酯(Brassinosteroids,BRs)被称为第六大类植物激素,能够参与植物的生长发育,调控植物的生理生化代谢过程,还能够缓解植物的逆境胁迫[5-6]。研究表明,外源BRs能够提高植物的光合速率,促进光合同化产物的积累,并调控碳水化合物的分配,增加植物对营养元素的吸收[7-8]。魏湜等[9]研究表明,施用外源BRs能够调节玉米幼苗叶片中内源激素含量,提高植株光合能力。吴秀和陆晓民[10]研究表明,外源油菜素内酯能够缓解亚适宜温光盐环境对黄瓜幼苗所造的氧化损伤,降低黄瓜幼苗的膜脂过氧化程度,提高其净光合速率,促进黄瓜幼苗在亚适宜温光盐环境下的生长。马梅等[11]研究表明,外源EBR能够降低油菜的气孔限制,提高净光合速率和水分利用效率,增加生物量积累,从而提高油菜的耐盐性。
燕麦(AvenasativaL.)是一种粮饲兼用型作物,具有抗寒、抗旱、耐贫瘠、耐盐碱等特点,是盐碱化和荒漠化土地改良的先锋作物。孙仁国等[12]研究表明,盐胁迫下,燕麦干物质积累量降低,生长受到抑制,且随着胁迫浓度和时间的增加,其光合速率显著下降。武俊英等[13]研究表明,盐胁迫下,燕麦的净光合速率和水分利用效率均下降,当盐浓度大于0.5%时,其光合作用受阻,生长严重受到抑制。刘建新等[14]研究表明,盐碱胁迫下,燕麦叶片光系统Ⅱ反应中心受损,这也是盐碱胁迫导致燕麦光合性能降低的主要因素。
研究表明,外源BRs能够明显缓解NaCl胁迫对燕麦种子萌发所产生的抑制作用,并促进NaCl胁迫下燕麦幼苗的生长[15],而关于BRs调控盐胁迫下燕麦光合作用的研究还未见报道。因此,研究盐胁迫下BRs对燕麦幼苗光合作用的影响,对阐明燕麦的耐盐机制具有重要的意义。本研究以加燕2号、青引2号燕麦为材料,在100 mmol/L NaCl胁迫下,研究外源2,4-表油菜素内酯(2,4-epibrassinolide,EBR)对燕麦幼苗光合色素含量、光合气体交换参数、荧光动力学参数、光合电子传递速率及PSⅡ光能分配情况的影响,旨在明确外源BRs对盐胁迫下燕麦光合作用的调控机理。
1 材料和方法
1.1 供试材料
供试燕麦品种为加燕2号(AvenasativaL. cv. Jiayan No. 2)和青引2号(AvenasativaL. cv. Qingyin No. 2),EBR购自Sigma公司(美国),Ruibio分装。
1.2 试验设计
将供试燕麦种子在HgCl2溶液(浓度0.1%)中消毒5 min,用清水冲洗干净后,播种在装有蛭石的培养钵(深度15 cm,上下口径各为15 cm和10 cm)中。用1/2 Hoagland营养液培养,待燕麦幼苗2叶期,每个培养钵中定植15株,转移至光照室进行培养,预培养21 d后正式开始试验。
试验设置4个处理:正常处理(对照,CK)、NaCl处理(100 mmol/L NaCl)、EBR处理(0.01 μmol/L EBR)、EBR+NaCl处理(100 mmol/L NaCl + 0.01 μmol/L EBR)。每个处理重复4次。试验处理液均用1/2 Hoagland营养液配置,其中NaCl处理和EBR+NaCl处理的处理液含100 mmol/L NaCl,处理液每天更换1次,并间歇性通入空气。试验期间,每天8:30左右在EBR处理和EBR+NaCl处理的燕麦幼苗叶片表面均匀喷施等量的0.01 μmol/L EBR溶液(CK和NaCl处理喷施蒸馏水),喷到有液滴为止。
NaCl处理第10天,取样测定燕麦幼苗叶片中的光合色素含量,同时测定光合气体交换参数、荧光动力学参数和电子传递速率,并计算PSⅡ光能分配情况。
1.3 测定方法
1.3.1 光合色素含量测定 参照Arnon[16]的方法,将燕麦幼苗叶片均匀剪碎后置于25 mL带塞试管中,用80%丙酮溶液遮光浸泡提取,测定叶绿素a(Chla)、叶绿素b(Chlb)和类胡萝卜素(Chlx·c)含量。
1.3.2 光合气体交换参数测定 参照寇江涛等[17]的方法,于9:00-11:00测定燕麦幼苗第2~3片旗叶的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci),并计算水分利用效率(WUE)。
1.3.3 叶绿素荧光动力学参数测定 参照寇江涛等[18]的方法,于9:00-11:00,选取燕麦幼苗第2~3片旗叶,利用Imaging-PAM调制叶绿素荧光仪(Walz,Germany)测定其初始荧光(Fo)、最大荧光(Fm)、非光化学淬灭系数(NPQ)、光化学淬灭系数(qP)、PSⅡ实际光合效率(ФPSⅡ)和表观光合电子传递速率(ETR),并计算PSⅡ原初光能转化效率(Fv/Fm)、PSⅡ潜在活性(Fv/Fo)和天线色素转化效率(Fv′/Fm′)。
1.3.4 光能分配情况计算 参照胡文海等[19]的方法,计算燕麦幼苗叶片的PSⅡ光能分配情况,公式如下:光化学反应能(P)=qP×Fv′/Fm′,天线耗散能(D)=1-Fv′/Fm′,反应中心耗散能(E)=(1-qP)×Fv′/Fm′。
1.4 数据处理和分析
采用Excel 2003对试验数据进行处理并绘制图表,采用SPSS 16.0进行差异显著性分析(LSD法),P<0.05表示各个处理间存在显著差异。
2 结果与分析
2.1 不同处理下燕麦幼苗叶片中的光合色素含量
由表1可知,和正常处理(CK)相比较,100 mmol/L NaCl胁迫下,燕麦幼苗叶片中的光合色素(Chla、Chlb、Chla+b和Chlx·c)含量及Chla/Chlb显著降低(P<0.05),Chl/Car显著升高(P<0.05)。正常条件下,0.01 μmol/L EBR处理对燕麦幼苗叶片的光合色素含量、Chla/Chlb和Chl/Car均无显著影响(P>0.05)。100 mmol/L NaCl胁迫下,添加0.01 μmol/L EBR后显著提高了燕麦幼苗叶片中的光合色素(Chla、Chlb、Chla+b和Chlx·c)含量(P<0.05),Chla/Chlb显著升高(P<0.05),Chl/Car显著下降(P<0.05)。
注:不同字母表示同一品种各个处理之间存在显著差异 (P<0.05)。表2同。
Note: Different letters indicate significant differences between treatments in the same variety(P< 0.05). The same as Tab.2.
2.2 不同处理下燕麦幼苗叶片的光合气体交换参数
由图1可知,和正常处理(CK)相比较,100 mmol/L NaCl胁迫下,青引2号和加燕2号燕麦幼苗的Pn、Tr、Gs和WUE均显著降低(P<0.05),Ci显著升高(P<0.05),燕麦幼苗的光合能力显著下降。正常条件下,0.01 μmol/L EBR处理对青引2号燕麦幼苗的Pn、Tr、WUE、Ci和加燕2号燕麦幼苗的WUE、Ci均无显著影响(P>0.05),但显著提高了加燕2号燕麦幼苗的Pn、Tr(P<0.05),同时显著提高了青引2号和加燕2号燕麦幼苗的Gs(P<0.05)。100 mmol/L NaCl胁迫下,添加0.01 μmol/L EBR后,青引2号和加燕2号的Pn、Tr、Gs和WUE均显著升高(P<0.05),Ci显著降低(P<0.05)。

不同字母表示同一品种各个处理之间存在显著差异 (P<0.05)。图2-3同。 Different letters on the column indicate that there are significant differences between different treatments in the same variety(P < 0.05). The same as Fig.2-3.
2.3 不同处理下燕麦幼苗叶片的叶绿素荧光动力学参数
由图2可知,和正常处理(CK)相比较,100 mmol/L NaCl胁迫下,青引2号和加燕2号燕麦幼苗叶片的NPQ和Fo显著升高(P<0.05),Fm、Fv/Fo、Fv′/Fm′、Fv/Fm、ФPSⅡ和qP均显著降低(P<0.05),燕麦幼苗叶片PSⅡ活性显著降低。正常条件下,0.01 μmol/L EBR处理对燕麦幼苗叶片PSⅡ活性无显著影响(P>0.05)。100 mmol/L NaCl胁迫下,添加0.01 μmol/L EBR后,青引2号和加燕2号燕麦幼苗叶片的NPQ和Fo显著降低(P<0.05),Fm、Fv/Fo、Fv/Fm、ФPSⅡ、Fv′/Fm′和qP均显著升高(P<0.05),燕麦幼苗片PSⅡ活性显著提高。


图2 不同处理下燕麦幼苗叶片的叶绿素荧光动力学参数Fig.2 Chlorophyll fluorescence kinetic parameters of oat seedling leaves under different treatments
2.4 不同处理下燕麦幼苗叶片光系统Ⅱ的ETR
由图3可知,和正常处理(CK)相比较,100 mmol/L NaCl胁迫下,燕麦幼苗叶片光系统Ⅱ的ETR显著降低(P<0.05)。正常条件下,0.01 μmol/L EBR处理显著提高了燕麦幼苗叶片光系统Ⅱ的ETR(P<0.05)。100 mmol/L NaCl胁迫下,添加0.01 μmol/L EBR后,青引2号和加燕2号燕麦幼苗叶片光系统Ⅱ的ETR均显著升高(P<0.05)。
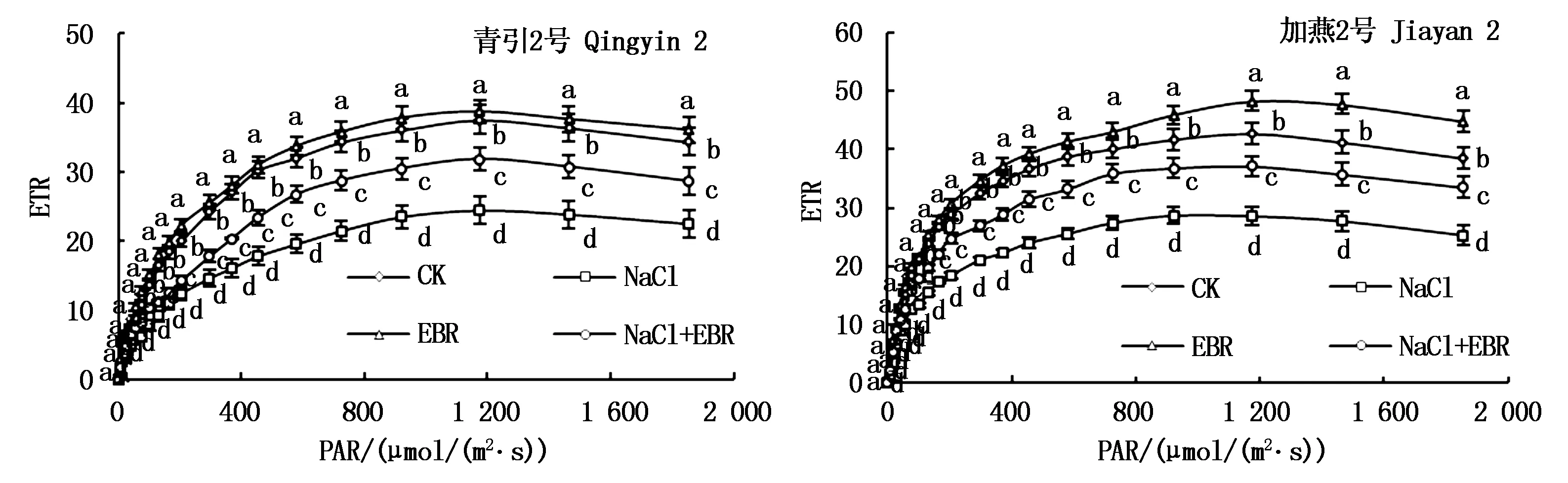
图3 不同处理下燕麦幼苗叶片光系统Ⅱ的ETRFig.3 ETR of light system Ⅱ of oat seedling leaves under different treatments
2.5 不同处理下燕麦幼苗叶片吸收光能的分配情况
由表2可知,和正常处理(CK)相比较,100 mmol/L NaCl胁迫下,燕麦幼苗叶片吸收光能的分配情况发生了改变,青引2号和加燕2号燕麦幼苗叶片吸收的光能中,P显著减少(P<0.05),D和E显著增加(P<0.05)。正常条件下,0.01 μmol/L EBR处理对燕麦幼苗叶片吸收光能的分配情况无显著影响(P>0.05)。100 mmol/L NaCl胁迫下,添加0.01 μmol/L EBR后显著促进了燕麦幼苗叶片吸收的光能向P部分的分配(P<0.05),显著降低了向D部分和E部分的分配(P<0.05)。

表2 不同处理下燕麦幼苗叶片吸收光能的分配Tab.2 Distribution of light energy absorbed by oat seedling leaves under different treatments %
3 讨论与结论
3.1 不同处理下燕麦幼苗叶片的光合色素含量及气体交换参数
在植物光合系统中,Chla和Chlb是PSⅠ、PSⅡ的主要组成成分,具有光能吸收、电子传递的作用,二者含量的高低直接影响植物的碳同化效率[20-21]。Car在维持类囊体膜和色素-蛋白复合物的稳定性、光能吸收、能量分配等方面起到重要作用[22]。逆境胁迫下,植物叶片中光合色素的含量和比例会发生改变,Chla/Chlb下降、Chl/Car升高,从而抑制植物对光能的吸收、转化和利用效率[23]。本研究中,100 mmol/L NaCl胁迫下,燕麦幼苗叶片的光合色素含量显著降低,Chla/Chlb显著下降,Chl/Car显著升高,说明NaCl胁迫抑制了燕麦幼苗叶片中Chl的合成代谢,导致Chl的降解加快,并对叶绿体类囊体结构及其垛叠程度造成破坏,致使PSⅠ、PSⅡ及外周天线受损,产生光抑制作用,从而抑制了燕麦幼苗叶片中的叶绿体对光能的吸收、转化和利用效率,造成燕麦幼苗的光合效率显著降低。在100 mmol/L NaCl胁迫下,添加0.01 μmol/L外源EBR显著提高了燕麦幼苗的光合色素含量,并提高了Chla/Chlb,降低了Chl/Car,说明外源EBR对保持燕麦幼苗叶片中叶绿体结构和功能的完整性、维持类囊体膜的稳定性具有一定的作用,同时还有利于燕麦幼苗叶片中Chl的生物合成,能够减轻NaCl胁迫对PSⅠ、PSⅡ及外周天线造成的损伤程度,提高光合电子传递效率,从而增强燕麦幼苗在NaCl胁迫下对光能的吸收、转化和利用效率,这和李涛涛等[24]、李彩凤等[25]、尹博等[26]在其他植物上的研究结果一致。
本研究中,100 mmol/L NaCl胁迫显著降低了燕麦幼苗的Pn、Tr、Gs和WUE,但Ci显著升高,说明NaCl胁迫所导致的非气孔因素(Gs下降、Ci上升)[27]阻碍并降低了燕麦幼苗对CO2的利用效率,从而引起燕麦幼苗的Pn下降,光合能力显著降低,这与吴雪霞等[28]在番茄上的研究结果一致。在100 mmol/L NaCl胁迫下,添加0.01 μmol/L外源EBR显著提高了燕麦幼苗的Pn、Tr、Gs和WUE,但Ci显著降低,这和张永平等[29]、李宁等[30]、李蒙等[31-32]在甜瓜、番茄、黄心菜上的研究结果一致,说明在NaCl胁迫下,外源EBR能够通过维持一定的气孔导度,提高燕麦幼苗对CO2的利用效率,进而补偿NaCl胁迫所造成的燕麦幼苗光合能力的下降。
3.2 不同处理下燕麦幼苗叶片光系统Ⅱ的功能及光能分配
Fo的大小和叶片中叶绿素含量有关[33],还和类囊体膜受损程度或PSⅡ反应中心遭受破坏程度有关[34]。Fm的大小能够反映光系统Ⅱ的电子传递速率,还和光系统Ⅱ原初电子受体QA的氧化还原状态有关[35]。本研究中,100 mmol/L NaCl胁迫下,燕麦幼苗叶片的类囊体膜结构遭到破坏,从而引起PSⅡ反应中心功能紊乱,QA的重新氧化受到抑制,最终导致PSⅡ的电子传递速率下降,所以燕麦幼苗叶片的Fo显著提高,Fm显著降低。添加0.01 μmol/L外源EBR可以减轻燕麦幼苗叶片类囊体膜结构和PSⅡ反应中心在100 mmol/L NaCl胁迫下的受损程度,促进燕麦幼苗叶片中QA还原态的重新氧化,进而提高燕麦幼苗叶片PSⅡ在盐胁迫下的电子传递速率,所以Fo显著下降,Fm显著升高。
ФPSⅡ和植物碳同化量有关,能够反映PSⅡ实际光化学效率的大小[36]。Fv/Fo和Fv/Fm的大小和光化学反应状况有关[37],植物在遭受逆境胁迫时Fv/Fm一般会下降[34]。本研究中,100 mmol/L NaCl胁迫破坏了燕麦幼苗叶片PSⅡ反应中心的正常功能,导致激发能由LHC向PSⅡ的传递过程受阻,同时使得燕麦幼苗叶片中光合电子由PSⅡ反应中心向QA、QB及PQ库的正常传递受阻,进一步增强了光抑制现象,使得激发能在PSⅠ和PSⅡ之间分配不均衡,导致燕麦幼苗的光合磷酸化效率、光能利用效率及碳同化效率降低,因此,燕麦幼苗叶片的ФPSⅡ、Fv/Fo、Fv/Fm显著降低。在100 mmol/L NaCl胁迫下,添加0.01 μmol/L外源EBR能够明显缓解燕麦幼苗PSⅡ的受破坏程度,减轻光抑制现象,因此,燕麦幼苗叶片的ФPSⅡ、Fv/Fo、Fv/Fm显著升高,这和李淑叶等[38]在外源EBR调控棉花幼苗耐冷性的研究结果一致。
qP反映了QA的还原状态[37],NPQ反映了光能的热耗散情况[39]。本研究中,100 mmol/L NaCl胁迫下,燕麦幼苗叶片QA的还原效率降低,叶片吸收的光能中,用于热耗散部分的比例显著增加,从而显著降低了燕麦幼苗的光能利用效率,因此,燕麦幼苗叶片的qP显著降低,NPQ显著提高。同时,100 mmol/L NaCl胁迫还阻碍了光能向PSⅡ反应中心的传递,降低燕麦幼苗叶片中光能的传递效率,导致光合碳同化所需的ATP、NADPH显著下降,燕麦幼苗光抑制程度增加,因此,燕麦幼苗叶片的Fv′/Fm′和ETR显著降低,这与Fv/Fo、Fv/Fm的变化结果一致,进而说明NaCl胁迫造成PSⅡ反应中心功能受损是燕麦幼苗光合效率降低的根本原因之一。在100 mmol/L NaCl胁迫下,添加0.01 μmol/L外源EBR显著提高了燕麦幼苗叶片中QA的还原效率,并降低了PSⅡ天线色素吸收的光能的天线热耗散,显著提高了燕麦幼苗的光能利用效率,有效缓解NaCl胁迫对燕麦幼苗叶片PSⅡ反应中心造成的损伤程度,从而提高NaCl胁迫下燕麦幼苗的光合效率,杨万基等[40]在28-高芸苔素内酯(28-HBR)缓解辣椒幼苗低温弱光胁迫的研究中也得到了类似的结果。
在正常情况下,光合电子传递、叶绿素荧光发射和热耗散是光能的3种主要消耗途径[41],当植物遭受逆境胁迫时,植物叶片吸收光能的天线色素耗散能增加,导致光化学反应能减少,植物则通过光能重新分配来缓解过剩光能对其造成的伤害[28]。本研究中,100 mmol/L NaCl胁迫导致燕麦幼苗叶片PSⅡ天线色素吸收光能的耗散途径发生了改变,用于PSⅡ光化学反应的光能显著减少,而天线耗散能和反应中心耗散能显著增加,说明NaCl胁迫导致燕麦幼苗对光能的利用效率降低,这与胡文海等[19]在辣椒上的研究结果一致。在100 mmol/L NaCl胁迫下,添加0.01 μmol/L外源EBR显著提高了燕麦幼苗对光能的利用效率,使得天线热耗散和反应中心过剩光能显著降低(向D、E的分配),PSⅡ光化学反应能显著增加(向P的分配),这与进一步平衡了激发能在PSⅠ、PSⅡ之间的分配,提高了PSⅡ光化学效率,有效缓解了NaCl胁迫对燕麦幼苗PSⅡ反应中心的结构和功能所造成的伤害有关,这与Li等[42]在外源EBR调控辣椒抗寒性的研究结果一致,说明外源能够提高燕麦幼苗在NaCl胁迫下的光化学反应效率,从而提高其光合能力。
综上所述,NaCl胁迫明显抑制了燕麦幼苗叶片PSⅡ反应中心活性,导致燕麦幼苗PSⅡ光化学效率下降,Pn显著降低。外源EBR能够显著提高NaCl胁迫下幼苗PSⅡ反应中心的实际光化学效率和光能捕捉效率,有效缓解NaCl胁迫对燕麦幼苗所产生的光抑制和PSⅡ反应中心损伤程度,提高燕麦幼苗的碳同化效率和光合能力。说明外源BRs对盐胁迫下燕麦光合作用起到正向调控作用,能够有效缓解盐胁迫对燕麦幼苗所造成的伤害。

