外源信号分子诱导处理对甜瓜抗病MAPK基因表达的影响
郑贺云 李超 姚军 廖新福 耿新丽


摘 要: 为了探讨MAPK基因在甜瓜中的表达调控模式,以感病甜瓜品种‘哈密加格达和抗病甜瓜品种‘Edisto47为试验材料,采用实时定量PCR(qRT-PCR)方法,研究了外源信号分子茉莉酸甲酯(MeJA)、脱落酸(ABA)和褪黑素(MT)诱导处理甜瓜叶片中MAPK基因的表达情况。结果表明,甜瓜品种中3个MAPK相关基因MAPK21、MAPK20、MAPK9在接种白粉病菌后均出现了上调表达,MeJA处理抗病甜瓜品种后,3个基因在36 h的相对表达量达到最高,分别为130.74、107.74和99.71,处理感病甜瓜品种后,各基因在60 h的相对表达量达到最高,分别为29.32、18.35和17.34;ABA和MT处理也是同样的变化趋势,但表达量低于MeJA处理,由此说明3个MAPK基因在抗病甜瓜品种中的相对表达量显著高于感病品种,MAPK21基因相对表达量高于MAPK20和MAPK9,且MeJA处理的甜瓜有助于MAPK21基因表达调控,提高其抗白粉病的能力。
关键词: 甜瓜; 外源信号分子; MAPK基因; 表达分析
Abstract: In order to investigate the gene expression involved in MAPK signal transduction pathway in melon, the susceptible melon cultivar ‘Hamijiageda and disease-resistant melon cultivar ‘Edisto47 melon were used as test materials, the expression of the MAPK genes were studied by quantitative reverse-transcription polymerase chain reaction(qRT -PCR), the external signal molecules were methyl jasmonate (MeJA), abscisic acid (ABA) and melatonin (MT). The results showed that the expressions of MAPK21, MAPK20 and MAPK9 in melon varieties were up-regulated after being inoculated with powdery mildew. The disease-resistant melon cultivar 's expression of three MAPK genes was the largest after MeJA treatment for 36 hours, and the expression respectively were 130.74、107.74 and 99.71. The susceptible melon cultivars expression of three MAPK genes was the largest after MeJA treatment for 60 hours, and the expression respectively were 29.32、18.35 and 17.34; ABA and MT change trend was same variation tread with MeJA, but the expression leave lower than MeJA processing, It was concluded that the relative expression of MAPK genes in disease-resistant melon cultivar significantly higher than that of cultivars. Compared with the MAPK20 and MAPK9, the relative expression MAPK21 gene was higher, the MeJA treatment will help MAPK21 gene expression regulation, improve the resistance to powdery mildew.
甜瓜是葫蘆科(Cucurbitaceae)香瓜属(Cucumis)一年蔓生草本植物,在我国具有悠久的栽培历史,且栽培面积居世界前列[1]。其中,新疆栽培面积更大,是当地农民创收的主要经济作物之一。然而,甜瓜白粉病是当地生产中广泛发生的重要病害之一,在很大程度上制约了当地甜瓜产业的健康发展,如果预防不到位将造成甜瓜植株叶片变黄萎蔫以致大面积枯死,对甜瓜的产量和品质带来很大危害[2]。挖掘甜瓜优异抗病基因资源用于抗病新品种的培育,是从根本上解决甜瓜白粉病病害的有效途径[3]。
促分裂原活化蛋白激酶级联途径(Mitogen-activated protein kinases, MAPKs)是在真核生物中广泛存在的一种十分重要的保守信号传导系统,在调节生物体对环境的主动适应过程中占非常重要的作用,通常包括3个级别的功能蛋白激酶,分别是促分裂原活化蛋白激酶激酶激酶(MAPKKK)、促分裂原活化蛋白激酶激酶(MAPKK)和促分裂原活化蛋白激酶(MAPK)[4-5]。随着各园艺作物基因组测序的完成,大量的MAPK级联途径基因家族成员先后从拟南芥、烟草、番茄、草莓、黄瓜、西瓜等[6-11]园艺作物中鉴定出来。其中MAPK受信号分子或细胞外刺激,经过MAPK级联反应(MAPKKK—MAPKK—MAPK)而激活的丝氨酸/苏氨酸蛋白激酶,通过蛋白质磷酸化作用响应外界信号并通过上游信号级联放大并传递至细胞内的蛋白激酶,在调控植物的生长发育、胁迫响应及抗病反应等许多生理生化过程中起重要作用[12]。笔者所在课题组前期研究发现,甜瓜MAPK 3个基因参与了由水杨酸(SA)、乙烯利(ETH)和南瓜白粉病病原菌介导的植物抗病防卫反应的基本信号通路,初步判断了MAPK 3个基因在甜瓜中的表达功能[13]。该试验在前期研究的基础上,以甜瓜感白粉病品种‘哈密加格达、抗白粉病品种‘Edisto47为试验材料,采用MeJA、ABA和MT作为外源信号分子进行处理,无菌水处理作为对照。调查感病率并采用荧光定量PCR技术分析甜瓜抗白粉病相关基因MAPK21、MAPK20和MAPK9的差异表达,通过外源诱导提高甜瓜抗病基因MAPK的表达水平来防御甜瓜白粉病菌的侵染,以期找到防治甜瓜白粉病的高效新方法。
1 材料与方法
1.1 材料
试验材料分别为感病品种‘哈密加格达和抗病品种‘Edisto47,2份种子购自国家西瓜甜瓜中期库。其中‘哈密加格达为地方品种,原产于新疆吐鲁番市鄯善县,为厚皮甜瓜类型,果皮灰绿色,果面有粗网纹,果肉浅绿色,肉质脆,不抗白粉病;‘Edisto47是由南卡罗纳州布莱克维尔大学选育的厚皮甜瓜品种,果皮深绿色,成熟后变成黄绿色,果实高圆,果面有粗网纹,肉质软,高抗白粉病。
甜瓜白粉病菌生理小种Race 1由新疆农业大学西甜瓜分子育种实验室提供。荧光定量PCR引物、反转录试剂盒等试材由奥科鼎盛生物有限公司提供、合成。
1.2 方法
2019年8—12月在河南科技学院园艺学院实验室完成。选取饱满无伤的甜瓜种子,消毒处理后经过28 ℃恒温处理催芽,播种到50穴育苗盘中,置于人工气候培养箱中生长,温度25 ℃、相对湿度60%,16 h光照/8 h黑暗。
将白粉病病原菌接种于诱导培养基上震荡培养,黑光灯诱导病原菌孢子的产生。制成浓度为1×106个·mL-1 的白粉病病原菌分生孢子悬浮液。
植株长出3~4片真叶后分别利用0.05 mmol·L-1 MeJA、0.03 mmol·L-1 ABA和 0.01 mmol·L-1 MT喷洒于甜瓜叶片表面,每个处理10株苗,3次重复,无菌水作为对照。在喷施2 d后接种甜瓜白粉病菌,扣小棚保持温度在25~28 ℃、相对湿度大于90%、16 h光照/8 h黑暗。分别于接种后0、6、12、36、60、84、108、132 h进行感病率调查,并取其叶片迅速置于液氮中冷冻后放置-80 ℃冰箱中保存,为测定MAPK基因相对表达量做准备。感病率/%=感病株数/总株数×100。
MAPK引物由奥科鼎盛生物有限公司合成(表1)。采用CTAB法提取甜瓜总RNA,cDNA第一条链用PrimeScriptTMRT reagent Kit with gDNA Eraser合成試剂盒合成。以经过MeJA、ABA和MT不同时间处理的抗病和感病甜瓜叶片的cDNA为模板,PCR反应体系:模板1.0 μL,上、下游引物各0.8 μL(10 μmol·L-1,表1),dNTP Mix 10 μL(10 mmol·L-1),加 ddH2O补足至20.0 μL。PCR反应程序:95 ℃ 2 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,33个循环,72 ℃ 10 min,4 ℃保持。PCR产物利用1%的琼脂糖凝胶电泳检测。
甜瓜MAPK基因片段的荧光定量PCR扩增反应体系:SYBR 10.0 μL,上、下游引物各0.8 μL,加入7.4 μL ddH2O补至19.0 μL,计算做出荧光定量试剂混合样品,之后将混合样分装到96孔板中,每孔19.0 μL,每孔加入1.0 μL cDNA模板,每个处理的cDNA模板2次重复,覆膜离心混匀,反应程序:95 ℃预变性30 min,95 ℃变性10 min,59 ℃退火 30 min,95 ℃延伸10 min,65 ℃ 5 min,95 ℃ 5 min。
1.3 数据处理与分析
采用DPS 19.0数据处理软件对试验数据进行处理,并利用Excel 2003对数据进行作图。
2 结果与分析
2.1 外源信号分子诱导处理后对2个甜瓜品种白粉病感病率的影响
由图1可知,首先是抗病甜瓜品种感病率远低于感病甜瓜品种,随着白粉病菌接种时间的延长,感病品种感病率一直呈现上升趋势,在132 h时,感病率达到96.67%,而抗病品种感病率为43.33%。在3个不同外源信号分子处理后,2个甜瓜品种的感病率与对照相比均有不同程度降低,不同外源信号分子处理对甜瓜白粉病的抗病效果不同,总体表现出一定的时间效应,表明MeJA、ABA、MT具有提高甜瓜白粉病抗性的作用。其中,MeJA处理下的抗病甜瓜品种感病率明显低于对照,且随着处理时间延长,感病率变化不大,趋势平稳,MeJA处理下的感病甜瓜品种感病率明显低于对照,且随着处理时间延长,感病率呈现上升趋势,MeJA处理后,对甜瓜白粉病的抗病效果诱导较佳,强于ABA、MT诱导效果,说明MeJA处理有助于提高甜瓜白粉病的抗性。
2.2 抗病和感病甜瓜叶片在不同外源信号分子诱导下MAPK基因表达量分析
经外源诱导处理后,抗病甜瓜品种‘Edisto47中MAPK21基因表达出现差异。对于每一个基因,相同时间点的处理组的表达量是对照组的3倍以上则差异显著,如果它们之间的表达量差异为5倍及以上时,则差异极显著[12]。由图2可知,接种后立即测定MAPK21基因的表达量,CK表达量为2.30,随着接种时间的延长,CK的MAPK21基因表达量出现上调趋势,在接种36 h后表达量达到最高,其表达量为33.74,接种60、84、108和132 h变化趋势比较平稳,说明MAPK21基因响应甜瓜白粉病菌胁迫处理。
用MeJA、ABA和MT处理接种白粉病菌的材料后立即测定MAPK21基因的表达量,其表达量分别为对照组的9.52倍、5.28倍和5.37倍,差异极显著;随着处理时间的延长,3个处理的MAPK21基因的表达量均出现上调趋势,均在36 h后达到最高,MeJA处理为CK的3.87倍差异显著,但ABA和MT处理分别为对照组的2.36倍和1.77倍,差异不显著,说明MeJA处理诱导MAPK21基因上调表达效果显著。
经外源诱导处理后,感病甜瓜品种‘哈密加格达中MAPK21基因表达出现差异。由图3可知,接种后立即测定MAPK21基因的表达量,CK表达量为0.27,随着接种时间的延长,CK的MAPK21基因表达量出现上调趋势,在接种60 h后达到最高,其表达量为1.13,接种84、108、132 h出现下降趋势,趋势变化比较大,说明感病品种中MAPK21基因也响应甜瓜白粉病菌胁迫处理,但是表达量远远低于抗病品种。
用MeJA、ABA和MT处理接种白粉病菌的材料后立即测定处理表达量,其中MeJA处理MAPK21基因表达量为CK的15.96倍,差异极显著;而ABA处理和MT处理表达量为CK表达量的4.85倍,差异显著。随着处理时间的延长,3个处理的MAPK21基因的表达量均在处理60 h后达到最高,各处理的MAPK21基因的表达量分别为对照组的25.95倍、8.78倍和5.26倍,都超过对照组的5倍以上,差异极显著,但是MeJA处理表达量最高,说明MeJA处理诱导感病甜瓜品种后MAPK21基因上调表达效果最显著,结合图2结果发现,MeJA处理甜瓜品种,有助于MAPK21基因表达调控,提高其抗白粉病的能力。
对比图2和图3可以看出,3个处理诱导2个不同甜瓜品种的MAPK21基因相对表达量达到峰值的时间不同,抗病甜瓜品种均在36 h出现最高相对表达量,而感病甜瓜品种均在60 h才出现;MeJA处理的抗病甜瓜品种在36 h出现最高相对表达量为130.74,感病甜瓜品種在60 h出现最高相对表达量为29.32,抗病甜瓜品种MAPK21基因相对表达量是感病甜瓜品种的4.46倍,说明抗病甜瓜品种基因调控表达能力强。
由图2和图3还可以看出,MeJA、ABA和MT处理抗病甜瓜品种60、84、108、132 h后,抗病甜瓜品种MAPK21基因相对表达量变化趋势比较平稳,说明抗病品种有助于防御白粉病菌,而处理的感病甜瓜品种84、108、132 h后,MAPK21基因相对表达量出现下降趋势,说明随着时间的延长,感病品种基因调节抵御白粉病菌的能力下降。
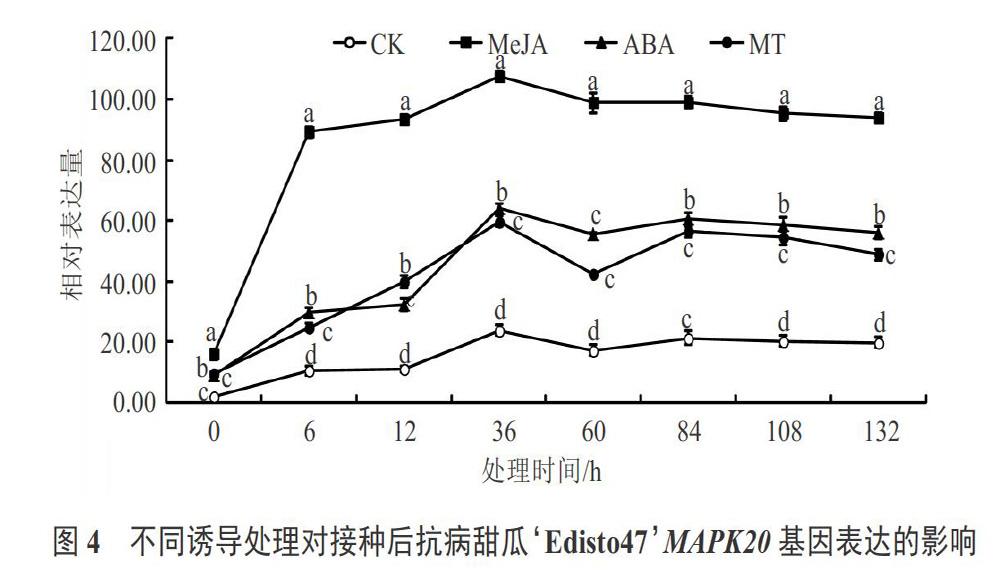
经外源信号分子诱导处理后,抗病甜瓜品种‘Edisto47和感病甜瓜品种‘哈密加格达中MAPK20基因和MAPK9基因表达变化趋势同MAPK21基因,也出现上调趋势(见图4~7),说明这2个基因对于甜瓜白粉病抗性方面也具有一定的响应性,但MeJA处理后的2个基因相对表达量高于ABA处理和MT处理。另外由图2~7对比可知,MeJA处理的抗病甜瓜品种MAPK21、MAPK20和MAPK9的相对表达量较高量分别为130.74、107.74和99.71,而用MeJA处理感病甜瓜品种MAPK21、MAPK20和MAPK9的相对表达量较高量分别为29.32、18.35和17.34;ABA和MT 2个处理也是同样的变化趋势,因此2个试验材料经过接种白粉病菌对比发现,抗病甜瓜品种MAPK21基因、MAPK20基因和MAPK9基因相对表达量远远高于感病品种;3个处理后同一品种中MAPK21基因相对表达量远远高于MAPK20基因和MAPK9基因。
3 讨论与结论
植物激素是植物在特定环境下细胞在代谢过程中产生的一类小分子物质,主要有SA、MeJA、ACC和ABA等。近年来,大量研究表明植物生长发育过程中受到病原菌的侵害时植株会产生激素调控与生物胁迫信号传导途径互作,调控植物应答生物胁迫的抗性,如:MeJA对甜瓜枯萎病[14]、人参锈病[15]、辣椒青枯病[16]等的抗性效果显著;ABA提高植物对病原菌敏感性的主要原因尚不清楚,但是研究表明,增加ABA含量能够提高植物对病菌的抗性,经ABA处理的烟草能够在一定程度上提高对病毒的抵抗能力[17];MT能够降低由盘二孢属引起的苹果斑点病[18]。该试验利用MeJA、ABA和MT处理感病甜瓜‘哈密加格达和抗病甜瓜‘Edisto47并统计发病率,结果表明,不同外源信号分子处理对甜瓜白粉病的抗病效果不同,总体表现出一定的时间效应,MeJA、ABA、MT具有提高甜瓜白粉病抗性的作用,都具有调控植物应答生物胁迫抗性的潜能。
抗逆性和抗病性是植物与环境胁迫及病原菌相互适应、相互选择的结果。基因的表达除了受组织特异性影响外,还会随着环境的生物或非生物胁迫而改变。MAPK是通过将胞外信号逐级放大并传递至细胞内并且得到响应的重要蛋白激酶,其在植物的生物和非生物胁迫响应中发挥着极为重要的作用,不仅可以通过磷酸化修饰被激活,而且在mRNA水平上也可以被激活。研究发现,ClMPK7很有可能同时参与了西瓜组织受干旱、高温及枯萎病原菌诱导的多条不同的信号转导途径,并在其中扮演关键角色[11];当葡萄受到胁迫诱导后,VvMKK2,VvMKK3和VvMKK4表现出差异性上调,可能实现不同的功能并参与不同信号通路,VvMKK2,VvMKK4和VvMKK6这3 种基因在拟南芥中的过量表达提高了植株的抗盐和干旱胁迫能力[19];AhMAPK13基因可能参与花生受干旱、低温、NaCl等非生物胁迫及JA、GA、ET、SA等激素介导的抗逆信号转到途径[20]。为了更进一步了解MeJA、ABA、MT调控甜瓜MAPK基因应答白粉病菌抗性作用,该试验采用实时定量PCR方法,对甜瓜MAPK基因家族成员在激素胁迫下的表达模式进行分析。结果表明,甜瓜品种中MAPK 3个相关基因MAPK21、MAPK20、MAPK9在接种白粉病菌后基因都呈上调表达,但表达量出现差异,抗病甜瓜品种3个MAPK基因相对表达量高于感病甜瓜品种,MAPK21基因相对表达量高于MAPK20和MAPK9。3个MAPK基因对MeJA、ABA、MT 3个胁迫因子的重叠表达特性,说明这3个基因有可能不同程度的参与了多个信号转到途径,在这些信号途径中扮演着重要的角色,其调控作用机制还有待深入研究。
甜瓜白粉病是瓜类作物上广泛发生的重要病害,抗白粉病基因的挖掘是目前研究的热点,筛选甜瓜优异抗病基因资源用于抗病新品种的培育,这样有利于从根本上解决甜瓜白粉病病害的有效途径。笔者主要分析了MeJA、ABA、MT 3个胁迫因子诱导抗病和感病甜瓜叶片中MAPK基因的表达模式,初步判断其在甜瓜叶片中的表达模式,MAPK级联途径在植物的生物和非生物胁迫响应中发挥着极为重要的作用,今后可以进一步深入明确抗白粉病相关基因是如何通过信号转导途径调控对白粉病的抗性及家族基因扮演的角色和它们之间蛋白互作的分子机制。
参考文献
[1] 新疆甜瓜资源调查组.新疆甜瓜西瓜志[M].乌鲁木齐:新疆人民出版社,1985.
[2] 崔浩楠,朱强龙,朱子成,等. 甜瓜白粉病及其抗性分子遗传研究进展[J].中国瓜菜,2018,31(3):1-7.
[3] WANG X L,LI G,GAO X W,et al.Powdery mildew resistance gene(Pm-AN)located in a segregation distortion region of melon LGV[J]. Rui Han in Euphytica,2011,180(3):421-428.
[4] TAKAHASHI Y ,SOYANO T,KOSETSU K,et al.HINKEL kinesin, ANP MAPKKKs and MKK6/ANQ MAPKK,Which phosphorylates and activates MPK4 MAPK,constitute a pathway that is Required for cytokinesis in Arabidopsis thaliana[J].Plant ﹠ Cell Physiology,2010,51(10):1766-1776.
[5] ZHAO F Y,HU F, ZHANG S Y,et al.MAPKs regulate root growth by influencing auxin signaling and cell cycle-related gene expression in cadmium-stressed rice[J]. Environmental Science and Pollution Research,2013,20(8):5449-5460.
[6] JONAK C,?KR?SZ L,B?GRE L,et al.Complexity, cross talk and integration of plant MAP kinase signaling[J].Current Opinion in Plant Biology,2002,5(5):415-424.
[7] 張兴坦.烟草MAPK基因的功能研究[D].重庆:重庆大学,2015.
[8] 王洁.植物MAPK级联途径基因家族的进化分析及番茄SlMPK13的功能鉴定[D].杭州:浙江大学,2015.
[9] ZHOU H Y,REN S Y,XING Y,et al.Identification and analysis of mitogen-activated protein kinase (MAPK) cascades in Fragaria vesca[J].International Journal of Molecular Sciences,2017,18(8):1766.
[10] WANG J,PAN C T,WANG Y,et al.Genome-wide identification of MAPK,MAPKK,and MAPKKK gene families and transcriptional profiling analysis during development and stress response in cucumber[J].BMC Genomics,2015,16(1):386.
[11] 宋秋明.西瓜MAPK和MAPKK家族基因的鉴定、表达模式和功能分析[D].杭州:浙江大学,2015.
[12] 于莹,陈宏宇,程莉莉,等.亚麻MAPK基因克隆及盐碱胁迫下的表达分析[J].东北农业大学学报,2015(3):21-28.
[13] 辛董董,李桂荣,郭卫丽,等.甜瓜MAPK基因的表达分析[J].北方园艺,2018(24):21-26.
[14] 郭海艳,刘璐,孙宇蛟,等.3种外源诱导剂预处理对甜瓜抗病特征及其Fom-2和CHT基因表达的影响[J].西北植物学报,2018,38(5):0894-0901.
[15] 傅俊范,盘柳依,陈明,等.茉莉酸甲酯诱导人参抗锈腐病的生理机制[J].吉林农业大学学报,2012,34(4):381-384.
[16] 赵显阳,向妙莲,曾晓春,等.茉莉酸甲酯对辣椒抗青枯病的诱导效应及抗氧化酶活性的影响[J].植物保护学报,2018,45(5):1103-1111.
[17] 周金鑫,胡新文,张海文,等.ABA在生物胁迫应答中的调控作用[J].农业生物技术学报,2008,16(1):169-174.
[18] YIN L,WANG P,LI M,et al.Exogenous melatonin improves malus resistance to marssonina apple blotch[J].Journal of Pineal Research,2013,54(4):426-434.
[19] 王刚.葡萄MAPK类基因家族的鉴定、表达分析及部分基因的功能验证[D].南京:南京农业大学,2014.
[20] 梁丹,张朝昕,王冕,等.花生MAPK13基因的克隆及表达分析研究[J].花生学报,2019,48(2):10-18.

