西瓜SSR标记中不同类型样品的DNA提取分析
孙波 王兴辉 吴勇 刘中阳 罗琳 曾健强 刘泽发 孙小武


摘 要: 为实现西瓜品种纯度的室内快速检测,笔者对西瓜的真叶、子叶、种芽和种子进行了DNA提取,比较了不同类型样品提取DNA的质量与浓度差异,并研究了从不同类型样品中提取的DNA对于SSR-PCR的影响。结果表明,不同类型样品中提取的DNA浓度与质量的大小排序均为:真叶>子叶>种芽>种仁,其DNA浓度之间具有显著性差异。将上述材料中提取的DNA作为模板进行了SSR-PCR扩增分析,发现以上4组DNA模板均能扩增出清晰可见的目标条带,表明从种仁中可直接提取DNA进行SSR分子标记纯度检测。因此在室内用SSR分子标记检测品种纯度时可省略催芽育苗阶段,从而提升检测效率,节省时间。
关键词: 西瓜; SSR标记; 种子; DNA提取
Abstract: In order to achieve rapid indoor identification of variety purity, in this study, the DNAs from true leaf, cotyledon, seedlings and seed of watermelon were extracted respectively, and the quality and concentration of them were compared, their influence for SSR-PCR were researched. The results showed that the concentration and quality of the extracted DNA were ranked as follows: true leaf > cotyledon > seedlings > seed, and the DNA concentration was significantly different. The DNAs extracted from the above materials was used as templates for SSR-PCR analysis respectively. They can all achieved the target band, indicating that the DNA extracted from the seed can be also used for SSR markers. Therefore, in the purity identification of watermelon cultivar by using SSR method, the germination and seedling stage can be omited, and the efficiency can be improved greatly and much time will be saved.
SSR標记技术在真核生物中具有普遍性[1],且被广泛应用于作物DNA指纹图谱的构建、遗传连锁图谱的绘制和基因定位等方面。该技术对品种的DNA质量浓度要求较低,种属特异性强,多态性丰富,而且可以鉴别纯合子和杂合子,结果相对可靠,省时省力,应用价值非常大。据统计,在品种鉴定中被应用次数最多的便是SSR标记技术[2]。在西瓜品种纯度检测方面,SSR标记技术的应用也较为广泛。张佩伦等[3]筛选出7对SSR引物对4份优质西瓜杂交种进行了纯度鉴定,刘子记等[4]则利用分布于西瓜不同染色体的SSR标记鉴定了小果型西瓜‘美月的纯度。上述研究者均是通过育苗提取西瓜叶片DNA来进行纯度鉴定。这也是目前大部分学者的普遍做法,即以西瓜真叶为材料提取DNA以满足分子标记的要求[5-7],但西瓜从浸种催芽到第1片真叶展开需10 d左右,因此通过真叶提取DNA对于材料为西瓜种子的样品来说程序比较繁琐。所以,有必要对西瓜DNA的提取部位进行探索,从而提高室内品种纯度检测的效率。刘泽发等[8]认为,西瓜的发芽根尖细胞内脂肪和叶绿素等含量非常少,适合作为快速提取DNA的材料,从中提取的DNA适用于SRAP标记,因此在进行纯度检测时只需要将种子催芽即可,无需育苗,缩短了室内检测纯度的时间。王吉明等[9]对不同类型的西瓜样品材料提取的DNA进行了研究,发现从西瓜种仁中提取的DNA可以顺利进行dCAPS扩增和酶切,这为西瓜品种纯度的室内快速检测提供了参考。在西瓜品种室内的纯度检测中,西瓜种子是最直接也最容易获得的材料,因此对种仁中提取的DNA是否适用于SSR标记进行探究具有重要意义。
笔者对西瓜的真叶、子叶、种芽、种仁进行了DNA提取,研究了各样品提取DNA的质量浓度差异,并探究了各DNA对于SSR-PCR的影响。
1 材料与方法
1.1 材料
‘雪峰黑媚娘有籽西瓜品种,由邵阳市农业科学研究院提供。试验于2018年1—3月在邵阳市农业科学研究院生物中心实验室完成。
1.2 方法
1.2.1 材料收集 取3粒‘雪峰黑媚娘种子直接去壳后用灭菌镊子将种仁取出分别放入离心管内。另取9粒‘雪峰黑媚娘种子在50 ℃温水中浸种3 h,置于30 ℃条件下催芽。出芽后将其中6粒进行播种育苗,另外3粒继续催芽,芽长3 cm左右时[8],用灭菌剪刀将种芽剪下放入离心管内。播种的种子成苗后分别用灭菌剪刀剪下真叶和子叶放入离心管内。种仁、种芽、子叶和真叶每种类型的材料各取3份。
1.2.2 DNA提取方法 DNA的提取采用天根生物公司的植物DNA提取试剂盒(货号DP320)结合高通量组织研磨器进行。
1.2.3 DNA质量浓度测定 DNA的浓度及质量通过微量核酸蛋白分析仪和琼脂糖凝胶电泳进行测定,并利用DPS软件进行数据处理分析。
1.2.4 SSR-PCR扩增 以不同类型材料的DNA为模板进行SSR-PCR扩增,以比较各DNA对于SSR分子标记扩增的影响。引物选用国家蔬菜工程中心[10]发表的SSR核心引物BVWS02048,上游引物序列为5-TCTGTGTGGATGCAAATGGT-3,下游引物序列为5-GCTAATCGAGCCCAGTTACG-3,目标片段长度为249 bp。扩增产物电泳后置于凝胶成像仪内观察结果,比较各样品提取的DNA扩增效果。反应体系:总体系[11]为20 μL,其中10×Taq Buffer 2 μL(Mg2+含量为15 mmol·L-1),2.5 mmol·L-1的dNTPS加1.6 μL,Taq酶含量为1 U,10 μmol·L-1的上下游引物各1 μL,DNA模板1 μL,加超纯水补足至20 μL。扩增程序:设置PCR仪的扩增程序为:94 ℃预变性4 min,94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸90 s,35次循环,72 ℃延伸5 min。10 ℃保存。扩增产物利用2%的琼脂糖凝胶进行电泳检测。
2 结果与分析
2.1 不同类型西瓜样品所提取DNA的浓度比较
由表1可知,以真叶为材料提取的DNA浓度最高,平均浓度为814.561 ng·μL-1,可能是由于真叶的细胞分裂最旺盛,因此DNA含量最高。其次为子叶和种芽,子叶的平均质量浓度为526.493 ng·μL-1,种芽的平均质量浓度为238.487 ng·μL-1。子叶的细胞分裂频率小于真叶,DNA含量次之;种芽内可能含有较多的液泡和木质化的导管,所以DNA含量相对较少。质量浓度最低的是种仁,仅为118.177 ng·μL-1,其富含氨基酸和脂肪酸,所以DNA的提取浓度最低。西瓜真叶、子叶、种芽、种仁提取的DNA浓度差异显著,种芽与种仁的DNA浓度之间差异未达到极显著水平。
2.2 不同类型西瓜样品所提DNA质量的比较
由表2可知,从真叶、子叶、种芽提取DNA的OD260/280均在1.8~2.0之间,说明提取的DNA质量较好,从种仁提取DNA的OD260/280均低于1.8,说明有蛋白质等其他杂质残留。所有DNA样品的OD260/230均大于2.0,说明从各材料中提取的DNA均没有碳水化合物、多肽和苯酚等污染物。
由如图1可以看出,从真叶、子叶、种芽所提取的DNA条带清晰明亮,从种仁提取的DNA有拖尾现象,说明含有蛋白质、酚类等杂质,这可能是由于种仁中含有较多的脂肪酸和氨基酸等物质影响了DNA的提取质量[12]。条带的亮度与DNA浓度呈正相关,亮度排序为真叶>子叶>种芽>种仁,这与微量核酸蛋白分析仪的浓度测量结果一致。
2.3 不同西瓜样品所提DNA对SSR-PCR扩增效果的影响
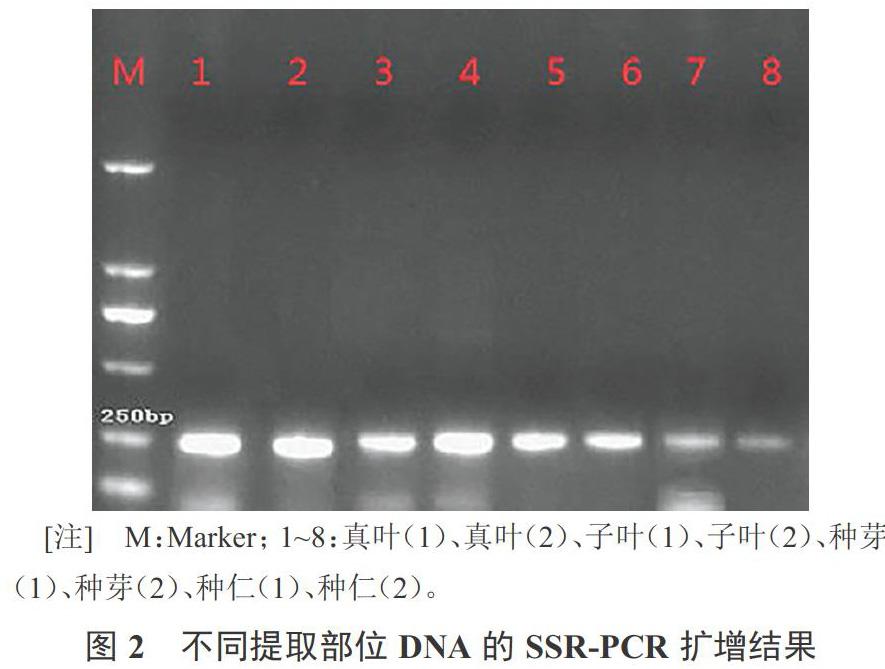
由图2可知,所有DNA模板经扩增后均在249 bp处出现了目标条带,以真叶、子叶的DNA为模板的PCR扩增条带较亮,读取条带非常直观。以种芽DNA为模板的扩增条带清晰,效果较好。以种仁DNA为模板的扩增条带较暗,但并不影响条带的读取,且DNA中残留的杂质对SSR-PCR扩增没有明显影响。说明从西瓜真叶、子叶、种芽、种仁提取的DNA均可用于SSR-PCR的扩增。
3 討论与结论
目前利用分子标记技术对西瓜品种进行纯度检测的方法已较为成熟[13-15],这与传统的田间纯度检测相比进步巨大,而SSR分子标记技术在品种鉴定中应用广泛[2],因此很有必要对室内SSR分子标记纯度的检测效率进行研究。DNA的质量与浓度会影响后续分子生物学等研究的操作效果[16]。而SSR技术对样品DNA质量和浓度要求并不高,因此在对西瓜品种进行室内纯度检测时,如何提升DNA的提取效率从而缩短检测时间对于种企按时销售种子较为关键。国内许多生物技术公司开发了直扩试剂盒,将样品置于裂解液中加热几分钟,即可以裂解液为模板进行扩增,省去了DNA提取时磨样等繁琐步骤,但此试剂盒价格较贵,将其直接应用至种企的纯度鉴定中并不现实。北京市农林科学院及一些生物检测公司在种子纯度鉴定方面取得了较大进展,其通过第一代测序仪、KASP技术可对品种纯度进行快速准确、高通量的检测,但目前在国内尚未推广开来。
笔者对西瓜品种真叶、子叶、种芽及种仁做了DNA提取质量的比较,探究了各类型样品所提取的DNA的浓度和质量差异。研究发现,在相同的提取方法下,从真叶中提取的DNA浓度最高,种仁中提取的DNA浓度最低且含有杂质,这和王吉明等[9]研究结果一致。通过和以往的液氮研磨提取DNA相比较后发现,高通量组织研磨器提取的DNA浓度普遍偏低,可能是由于研磨仪内小钢珠通过击打来破碎组织的效果没有加液氮研磨破碎的效果好。对各DNA模板SSR-PCR扩增后的效果进行了比较,发现以西瓜真叶、子叶和种芽的DNA为模板时扩出的条带明亮清晰,无明显差异,以种仁DNA为模板扩出的条带较暗,但是并不影响条带的读取。王吉明等[9]还对干燥真叶、新鲜真叶、种芽、下胚轴、子叶和种子所提取的的DNA进行了dCAPS扩增及酶切,发现所有样品DNA的扩增效果无明显差异,可以满足dCAPS酶切要求,说明从种仁中提取DNA基本可以满足一般的分子生物学试验。因此,在利用SSR技术构建DNA指纹图谱或进行纯度鉴定时,如若样品材料不多且时间充分,可以育苗通过真叶或者子叶提取的DNA为模板,时间紧张时也可催芽以提取种芽的DNA为模板,以便更好地观察扩增后条带之间的差异。但是纯度鉴定在种企或者检测中心等单位的实际应用中需要快速大批量提取样品DNA,如采用SSR分子标记来进行检测,则可以利用高通量自动研磨仪直接对种子进行研磨,研磨充分后利用排枪加提取液提取种仁DNA,这样可大大减少工作量,提高工作效率,并且单人可完成所有过程。
参考文献
[1] TAUTZ D,RENZ M.1984,Simple sequences are ubiquitous repetitive components of eukaryotic genomes[J].Nucleic Acids Res,1984,12(10):4127-4138.
[2] 王立新,常利芳,李宏博,等.小麦区试品系DUS测试的分子标记[J].作物学报,2010,36(7):1114-1125.
[3] 张佩伦,郭禄芹,胡倩梅,等.利用SSR标记快速鉴定西瓜杂交种纯度[J].中国瓜菜,2018,31(5):16-19.
[4] 刘子记,詹园凤,朱婕,等.利用SSR标记鉴定西瓜杂交种纯度的研究[J].热带作物学报,2016,37(9):1714-1718.
[5] 周贤达,王凤辰,周桂林,等.西瓜杂交种纯度SSR分子鉴定技术研究[J].中国瓜菜,2012,25(5):13-16.
[6] 高磊,赵胜杰,路绪强,等.利用SSR标记对西瓜果肉硬度性状的连锁分析[J]. 植物遗传资源学报,2016,17(5):866-870.
[7] 羊杏平,刘广,侯喜林,等. 西瓜核心种质枯萎病抗性与SRAP分子标记的关联分析[J]. 园艺学报,2013,40(7):1298-1308.
[8] 刘泽發,孙小武,董亚静.SRAP标记鉴定西瓜种子纯度方法研究[J].中国瓜菜,2009,22(1):5-8.
[9] 王吉明,尚建立,李娜,等.西瓜不同类型样品的DNA提取研究[J].中国瓜菜,2016,29(11):11-13.
[10] ZHANG H Y,WANG H,GUO S G,et al.Identification and validation of a core set of microsatellite markers for genetic diversity analysis in watermelon,Citrullus lanatus Thunb.Matsum.& Nakai[J].Euphytuca,2012,186(2):329-342.
[11] 张海英,许勇.十大技术之一(一)西瓜资源与品种核酸指纹鉴定关键技术[J]. 中国瓜菜,2013,26(5):63-65.
[12] 张玉秀,赵文明. 籽瓜种子营养成分研究:Ⅱ籽瓜种子脂肪酸成分分析[J]. 中国西瓜甜瓜,1992,5(2):18-19.
[13] 张佩伦. 西瓜杂交种纯度快速鉴定及杂交制种技术的研究[D]. 郑州:河南农业大学,2018.
[14] 孙波,邹甜,王志伟,等. 利用SSR技术鉴定西瓜品种纯度[J]. 中国瓜菜,2018,31(6):16-19.
[15] 李超汉,刘莉,刘翔,等. 基于SSR标记的5个西瓜新品种纯度鉴定及特异性分析的研究[J]. 中国农学通报,2015,31(33):177-185.
[16] 吴艳艳,代德艳,蔡春梅. 一种改良的大豆DNA提取方法[J]. 大豆科学,2015,34(1):112-115.

