UPLC-MS/MS法测定食品中的4种木酚素
肖伟敏,王奇,董珊,苏佳婷,彭祖茂,张协光∗
深圳市计量质量检测研究院,国家营养食品质量监督检验中心(广东)(深圳 518109)
木酚素是一类有苯丙素氧化聚合而成的天然化合物,属于植物雌激素,与人体雌激素十分相似,具有弱激素和抗雌激素双向调节功能,以及非常高的抗氧化活性,在抗癌、保护心血管、治疗糖尿病等方面有良好效果[1-6]。已报道的木酚素物质主要有亚麻木酚素(SDG)、开环异落叶松脂醇、落叶松脂醇、马台树脂醇、芝麻素、芝麻林素、芝麻酚等,其中SDG、芝麻素、芝麻林素、芝麻酚的含量较高,亚麻籽中SDG的含量可达0.5%~1%;芝麻中芝麻素和芝麻林素的含量为0.5%~1%;谷物、蔬菜、水果等食品的木酚素含量较低[7]。含木酚素食品的日常摄入对人类慢性病有潜在的有益作用[8],因此针对食品中有生物活性的木酚素类营养成分,建立相关物质的检测方法对于建立食品营养成分数据库、进行营养膳食补充指导以及开发木酚素营养保健食品均具有重要意义。
随着木酚素类物质在营养食品、保健食品等领域的开发应用,相关营养保健食品在英国、美国等均已面市多年;一些复合营养食品如枸杞山药芝麻粉、植物益生元八珍粉等,均含有亚麻木酚素和芝麻木酚素类物质,但目前国内还缺乏该类产品的质量技术支持。已报道的木酚素检测方法和标准[9-10]主要是紫外分光光度法[11]、高效液相色谱法(HPLC)分别检测SDG和芝麻木酚素[12-13],样品适用于亚麻籽、芝麻及其制品。紫外分光光度法测定干扰大,定量不准确;HPLC灵敏度达不到木酚素含量较低食品的定量水平;已报道的UPLC-MS/MS法未同时测定芝麻木酚素[14-15]。
鉴于尚未有同时检测食品中主要木酚素物质(SDG、芝麻素、芝麻林素、芝麻酚)的标准和文献报道,以及质量监管和质量技术支持的需求,试验首次建立UPLC-MS/MS同时检测食品中亚麻木酚素、芝麻酚、芝麻素、芝麻林素的方法。该方法适用范围广,准确简便,可为后期木酚素的科学研究提供有效的数据查询,为居民营养膳食提供科学指导,并能促进相关基础应用和临床应用的研究发展,更为后期国家标准的建立和市场产品监督提供足够的技术支持。
1 试验部分
1.1 仪器与试剂
超高效液相色谱仪(美国Thermo Fisher Scientific Ultimate 3000);三重四级杆质谱仪(美国Thermo Fisher Scientific TSQ Quautis);分析天平(Sartorius,感量0.1 mg)。
亚麻木酚素、芝麻素、芝麻林素标准品(购自安谱,纯度≥98.8%);芝麻酚标准品(购自CATO,纯度99.9%);4种木酚素的化学信息见表1。氢氧化钠和无水乙醇为分析纯,甲醇和甲酸为色谱纯;芝麻香油(自制);其余样品市售。
1.2 试剂配制
70%乙醇:量取70 mL无水乙醇加水稀释至100 mL,混匀。
70%乙醇-1 mol/L氢氧化钠溶液:称取20 g氢氧化钠,用适量水溶解,冷却后定容至150 mL,与350 mL无水乙醇于烧杯中混匀。
盐酸溶液(10.6 mol/L):量取88 mL盐酸加水稀释至100 mL,混匀。

表1 4种木酚素的化学信息
1.3 标准溶液的配制
用甲醇配制质量浓度均为1.00 mg/mL的亚麻木酚素、芝麻酚、芝麻素、芝麻林素标准储备液,于4℃保存。然后稀释配制4种木酚素质量浓度为0.040 0,0.100,0.400,1.00,2.00和10.0 μg/mL系列标准工作液。
1.4 分析条件
1.4.1 超高效液相色谱条件
色谱柱:ACQUITY UPLC BEH C18(3.0 mm×100 mm,1.7 μm)。流动相:A为0.1%甲酸水,B为甲醇。梯度洗脱程序:0~3 min,70%~40% A;3~5 min,40%~20% A;5~9 min,20%~2% A;9~12.5 min,2% A;12.5~12.6 min,70% A;12.6~15 min,70% A。流速0.3 mL/min;柱温30℃;进样体积2 μL。
1.4.2 质谱条件
采用电喷雾离子源正离子模式(ESI+);选择反应监测(SRM)扫描;离子源电压3 500 V;蒸发温度360℃;离子传输管温度300℃;鞘气(N2)42 bar,辅助气(N2)10 bar,吹扫气0 bar。4种木酚素质谱参数见表2。
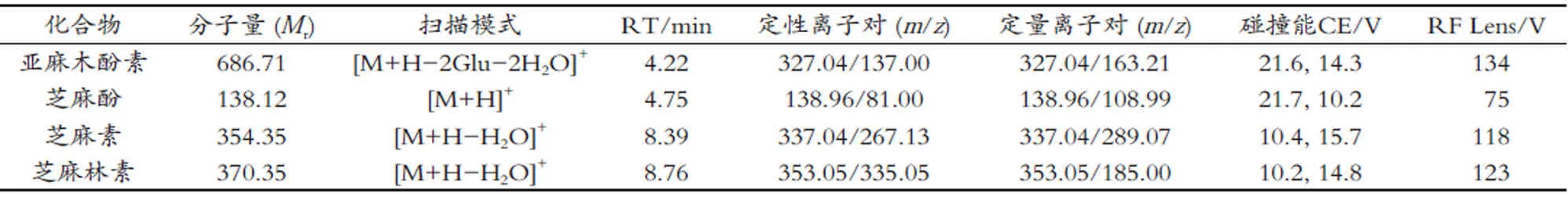
表2 4种木酚素的UPLC-MS/MS分析参数
1.5 样品前处理
1.5.1 试样制备
液体或固体粉末样品:将样品混合均匀后,立即测定或于冰箱中冷藏。
新鲜水果和蔬菜类:取500 g左右样品,用匀浆机或者粉碎机将样品均质,制得均匀性一致的匀浆,立即测定或者于冰箱中冷冻保存。
其他含水量较低的固体样品:如含水量在15%左右的谷物,取100 g左右样品,用粉碎机将样品粉碎,制得均匀性一致的粉末,立即测定或者于冰箱中冷藏保存。
1.5.2 试样处理
称取0.5~5 g混合均匀的固体试样或0.3~0.5 g油样于50 mL离心管中,加入40 mL 70%乙醇-1 mol/L NaOH水溶液,漩涡混匀;于65℃空气控温摇床上,以350 r/min振摇1 h。用10.6 mol/L盐酸将pH调至4.0~4.5,用70%乙醇水溶液定容至50 mL,摇匀,离心;取清液,用0.45 μm微膜过滤,上机。若样品中分析物的含量不在标准曲线范围内,用70%乙醇水溶液稀释后上机。
2 结果与讨论
2.1 质谱条件的优化
采用蠕动泵进样的方式,将1 μg/mL单标溶液以10 μL/min的流速连续注入ESI源中,在正离子模式下进行一级质谱全扫描,得到待测物的母离子峰。优化离子源气流、电压、温度等参数,使母离子峰的响应强度优且稳定;对母离子峰进行二级质谱扫描,确定子离子,优化碰撞能量和RF lens。优化后的质谱参数见表2。
SDG分子中含有两个葡萄糖苷单元,在ESI+模式下,产生的离子峰m/z709.17为[M+Na]+,响应弱;m/z327.04为[M+H-2Glu-2H2O]+,是SDG脱去2个葡萄糖残基(葡萄糖残基:162 Da)和2分子水的离子峰,响应较好;因此,选用m/z327.04作为SDG的母离子。m/z138.12为芝麻酚的离子峰[M+H]+。芝麻素、芝麻林素在ESI+模式下,易脱去1分子的水,形成[M+HH2O]+离子峰,分别为m/z337.04和m/z353.05。
2.2 液相色谱条件的优化
2.2.1 色谱柱的选择
试验使用了Hypersll Gold(100 mm×2.1 mm,1.9 μm)、ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm)、ACQUITY UPLC BEH C18(100 mm×3.0 mm,1.7 μm)3种色谱柱。Hypersll Gold色谱柱分离4种木酚素时,SDG及芝麻酚的峰形拖尾;使用ACQUITY UPLC HSS T3色谱柱时,各物质保留时间不稳定;而ACQUITY UPLC BEH C18色谱柱在分离4种木酚素时有较好的色谱峰和稳定的保留时间。故选择使用ACQUITY UPLC BEH C18色谱柱。
2.2.2 流动相条件的优化
试验比较了甲醇-0.1%甲酸水、乙腈-0.1%甲酸水的分离效果。结果发现,乙腈-0.1%甲酸水作为流动相时,SDG响应不稳定;而采用甲醇-0.1%甲酸水作为流动相时,4种木酚素的响应均较稳定,峰形也好(图1和图2),推测SDG在甲醇-0.1%甲酸水体系下离子化效果较好。故采用甲醇-0.1%甲酸水作为流动相。
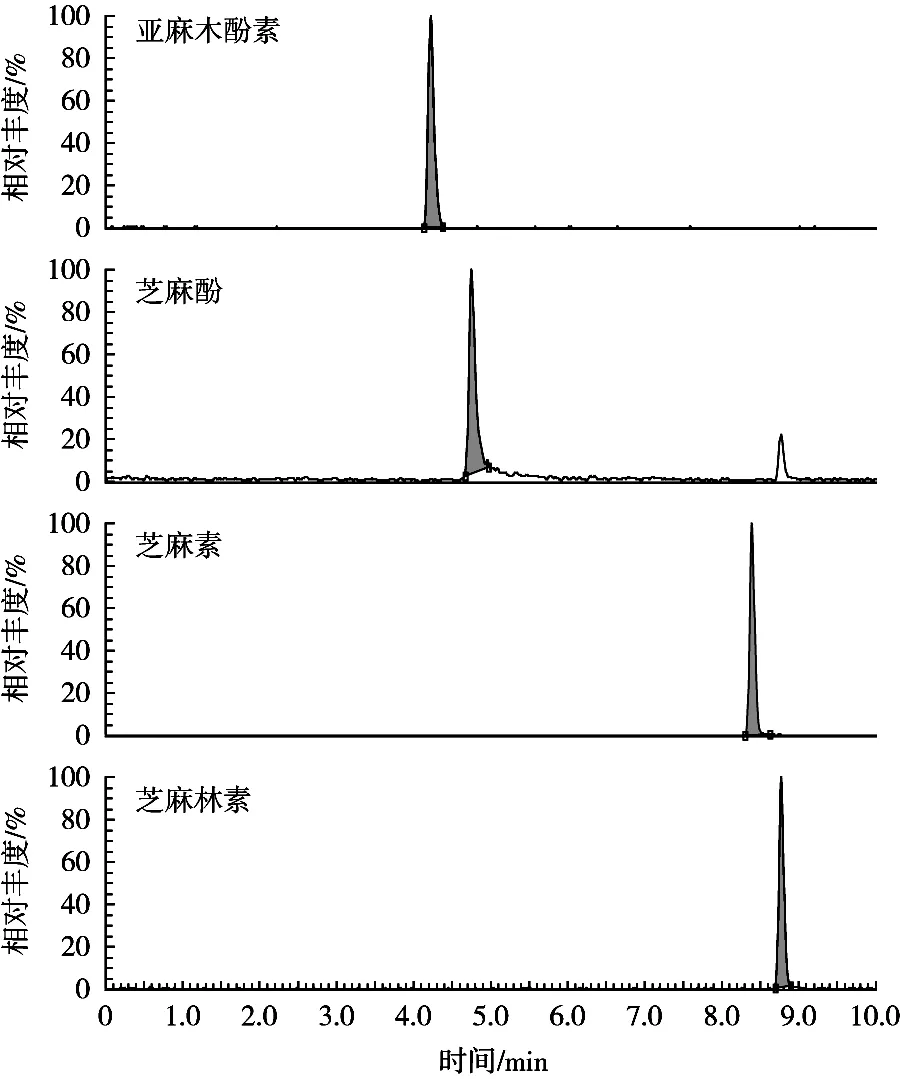
图1 4种木酚素混合标准溶液的超高效液相色谱-串联质谱图
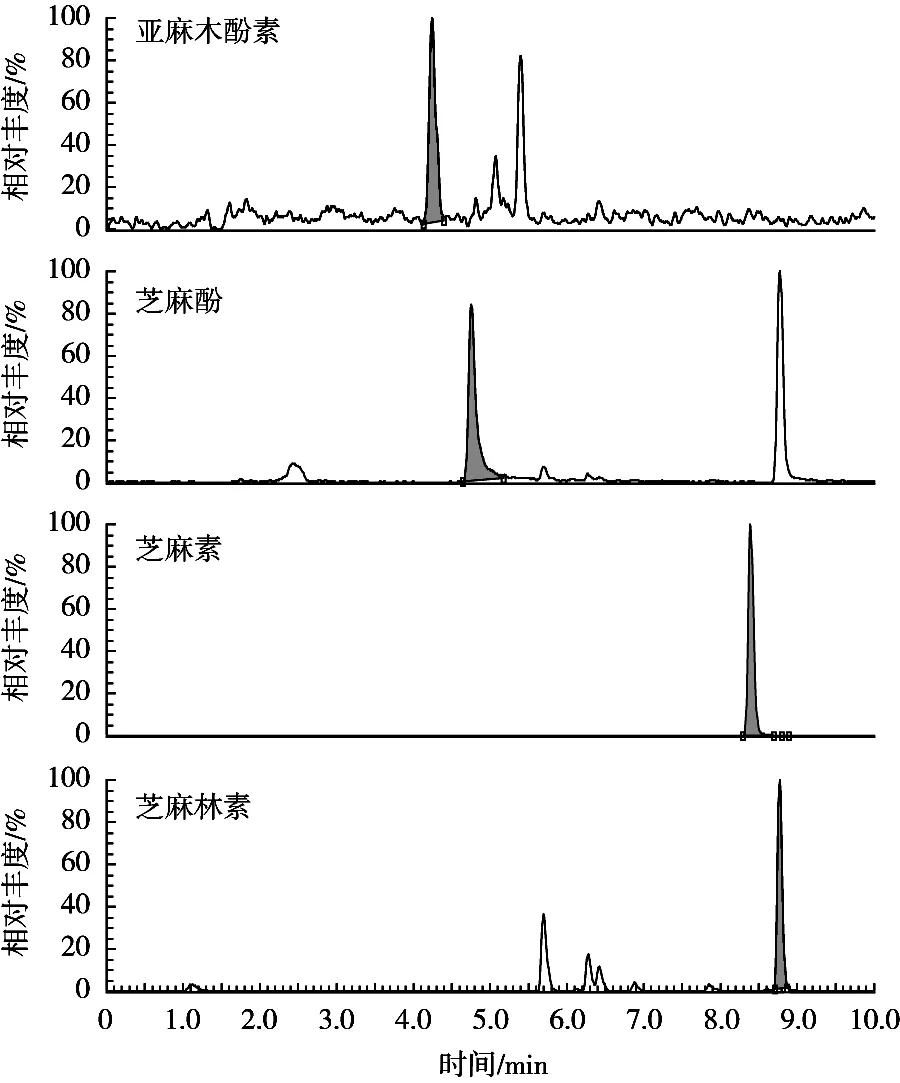
图2 植物益生元八珍粉中4种木酚素的超高效液相色谱-串联质谱图
2.3 提取条件的确定
SDG为水溶性的木酚素,在自然条件下以聚合物形式存在,只有在被碱水解后才能游离出SDG单体;有机碱甲氧基钠和三乙胺、无机碱氢氧化钠均可完成此水解过程。SDG在醇碱溶液中可以实现碱解与提取同时进行,更简便高效,提取效果更好[15-16]。芝麻素、芝麻林素、芝麻酚为脂溶性的木酚素,甲醇和乙醇亦是常用提取溶剂[17]。因此,为实现同时提取食品中的4种木酚素,并综合考虑安全性和经济性,试验选用常用的氢氧化钠进行碱解,以及更经济安全的乙醇浸提。
试验分别考察了60%,70%和80%乙醇-NaOH(1 mol/L)溶液提取亚麻籽中SDG、白芝麻中的芝麻素、芝麻林素的情况(图3)。结果表明,70%乙醇-NaOH(1 mol/L)水溶液在提取SDG、芝麻素、芝麻林素时有更好的提取率。
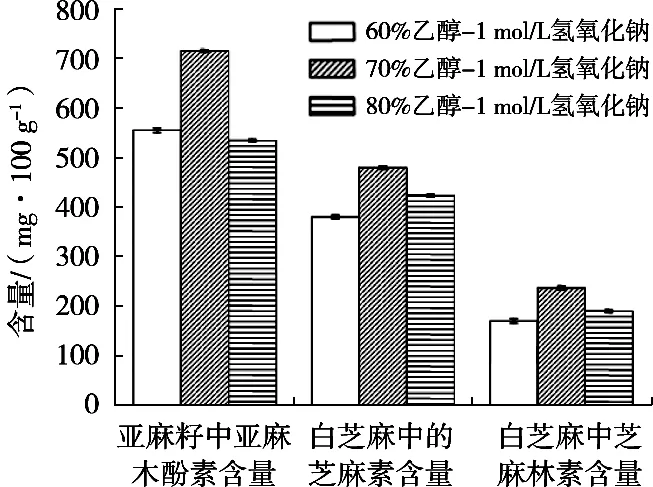
图3 乙醇比例对提取率的影响(n=3)
由于样品中SDG的提取和样品中油脂的皂化均与碱浓度大小有关。因此,试验分别用70%乙醇配制0.1,0.5,1,2和3 mol/L NaOH的提取液,考察不同碱浓度对木酚素提取的影响。亚麻籽、白芝麻中木酚素提取情况见图4。结果表明,碱浓度对SDG的提取有较大影响,1 mol/L NaOH乙醇溶液提取率最高;碱浓度增大到3 mol/L,提取率无明显变化;碱浓度对芝麻中油脂皂化有一定影响,碱浓度升到0.5 mol/L后,芝麻素、芝麻林素的提取率未有明显变化。综合考虑SDG的提取条件,确定70%乙醇-1 mol/L NaOH水溶液为最佳提取溶剂。醇碱溶液提取后的粗提液,经HCl调节pH至4~4.5,蛋白或肽类的杂质会沉淀下来,起到净化作用。
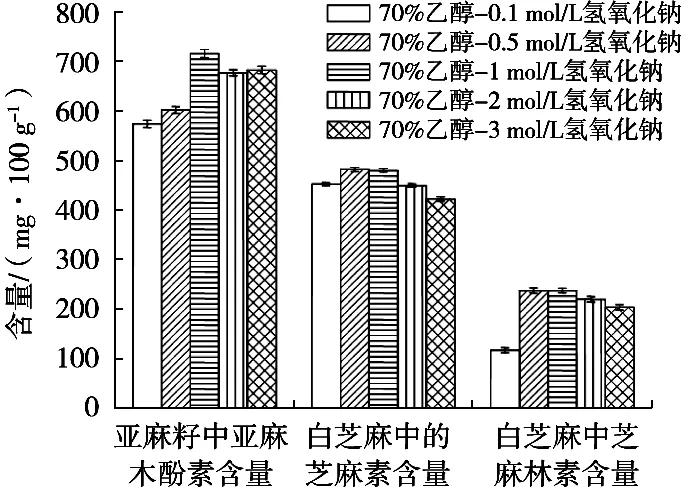
图4 NaOH浓度对提取率的影响(n=3)
2.4 线性范围、检出限与定量限
将木酚素系列标准工作液按优化方法进样,以标准系列溶液浓度为横坐标(x),以相应的峰面积为纵坐标(y)做线性回归方程;以信噪比(S/N)为3和10分别计算检测限和定量限,结果见表3。4种木酚素的相关系数R在0.999 5~0.999 9之间,线性范围在0.040 0~
10.0 μg/mL浓度范围内,各物质的线性相关性较好。
2.5 回收率及精密度试验
亚麻籽油中未检出4种木酚素成分,故试验采用亚麻籽油为空白样品进行加标,分别添加低、中、高3个水平的混合标准工作液,每个添加水平做6个平行样品,测定的回收率及精密度见表4。结果表明,4种木酚素的回收率范围均在95.0%~101%之间,RSD在1.0%~3.1%之间,回收率和精密度符合GB/T 27404—2008 F.1和F.3的要求[18]。
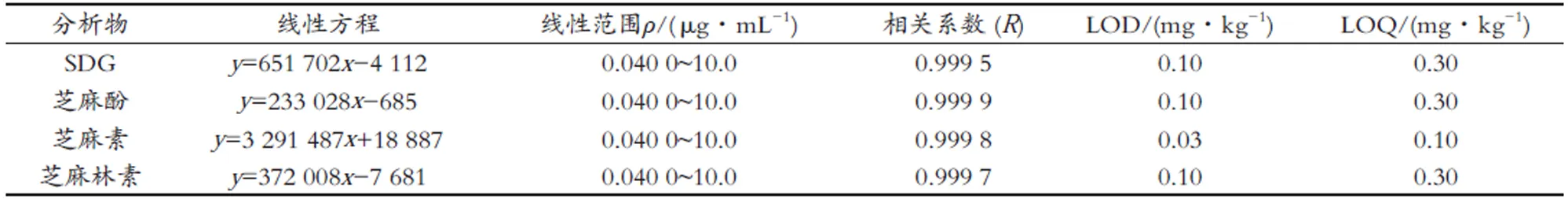
表3 木酚素的线性方程、线性范围、相关系数、检出限与定量限
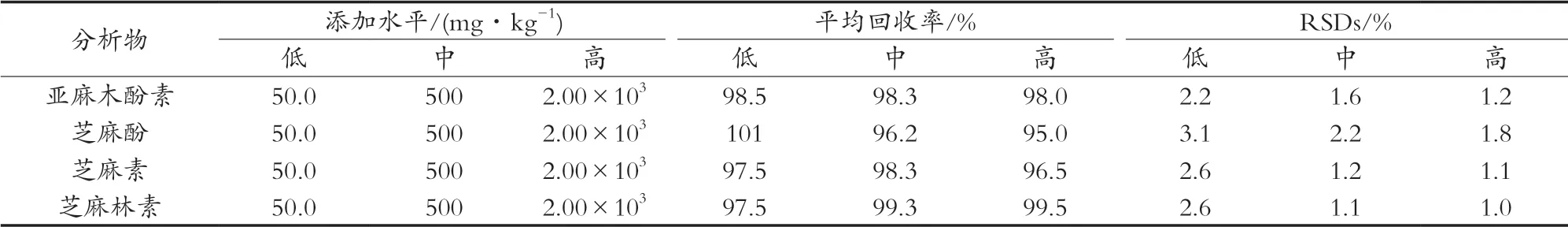
表4 4种木酚素的加标回收率和相对标准偏差(n=6)
2.6 实际样品分析
试验分别检测了亚麻籽、黑芝麻、白芝麻、芝麻油、枸杞山药芝麻酚、草莓干、茶叶、植物益生元八珍粉、木酚素软胶囊等多种类型的样品,结果见表5。结果表明,亚麻籽中SDG含量较高,亚麻籽1的含量可达8.78×103mg/kg;而6种亚麻籽油均无SDG检出,这是由于SDG是水溶性的化合物,不溶于油脂中;草莓干、山药干、茶及木酚素软胶囊保健食品中均有一定的SDG检出;芝麻及其制品中含有较高的芝麻素和芝麻林素;自制芝麻油1中芝麻素含量为7.88×103mg/kg,芝麻林素含量为3.83×103mg/kg,市售芝麻油2中芝麻素含量为2.61×103mg/kg,芝麻林素未检出,2种芝麻油中芝麻木酚素含量差异较大;枸杞山药芝麻粉、植物益生元八珍粉等复合营养食品,4种木酚素成分均有一定量的检出(见图2)。购自美国的木酚素软胶囊中检出的亚麻木酚素为110 mg/kg,比蔬果类的亚麻木酚素含量高,但比亚麻籽中的木酚素含量低约80倍。

表5 食品中木酚素的含量 mg/kg
3 结论
试验首次采用UPLC-MS/MS法同时分析食品中的4种主要木酚素物质,实现了蔬果制品、保健食品、茶叶等15个样品中SDG、芝麻酚、芝麻素、芝麻林素的定量分析。该方法为一步醇碱提取,简便高效,灵敏度高,可准确检测木酚素含量较低的食品,丰富了食品营养成分数据库。通过分析自制芝麻油1和市售芝麻油2中的芝麻素和芝麻林素,可发现芝麻油产品中芝麻素和芝麻林素的含量差异明显,芝麻木酚素可作为芝麻油的特征指标,为市场上芝麻油的掺伪掺假鉴别提供一定的技术支持。

