酸水解法提取酸浆果结合酚工艺及抗氧化活性
李成华,薛长松,于斌
通化师范学院吉林省重点实验室-长白山植物种质资源保护与利用实验室(通化 134001)
酸浆(Physali alkekengiL.)别名红姑娘、灯笼草、菇蔫儿、姑娘儿、挂金灯,原产于中国,主要分布在吉林、辽宁、黑龙江、内蒙古、四川、西藏等地,植株全身均可入药[1],其性味甘、酸,性寒,有清凉、消肿、利尿、清除自由基、抗肿瘤等功效。初步研究发现,酸浆入药部位主要含黄酮、多酚类物质[2]。植物中存在的酚类化合物可分为游离酚和结合酚。酚类化合物的分离提取的难易程度与其存在形态有关,游离酚易溶于水或有机溶剂,可直接萃取出来,结合酚需要水解破坏化学键后或水解、蒸煮等方式破坏细胞结构才可提取[3-4]。结合酚广泛分布在植物中,具有较强的抗氧化活性[5],体内研究表明,在代谢途径和生物活性方面与游离酚相比有所不同[6]。结合酚经过胃和小肠消化,经肠道微生物菌群发酵作用后,相对于游离酚,在结肠中释放并产生更强生物活性[7-8]。开展植物结合酚提取方法及评价其生物活性十分必要。Pérez-Jiménez等[9]研究表明,在水果中结合酚占比60%~90%,Wang等[10]研究表明枣籽中结合酚含量是游离酚的3倍多,结合酚的水解方法主要为碱水解和酸水解,碱水解主要破坏酯键,酸水解主要破坏糖苷键[11],苏东晓[12]、Arranze等[13]发现酸法水解得到的荔枝、小麦结合酚的含量及抗氧化能力均比减法高。
酸浆果结合酚提取工艺参数缺乏,以酸浆果为原料,采用酸水解法将结合酚从原料组织中释放,采用乙酸乙酯进行萃取,利用响应面法优化了结合酚的酸水解法提取工艺。在此基础上,对酸浆果中的游离酚和结合酚进行体外抗氧化研究。研究有利于开展酸浆果中结合酚的提取及明确其含量,对评估酸浆果结合酚的总量及生物活性研究具有重要意义。
1 材料与方法
1.1 材料、仪器及试剂
酸浆果(2017年10月采自吉林省通化市周边山上,干燥、粉碎备用)。
3-乙基苯并噻唑-6-磺酸(ABTS)、2, 4, 6-三吡啶基三嗪(TPTZ)(上海伊卡生物技术有限公司);VC、2, 6-二叔丁基对甲酚(BHT)、没食子酸对照品(批号161171-160921)(中国食品药品检定研究院);乙醇、乙酸乙酯、甲醇等(均为分析纯,天津市百世化工有限公司)。
酶标仪(Bio-Rad公司);HZQ-X100恒温震荡培养箱(大仓市实验设备厂);HH-8型恒温水浴锅(常州冠军仪器制造有限公司);RE-52AA旋转蒸发器(上海亚荣);PB-10型pH计(北京赛多利斯科学仪器有限公司)。
1.2 方法
1.2.1 游离酚提取
参照徐菲等[14]方法进行,取1 g酸浆果实粉末,加25 mL 60%的乙醇,50℃水浴锅中加热2 h,离心(4 000 r/min,20 min),过滤,保留上清液,残渣用同样方法提取2次,合并上清液,定容至5 mL,得酸浆果游离酚。
1.2.2 结合酚提取
参照鞠亚辛等[15]方法,取充分提取游离酚后的果残渣置于圆底烧瓶中,加入H2SO4溶液水解,离心(4 000 r/min,20 min),弃去残渣保留上清液,用NaOH将pH调至中性,加入20 mL乙酸乙酯萃取,萃取2次,合并萃取相,离心(4 000 r/min,20 min)。在45℃条件下旋转蒸发至干,残余物用50%甲醇超声定容至5 mL,得到果结合酚提取液,-20℃避光保存。
1.2.3 多酚含量测定
1.2.3.1 标准曲线的绘制
准确称取10.00 mg没食子酸用蒸馏水定容至10 mL,得到Ⅰ标准液,取2.5 mL Ⅰ标准液用蒸馏水定容至25 mL得到Ⅱ标准液。准确吸取Ⅱ标准液0,1,2,3,4和5 mL,Ⅰ标准液0.75,1.00和1.50 mL,用蒸馏水定容至5 mL,得到质量浓度梯度为0,20,40,60,80,100,150,200和300 μg/mL的标准使用液。
分别取上述标准使用液125 μL于试管中,加500 μL蒸馏水和125 μL福林酚,摇匀,反应6 min,加1.25 mL质量分数7% Na2CO3溶液,加入1 mL蒸馏水,20℃下避光放置1.5 h后,在波长760 nm下测定吸光度,重复3次。根据没食子酸溶液质量浓度和吸光度,绘制标准曲线,得到的回归方程为Y=4.936X-0.022 1(R2=0.999 0)。
1.2.3.2 样品多酚质量分数测定
根据1.2.3.1方法测定样品结合酚含量,多酚含量以每g质量中含没食子酸当量表示,计算如式(1)。
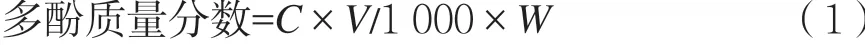
式中:C为测定的多酚质量浓度,mg/mL;V为提取液总体积,μL;W为称取样品质量,g。
1.2.4 响应面法优化酸浆果结合酚提取条件
在单因素试验基础上,选择H2SO4浓度(A)、液料比(B)、水解时间(C)、水解温度(D),利用Design-Expert 8.0.6软件优化酸浆宿萼结合酚提取条件。以结合酚提取量为响应值(Y)进行试验设计,各因素水平见表1。
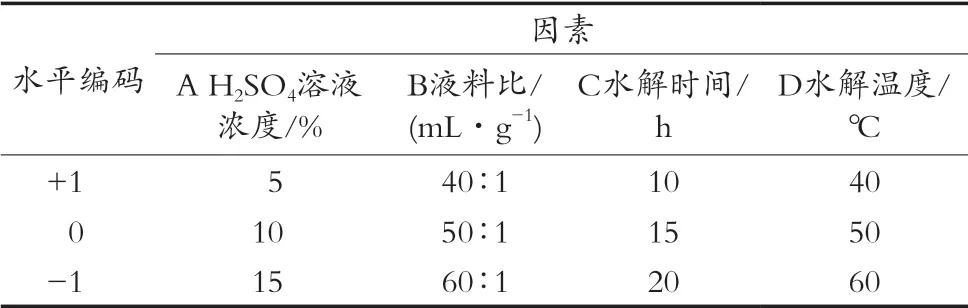
水平编码因素A H2SO4溶液浓度/%D水解温度/℃+1 5 40∶1 10 40 0 10 50∶1 15 50-1 15 60∶1 20 60 B液料比/(mL·g-1) C水解时间/h
1.2.5 抗氧化活性测定
1.2.5.1 FRAP法抗氧化活性[16-17]
FRAP溶液的制备:分别配制10 mmol/L TPTZ溶液(40 mmol/L HCl溶液为溶剂),0.3 mol/L醋酸钠缓冲液,20 mmol/L FeCl3溶液,三者体积1∶10∶1混合。
FeSO4标准曲线的制备:配制10 mmol/L FeSO4溶解,准确吸取该溶液适量,稀释成浓度0.1,0.062 5,0.125,0.25,0.50,1和2 mmol/L溶液。准确吸取各溶液10 mL,加FRAP溶液1 mL,纯水1 mL,避光反应30 min,595 nm波长测定吸光度,11 mL纯水加FRAP溶液1 mL为参比。以吸光度Y对浓度X作图,拟合得到回归方程Y=1.300 3X+0.021 3,r=0.999 8。
FRAP法抗氧化活性测定:精密吸取各酸浆宿萼游离酚、结合酚样品溶液20 μL加180 μL FRAP溶液,于595 nm波长测定吸光度A样品,精密吸取各酸浆宿萼游离酚、结合酚样品溶液20 μL加180 μL纯水,于595 nm波长测定吸光度A对照,FRAP以FeSO4mol·g-1表示。并用0.2 g/mL的VC、BHT溶液作对照。
1.2.5.2 ABTS+·清除能力测定[18-19]
ABTS+·溶液的制备:分别配制7.4 mmol/L ABTS+·溶液,2.6 mmol/L过硫酸钾溶液,二者体积1∶1混合于棕色瓶中,避光反应16 h,产生ABTS+·,将ABTS+·用甲醇稀释,使其在734 nm波长处吸光度为0.70±0.02。
ABTS+·的清除:精密吸取的各样品溶液10 μL,分别加ABTS+·溶液190 μL,避光反应20 min,于734 nm处测定吸光度A样品,甲醇为空白对照,甲醇加工作液为样品本底对照A对照,所测的值减掉空白对照算清除率。用0.2 g/mL的VC、BHT溶液作对照。计算各样品溶液清除ABTS+·的IC50值。
ABTS+·清除率=(A对照-A样品)/A对照×100%(2)
1.2.5.3 ·OH清除能力测定[20]
工作液配制:分别配制3 mmol/L FeSO4溶液,3 mmol/L H2O2溶液,3 mmol/L水杨酸溶液。
羟自由基的清除:样品,50 μL FeSO4溶液加50 μL各样品溶液加50 μL H2O2溶液,混匀,静置10 min,加50 μL水杨酸溶液,混匀,静置30 min,于492 nm处测吸光度A样品;对照,50 μL FeSO4溶液加50 μL各样品溶液加50 μL H2O2溶液,混匀,静置10 min,加50 μL蒸馏水,混匀,静置30 min,于492 nm处测吸光度A对照;空白,50 μL FeSO4溶液加50 μL蒸馏水加50 μL H2O2溶液,混匀,静置10 min,加50 μL水杨酸,混匀,静置30 min,于492 nm处测吸光度A空白。用0.2 g/mL的VC、BHT溶液作对照。计算各样品溶液清除自由基的IC50值。

2 结果与分析
2.1 酸浆果结合酚提取单因素试验结果
2.1.1 H2SO4浓度对结合酚提取量的影响
固定液料比40∶1 mL/g,温度50℃,水解时间15 h,改变H2SO4溶液浓度(5%,10%,15%,20%和25%),由图1知,H2SO4浓度为10%时,结合酚提取量最大。适当浓度酸能破坏糖苷键,释放结合酚。随着酸浓度增大,结合酚遭到破坏,结合酚提取量降低。故选H2SO4浓度为10%。
2.1.2 水解时间对结合酚提取量的影响
固定液料比40∶1 mL/g,温度50℃,H2SO4浓度10%,改变水解时间(5,10,15,20和25 h),由图2知,水解时间15 h时,结合酚提取量最大。故选水解时间为15 h。
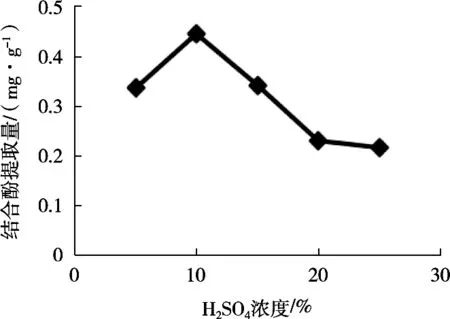
图1 H2SO4浓度对结合酚提取量的影响
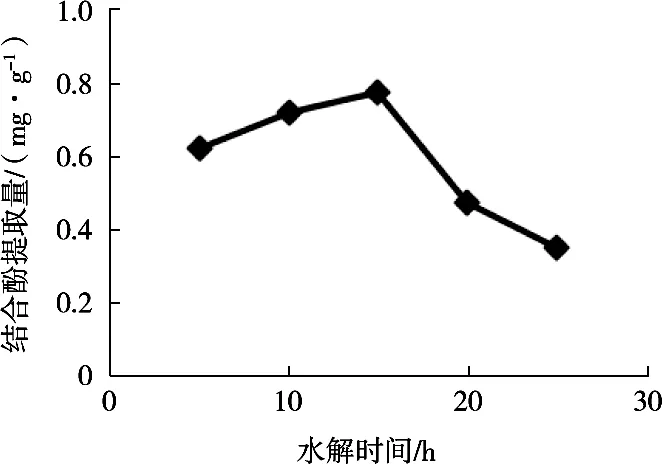
图2 水解时间对结合酚提取量的影响
2.1.3 液料比对结合酚提取量的影响
固定水解时间15 h、水解温度50℃、H2SO4浓度10%,改变液料比(20∶1,30∶1,40∶1,50∶1和60∶1 mL/g),由图3知,液料比为50∶1 mL/g时,结合酚提取量最大。故选液料比50∶1 mL/g。
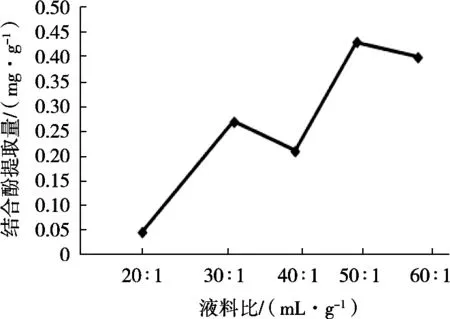
图3 液料比对结合酚提取量的影响
2.1.4 水解温度对结合酚提取量的影响
固定水解时间15 h,液料比50∶1 mL/g,H2SO4浓度10%,改变水解温度(30,40,50,60和70℃),由图4知,水解温度为50℃时,结合酚提取量最大。温度升高有利于结合酚水解,温度过高能导致结合酚发生分解,故选水解温度为50℃。
2.2 酸浆果结合酚提取响应面试验结果
采用响应面分析法分析试验结果,以结合酚提取量为响应值,对试验数据进行二次多项式回归拟合,得回归方程:Y=6.26-0.12A+0.018B+0.092C-0.48D+0.020AB-1.18AC+0.42AD-0.055BC-0.68BD-0.48CD-0.14A2-0.90B2-0.41C2+0.31D2。试验设计方案与结果见表2。
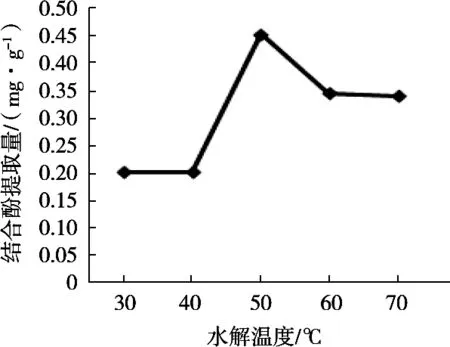
图4 水解温度对结合酚提取量的影响

表2 拟合设计试验方案及结果
由表3可知,以结合酚提取量为响应值,回归方程显著性检测p=0.048 5<0.050,表明该二次方程模型显著,回归方程模型与实际拟合性较好,试验误差小,证明应用响应面法优化酸浆果结合酚提取工艺是可行的,各因素对结合酚提取量的影响依次为:水解温度>硫酸浓度>液料比>提取时间。
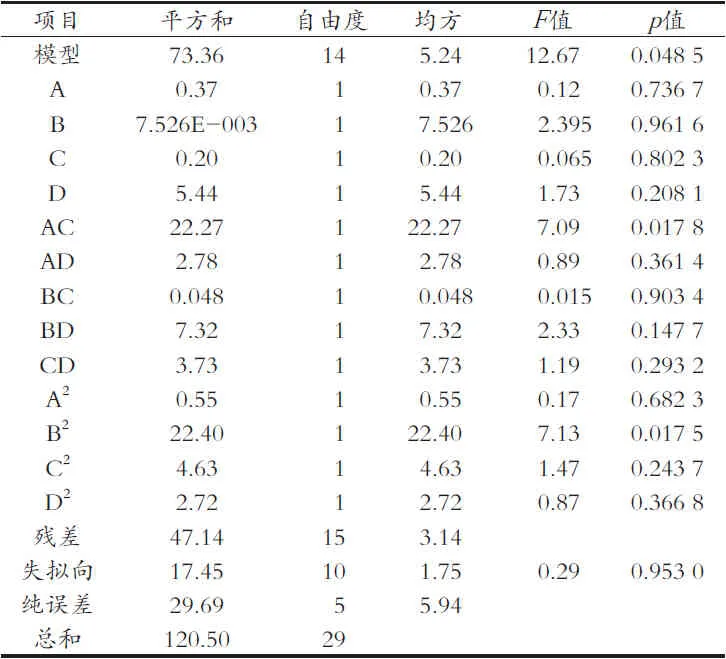
表3 响应面法对酸浆果结合酚提取量的方差分析表
将表2中的试验数据进行响应面曲面分析,选择2个交互的因素对结合酚提取量的影响进行分析。根据回归方程,考察拟合响应面的形状,分析水解时间、料液比、H2SO4溶液浓度、提取温度对结合酚提取量的影响,结果见图5。
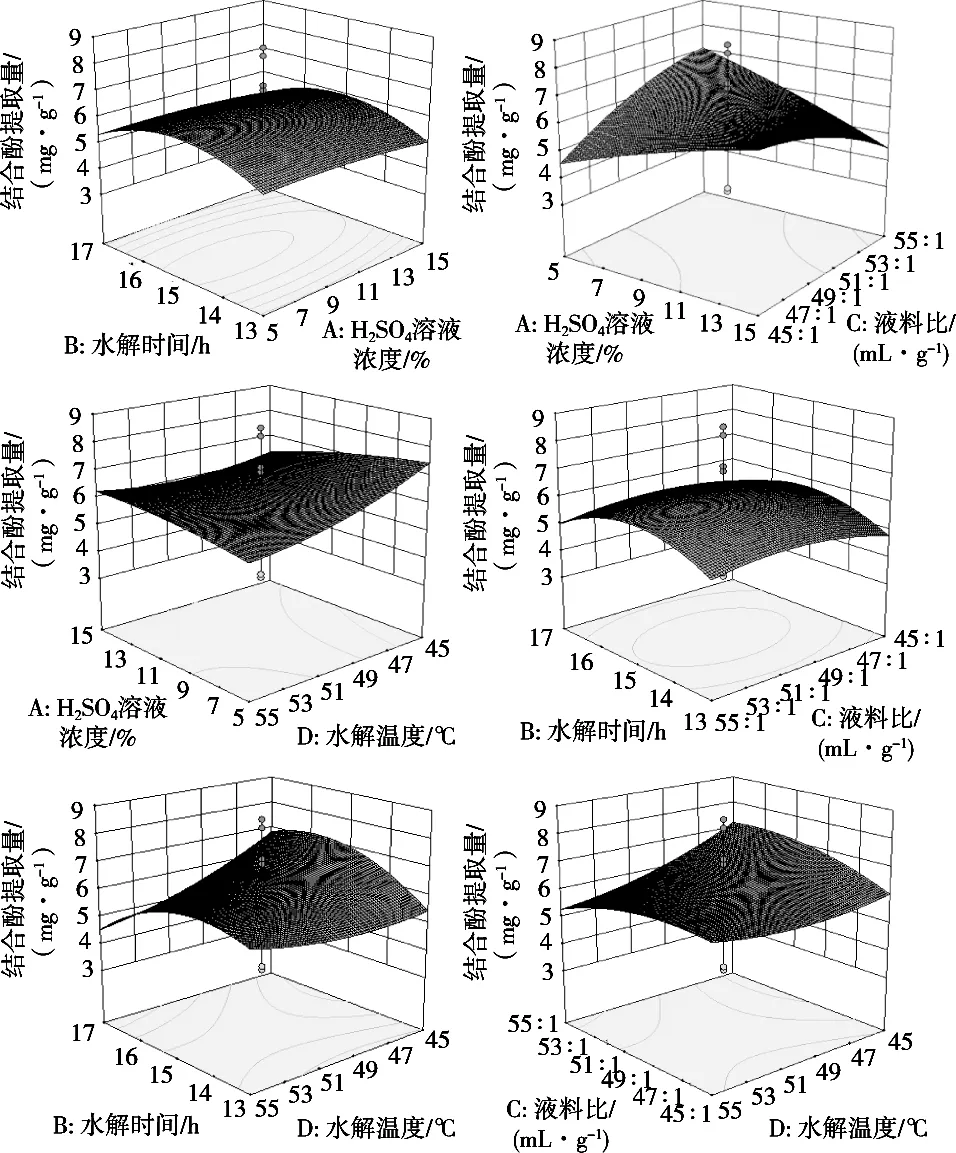
图5 各两因素交互作用对结合酚提取影响的响应图
利用回归方程分析结果绘制结合酚提取量随各因素变化的响应曲面图,由响应曲面图知液料比、H2SO4浓度、提取温度、水解时间对结合酚提取量的影响。由图5可见,提取条件在一定范围内,与其他提取因素比较,液料比与水解时间交互因素与结合酚提取量呈明显的抛物线关系;随着液料比增加,结合酚提取量逐渐缓慢减少;随着H2SO4浓度增加,结合酚提取量产量逐渐减少。
2.3 验证试验
由Design-Expert 8.0.6软件分析,得出酸浆果结合酚提取的最优条件。结果显示,酸浆果结合酚提取的最佳条件是:液料比55∶1 mL/g、H2SO4浓度5%、水解时间16 h、提取温度45℃。此时结合酚的提取量为8.81 mg/g。在此优化条件下,进行3次平行试验验证,其结果显示,酸浆果结合酚提取量为8.83±0.18 mg/g,与模型预期值的误差为4.96%,说明方程与试验情况拟合较好。
2.4 酸浆宿萼游离酚、结合酚抗氧化活性结果
2.4.1 Fe3+的还原活性
所有提取液对Fe3+-TPTZ复合物均表现出一定还原能力,见表4。酸浆果结合酚还原铁能力与BHT相当,比VC强;酸浆果游离酚原铁能力介于BHT与VC间;F=283.173,p=0.000。
2.4.2 ABTS+·的清除能力
ABTS+·溶液呈蓝绿色,遇到有供氢能力的抗氧化剂时,ABTS+·的产生被抑制,溶液变无色ABTS[21]。酸浆果游离酚、结合酚都有一定的ABTS+·清除能力,见表4,均比VC、BHT清除能力弱,F=6.331,p=0.017。
2.4.3 ·OH的清除能力
酸浆果游离酚、结合酚对·OH基团表现出一定的还原能力,见表4,都比VC、BHT清除能力弱,F= 601.492,p=0.000。
及·OH法测定抗氧化活性的影响(n=4)
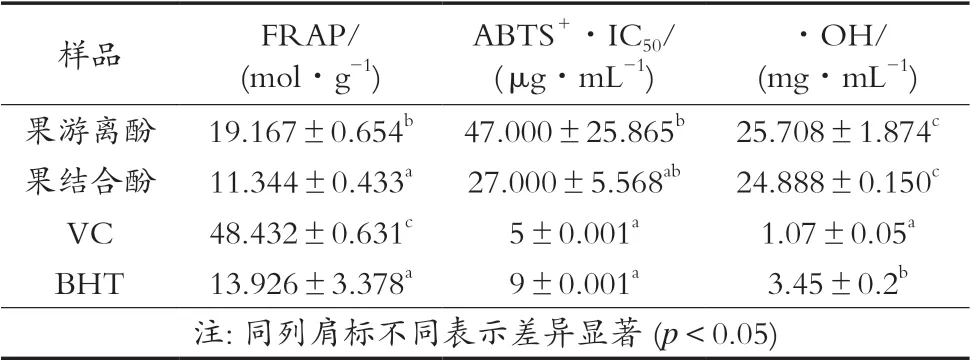
表4 游离酚、结合放你对FRAP法、ABTS+·法
3 结论与讨论
采用响应面法优化酸水解法提取酸浆果结合酚的工艺,最佳提取工艺条件为:液料比55∶1 mL/g、H2SO4浓度5%、水解时间16 h、提取温度45℃。此时结合酚提取量为8.81 mg/g,在此条件下,酸浆结合酚提取量为8.83±0.18 mg/g,与模型预期值的误差为4.96%,影响酸浆果结合酚得率大小的因素主次顺序为:水解温度>硫酸浓度>液料比>提取时间。其中,液料比与水解时间交互因素与结合酚提取量之间的交互作用显著。
抗氧化结果显示,酸浆果结合酚还原铁能力与BHT相当,比VC强;酸浆果游离酚原铁能力介于BHT与VC间。酸浆果游离酚、结合酚都有一定的ABTS+·清除能力,均比VC、BHT清除能力弱,但比洋葱醇提物[22]、朝鲜蓟叶多酚[23]强。酸浆果游离酚、结合酚对·OH基团的还原能力,都比VC、BHT清除能力弱,但比纯化后绵马贯众多酚[24]和麦冬花多酚[25]强。
酚类化合物具有抗氧化活性,与其含量显著相关[26]。结合酚广泛存在于植物基质中,与游离酚相似,如樱桃[27]、茭白[28]等的结合酚均有很好的抗氧化活性。富含酚类化合物的食品进入消化道,游离酚可在小肠内酯酶的作用下水解,随后被吸收利用;与细胞壁紧密结合的酚类化合物在小肠水解的少,在结肠微生物产生的水解酶作用下缓慢持续释放,可能会使其在体内发挥更长的抗氧化作用[29]。游离态和结合态酚类化合物广泛分布在植物中,不同存在形态的酚类化合物具有相似生物活性,不同生理活性。不同酚类化合物在体内吸收代谢途径和抗氧化方式不同,结合酚在体内较为持续的抗氧化作用及潜在的生理活性值得进一步探究。试验分别釆用DPPH法、ABTS+法及FRAP法研究酸浆宿萼结合酚抗氧化能力,3种方法侧重点不同,能全面衡量被测物质的抗氧化活性[30-31],不同抗氧化模型,测得的抗氧化能力存在差异,可能是因为模型不同,抗氧化物质基础不同,抗氧化原理不同[32]。研究结果为酸浆果作为保健食品的深入开发及酸浆宿萼结合酚开发和利用提供依据,避免资源浪费。

