在线红外与量热技术联用分析噻吩酯合成反应过程
罗 鹏,许启跃,叶树亮,杨遂军,杨伟华,韩雪青
1.中国计量大学工业与商贸计量技术研究所,浙江 杭州 310018;
2.杭州仰仪科技有限公司,浙江 杭州 310018;
3.浙江省安全生产科学研究院,浙江 杭州 310012
化工产业是国民经济的重要组成部分,与生产生活息息相关。上世纪六十年代提出的“三传一反”,开辟了化学工程发展的第二个里程碑,是化工学科发展的重要基础[1]。现阶段我国化工行业发展较快,水平也有较大提升,但在实际生产中仍然存在生产效率和质量较低的现象,缺乏对反应风险的认知。
随着仪器科学的发展,仪器分析在各个学科所占比值越来越高,也逐步推广应用于化工领域,成为反应工艺开发、分析及优化的重要途径。JASON 等[2]通过在线红外光谱分析与微反应器系统相结合,最大程度地提高Pall-Knorr 反应的生产率;MORITZ 等[3]通过使用傅里叶变换衰减全反射红外光谱(ATR-FTIR)结合一系列连续温度阶跃实验,用于快速确定药物合成工艺开发过程中的反应动力学,以及设计、缩放合适的工艺和设备;ADJI 等[4]使用反应量热仪进行硝化反应,用以合成硝酸2-乙基己酯(EHN)的替代品,研究其反应过程的放热信息,并使用差示扫描量热仪、质谱仪等对产物进行离线分析。近些年来多种分析仪器在线联用的分析方法在农药、食品[5]、电气[6]、能源[7-9]及新型材料[10]等领域逐渐开始应用,而化工领域的联用分析方法仍有待探索。
精细化工及药物合成在工艺路线和方法上,常有多种反应途径及优化空间,仅依靠单一仪器进行分析获得的数据有限。为了进一步认知和评估化学反应过程,本工作提出基于在线红外与量热技术联用的原位反应过程研究方法。反应量热仪是一种动态热分析仪器,能在线监测化学反应过程的变化,跟踪反应过程中的温度等信息,它能使化学反应在特定的条件下进行[11-12];傅里叶变换红外光谱法(FTIR)具有整体特征性强、分辨率高、采样技术简单和灵敏度高等特点[13],在线傅里叶红外光谱仪是研究连续复杂多产物反应过程的有效手段,同时利用反应量热仪所提供的原位环境,精确控制工艺中的压力、温度等变量,模拟真实工艺过程,可以在分子尺度上连续地捕获材料的结构演化信息[14-15]。实验以噻吩酯合成工艺为例,通过联用反应量热仪和在线傅里叶红外光谱仪,利用相关数据分析反应速率以及不同工艺条件对反应进程和产物变化的影响,实现对反应过程的评估及优化。
1 测量设备
反应量热仪由反应釜、中央控制器、循环油浴、搅拌器、校准加热器、温度传感器和进样泵等组成[16]。图1 为联用装置示意图,其中Tr和Tj分别是反应釜内样品温度和夹套内循环硅油的温度。实验中,由中央控制器采集温度,同时根据实验流程,对部件进行控制,从而实现实验过程的在线监测和控制。
反应量热仪主要测量反应过程中某一时刻的热量变化,其反应放热速率可由下式得到:
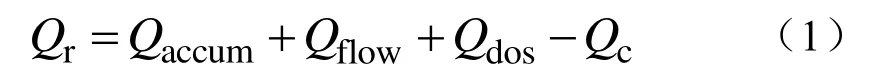
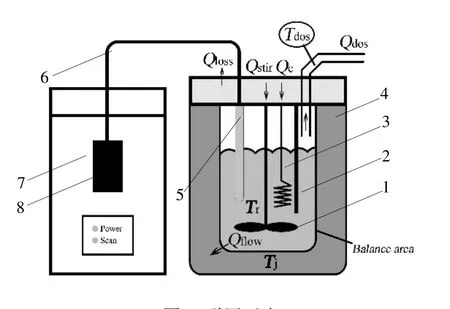
图1 联用示意Fig.1 Combined schematic diagram
式中:Qr为反应放热速率;Qc为校准功率,由校准加热器输出;Qaccum为反应体系的热累积速率,通过反应体系质量m、比热容Cp以及样品温度变化速率计算获得;Qflow是从反应体系向夹套传递的热流量,由传热系数UA 及样品与夹套温差(Tr-Tj)计算获得;Qdos为投料时所应起的热量损失速率,通过投料速率、投料物比热容以及投料物温度计算得到。
在线傅里叶变换红外(FTIR)光谱仪通过置于反应釜中的金刚石探头来收集整个合成实验中实时的光谱图。
2 应用案例
2.1 噻吩酯合成工艺
2-(噻吩-2-基)乙基4-甲基苯磺酸酯(噻吩酯)是治疗血栓类疾病的药物噻氯匹定和氯吡格雷合成过程中的中间体。在现有的噻吩酯合成工艺中,反应生成物中产物纯度不高,副产物所占比重较大。该反应工艺以甲苯作为溶剂,2-噻吩乙醇和对甲苯磺酰氯作为反应物,在特定温度下加入20%的氢氧化钠溶液和催化剂进行反应,再通过匀速升温得到最终产物,噻吩酯合成工艺的反应方程式为:

2.2 实验方案
实验通过改变工艺温度,研究温度对反应过程和产物成分变化的影响,具体实验条件如表1 所示。
实验利用自动反应量热仪提供原位环境,模拟真实反应工艺,对反应釜内温度进行控制,并实时记录釜内物料的温度变化。在反应前后对反应釜内物料的传热系数、比热容进行标定,通过测得的温度数据,分析计算出绝热温升、热转化率、反应放热等热力学参数。同时实时测定合成实验的红外光谱图,用于判断反应的进程和不同组分的变化用以区分不同的反应物和产物,并且与反应量热数据联用来评估整个合成工艺。

表1 合成实验工艺条件Table 1 Synthetic experimental process conditions
实验前,首先利用在线FTIR 光谱仪测定2-噻吩乙醇、对甲苯磺酰氯和产物噻吩酯的光谱图,对其特征峰进行识别,根据实验过程中检测成分变化的需要,结合文献选择相对强度较高、对应基团明确的特征峰作为监测反应中不同成分变化的特征峰,具体物质选择的特征峰波数和该特征峰对应的基团如表2 所示。
2.3 实验结果与数据分析
整个实验过程持续约450 min,根据量热数据计算得到的反应放热、反应物料比热容、夹套和反应物料之间传热系数等参数如表3 所示。
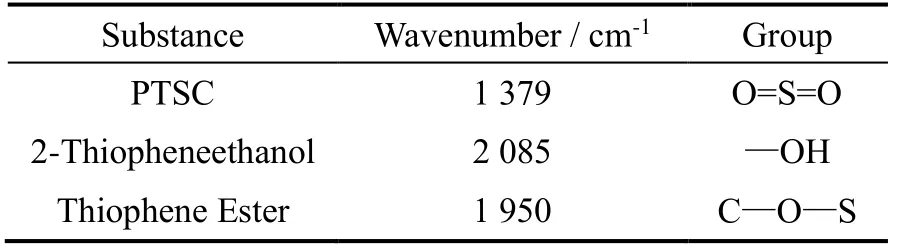
表2 反应中物质与其对应特征峰波数Table 2 Reactant and corresponding wavenumber of the characteristic peak

表3 噻吩酯合成实验量热数据Table 3 Synthetic experimental calorimetric data
表3 中的总放热量为在当前工艺条件下反应体系放出的总热量。对于同一反应,相同反应物质量和反应时间下总放热量越大代表反应物料的转化率越高;比放热焓为单位摩尔质量下物质放出的热量;进料吸热为投料时物料从反应体系中带走的热量;绝热温升表示在绝热状态下反应体系能升高的最大温度;Tcf(反应失控最高温度)是冷却失效的情况下反应体系内累积的反应物料反应后达到的温度;Cp和UA1、UA2分别表示反应开始前和反应开始后的比热容和传热因子与面积的乘积,这些参数是表征反应安全性的重要依据。通过表3 可以看出,
三组实验中第二组的总放热量最大,其绝热温升和反应失控最高温度较其他两组相对较高,结合工艺温度来看,三组实验的热危险性并没有因为工艺温度的改变而显著变化,通过这些量热数据可以为确定最佳工艺条件提供依据,对最终的反应工艺安全性评估提供参考。
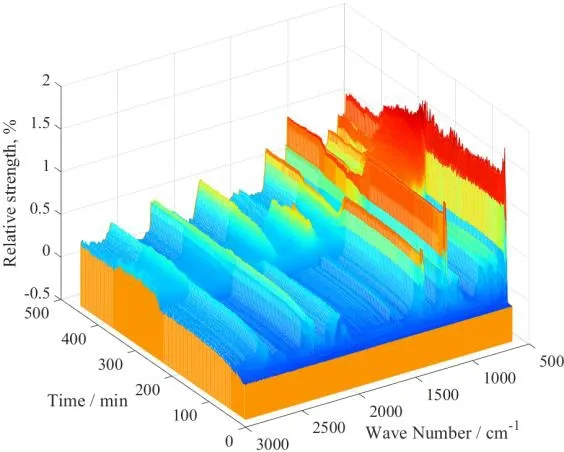
图2 合成实验红外光谱Fig.2 IR spectrum of synthesis experiment
如图2 所示为实验中在波数为3 000~650 cm-1内收集的红外光谱图。为后续特征峰识别及数据分析方便,将溶剂甲苯的红外谱图从实验曲面中整体扣除。为联用在线红外和量热技术分析反应过程,将反应相关特征峰曲线和量热数据曲线进行同步对比,特征峰曲线图上所列的均是与反应过程相关度较高的强度变化。同时将实验过程中关键操作信息标记在图上,并与反应量热数据中实时反应放热热流和热转化率曲线同步对比,三组实验的对比如图3 所示。需要指出的是,放热热流和热转化率曲线表征的是实际反应发生时的热量相关信息,由于实验前期和后期为反应体系的传热系数、比热容等参数标定,并不发生反应,故图3 的放热信息中只有中间部分有曲线。
图3 中的实时放热热流由式(1)计算可得,表示反应过程中实时的热量变化,一定程度上可以表示反应剧烈程度。热转化率是累积放热量占总放热量的比例,实验中可以通过热转化率来表征反应进程。
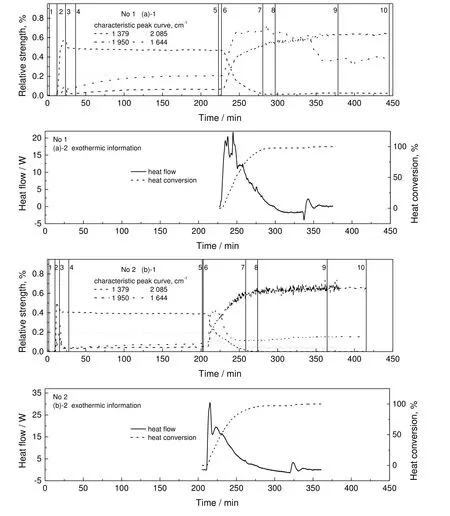

图3 反应相关特征峰曲线和量热数据曲线同步对比Fig.3 Synchronous comparison of characteristic peak curve and calorimetric data curve
结合表2 信息,2 085 cm-1峰强度降低代表噻吩乙醇不断被消耗,1 950 cm-1峰强度增加代表噻吩酯不断生成,1 379 cm-1为O=S=O 不对称伸缩振动,其峰强度降低是由其它峰强度随反应进行不断增加导致其强度减弱。图3 中特征峰1 644 cm-1,其相对强度随反应的进行发生明显变化,而1 644 cm-1未出现在噻吩酯纯谱中,根据反应式可知,该反应工艺主要副产物为水和氯化钠。通过分析水的红外光谱图,均在1 640 cm-1附近出峰,故推测1 644 cm-1对应物质为水。在量热标定阶段,空气中的水分会进入反应体系,使1 644 cm-1处峰强度缓慢增加,当反应开始时,其峰强度快速增加,随着反应进行,噻吩酯的特征峰越来越大。表4 为三组实验不同反应阶段量热数据与红外数据比较结果。

表4 反应阶段量热与红外数据Table 4 Calorimetry and IR data during reaction
对比分析图3 中的三组放热信息曲线,其中放热热流差异显著,放热热流越大代表反应速率越大,即反应越剧烈。以主产物(1 950 cm-1)为例,通过图中曲线和表4 可知,在氢氧化钠投料期间,第二组实验放热热流达到30.60 W,大于其他两组实验,说明第二组实验反应速率最快,使得主产物特征峰相对强度达到三组实验中最大值(0.62%),同时主产物相对强度的生成速率也为最大(0.045 %/min)。
通过表4 中最大放热热流数据可知,三组实验最大放热热流均出现在氢氧化钠投料阶段,结合图3 中的特征峰曲线,主产物和副产物正是在此阶段大量生成的,主产物特征峰1950 cm-1和副产物特征峰1 644 cm-1相对强度快速上升,其生成速率体现在放热热流曲线上,生成速率越快,则放热热流越大。匀速升温阶段,三组实验放热热流曲线均出现一个小峰值,说明随温度升高,反应会继续进行,但反应速率明显小于初期。
由图3 中的三组放热信息曲线可知,反应温度不同,最大放热热流不同,说明改变工艺温度有助于提高反应速率,但反应速率并非与温度成正比,而是呈现先增加后降低的趋势。同时,反应温度不同,反应所生成的副产物浓度也不同,从表4 可知三组实验在氢氧化钠投料阶段,副产物特征峰相对强度分别为0.74%、0.14%和0.39%,再经过匀速升温阶段,每组实验的副产物相对强度都有所下降,其变化趋势在图3 中有清晰表现,这说明升高工艺温度一定程度上有助于抑制副产物的比例。
观察图3 还可以发现,每组实验在副产物特征峰相对强度下降的时刻,对应放热热流均有小幅度上升,这不但说明副产物分解时会放热,同时也说明成分变化可以体现在量热的热力学数据上。由其热转化率曲线可知,反应工艺温度不同,反应进程变化趋势也不同。三组实验主要反应均发生在氢氧化钠投料阶段,但反应工艺温度越高,反应发生在匀速升温阶段占比越高,这一特点在表4 中有明显体现,三组实验在氢氧化钠投料阶段的热转化率分别为97.64%、95.62%和90.12%,随工艺温度升高而下降,说明温度对该工艺的反应进程有较为明显的影响。
热转化率曲线与主产物的变化趋势相吻合,主产物浓度随热转化率升高而升高,而2-噻吩乙醇和对甲苯磺酰氯对应的特征峰1 379 cm-1和2 085 cm-1的相对强度在氢氧化钠进料时,即反应开始时逐渐减小,当氢氧化钠进样完成时,这两条曲线相对强度降低至零附近,表明这两种物质参与反应并基本消耗殆尽,此时热转化率均超过80%,放热热流较之前也有大幅度下降,说明反应已经基本完成,但仍有小部分的反应在匀速升温的过程中进行。
对比三组实验主产物和副产物对应特征峰的相对强度,改变工艺温度,可有效抑制副产物在生成物中所占比重。同时温度匀速升高,反应会继续进行,主产物浓度会持续上升,有助于提高产物质量。实验结果表明,存在最优工艺温度25 ℃使最终生成物中副产物浓度降至较低水平。结合表3 结果,三组实验工艺温度虽然不同,但提高工艺温度对反应的热危险性的影响有限,三组实验的Tcf与工艺温度的差值虽然随工艺温度升高有所变化,但变化幅度较小,即可认为反应危险性没有显著提高。
3 结 论
a)利用提出的基于在线红外与量热技术联用的原位反应过程研究的方法对化学反应过程进行分析,以噻吩酯合成工艺为例,通过改变工艺条件,研究不同条件对反应进程和成分比例变化的影响。
b)案例噻吩酯合成工艺中,温度对反应速率、反应进程和最终产物质量影响明显,以主产物(1950 cm-1)为例,通过放热热流表征反应速率,不同温度下最大放热热流差异明显,说明主产物生成速率不同;通过热转化率表征反应进程,温度不同导致热转化率变化趋势也不同,温度越高反应发生在匀速升温阶段占比越高。不同温度下副产物最终浓度不同,同时随温度升高主产物浓度会持续上升,说明存在最优工艺,使副产物浓度降低,提高最终产物质量。从量热数据来看热安全数据不能与产物质量同时达到最优,但风险增加相对可控,反应的热危险性不会随温度上升而显著增加。
c)通过同步分析反应过程量热信息及红外吸收谱信息可知,反应主要发生在氢氧化钠投料阶段,主、副产物特征峰相对强度快速上升,放热热流达到最大,热转化率曲线与主产物变化趋势吻合;小部分反应发生在匀速升温阶段,此阶段主产物浓度继续上升,副产物浓度下降。
d)通过红外吸收谱与量热数据同步对比分析,可发现反应中某些明显特征,有助于过程分析及判断,结果表明该方法可应用于各类化学反应过程分析。通过放热量、绝热温升等热力学数据体现反应安全性,通过反应速率、热转化率等数据体现反应进程,将反应过程中的量热数据与成分变化相关联,可以分析成分变化对反应过程量热数据的影响,同时也能通过量热数据得到成分变化以外的信息。
e)该联用方法结合量热技术与在线红外两者的优势,从两种数据中获得不同角度的反应相关信息,可以有效实现反应过程的认知,清晰反应优化的方向。

