鱼类实验动物封闭群和近交系资源培育现状
蔡磊,李建军,余露军,黄韧
(广东省实验动物监测所,广东省实验动物重点实验室,广州 510663)
鱼类作为水生态系统和低等脊椎动物的典型代表,具有种类多、繁殖力强、遗传容易控制、饲育设施要求简单等诸多优点,在发育生物学、遗传学和生态毒理学等研究领域具有不可替代优势。仅国际斑马鱼模式生物数据库(ZFIN)中注册的斑马鱼实验室已达1304个(2019年5月,https://zfin.org),我国利用斑马鱼开展科学研究的实验室超过250个[1],目前全球以斑马鱼为代表的实验鱼使用量呈逐年上升趋势[2]。由于我国实验动物学科建设整体起步较晚[3],尤其实验鱼培育管理更滞后于哺乳类实验动物,国内外现有实验鱼品种品系的来源、代系、培育和管理方式等均较复杂。为促进我国实验鱼的规范培育,本文综述了国内外实验鱼的培育管理现状。
1 实验鱼封闭群和近交系定义
1.1 封闭群
封闭群的定义最早出现在1963年国际实验动物科学理事会(The International Council on Laboratory Animal Science,ICLAS)会议(ICLAS Bulletin No.14),为:“不从外部进行引种的群体为封闭群”[4],后ICLAS于1972年发布了封闭群官方定义,为:“不从外部引种,至少封闭培育4代以上,每代近交系数上升不超过1%”[5];1992年美国大鼠命名委员会发布的大鼠命名规则中对封闭群定义仍沿用ICLAS的官方定义[6];我国哺乳类实验动物遗传质量控制国家标准(2001版和2010版)中对封闭群的定义均参考ICLAS,为:“以非近亲交配方式进行繁殖生产的一个实验动物种群,在不从外部引入新个体的条件下,至少连续繁殖4代以上的群体”[7];鼠类国际标准化遗传命名委员会(International Committee on Standardized Genetic Nomenclature for Mice,ICSGNM)2016年发布的最新修订《大小鼠命名指南》中对封闭群定义为:“封闭群为保持有限遗传多样性的一个实验动物群体,以无选择的非近亲交配方式繁殖,所有的交配仅限于封闭群内部个体之间,且不从外部引进新的动物”[8]。
以往国内外较多书籍[9]、文献[10]、标准[7]和指南中常将远交群(outbred stock)和封闭群概念等同。参照ICSGNM于2016年新发布的指南,封闭群和远交群定义存在本质上的区别,封闭群为保持有限的遗传多样性(Contains Limited Genetic Diversity),而远交群则为保持最大的遗传杂合度(Maintain Maximum Heterozygosity)[8]。
封闭群主要特征为在一定范围内保持相对稳定的遗传杂合度,维持这种状态所需的条件包括:①封闭(不由外部引进新基因);②非近交(尽量减少基因丢失);③连续繁殖4代以上(前几代遗传杂合度波动较大);④传代亲本数量较多(降低近交机率)。因此,推荐实验鱼封闭群定义:“以非近亲交配方式繁殖生产,不从外部引入新基因,至少连续繁殖4代以上的实验鱼种群”。同时结合亲本数量要求,如传代亲本应保持50对以上,以满足实验动物封闭群的本质要求。
1.2 近交系
与封闭群定义相比,国内外对近交系的定义较为一致,为:“经过连续20代以上的全同胞兄妹交配或亲子交配,品系内所有个体都可以追溯到起源于第20代或以后代数的一对共同祖先,近交系数大于99%,且群体内任何个体基因组中98.6%以上的等位位点为纯合”[2-3, 6]。因实验鱼与哺乳类遗传规律相似,国际上已按照哺乳类近交系培育方法成功培育出多个实验鱼近交系(表1)。
2 实验鱼封闭群和近交系培育
2.1 封闭群培育
以大小鼠为代表的哺乳类实验动物封闭群理论体系已获国内外广泛认可。实验鱼与哺乳类同为脊椎动物,生殖方式相似,共同遵守遗传分离、自由组合和连锁定律,且实验鱼封闭群建群过程中基因频率变化规律与哺乳类实验动物相同。因此,哺乳类封闭群理论体系也同样适用于实验鱼,目前国内外已按照哺乳类封闭群的概念和培育管理方法,成功育成多个鱼类封闭群。
目前国际上实验鱼封闭群培育规模最大的为日本青鳉(Oryziaslatipes),已报道封闭群超过50个[11],如Kunming,Nagoya,Toyohashi等。斑马鱼(Daniorerio)至今报道的封闭群有AB[12]、TU[13]、TL[13]、IN(India)[14]、EKK[15]、WIK[16]、Darjeeling(DAR)[17]、NHGR-1[18]、IM12m[19],IM14m[19]、Florida wt line[20],Light-colored[21]等。其中AB、TU、TL、WIK、IN、Darjeeling和NHGR-1等原始建群方式未严格遵照标准封闭群建群要求,如AB系有孤雌生殖背景;TU为利用近交移除胚胎期致死突变得来;TL为筛选leo和lof基因纯合得来;WIK来源野生群,经挑选单次产卵量最大的一对鱼作为原始群建立;IN来源于印度东北部野生群,经过3代近交后再回交得来;DAR来源印度Darjeeling地区,1987年后于美国俄勒冈大学保种;NHGR-1来源于AB × TU繁殖的后代TAB-5,在TAB-5近亲繁殖的F1代中挑选繁殖量最大的亲本作为NHGR-1的第一代,这些群体有人认为是远交群或非近交群(outbred line/ outbred strain/ non-inbred strains),也有人认为是封闭群[22],因此,其不是严格意义上的封闭群动物。但IM12 m、IM14 m、EKK、Florida wt line和Light-colored等为按照封闭群要求育成。此外,其它实验鱼也有多个封闭群报道,如剑尾鱼属的新月鱼(Xiphophoursmaculatus)2856品种(1971)、剑尾鱼(Xiphophourshellerii)501品种(1963)、2977品种(1963)和3062品种(1971)等[23],孔雀鱼(Poeciliareticulata)S、S3HR、SC和F22等16个封闭群[24-25]。
国内实验鱼封闭群培育方面,广东省实验动物监测所培育了我国第一个海水实验鱼封闭群—诸氏鲻虾虎鱼(Mugilogobiuschulae)封闭群,现已达第19代[26- 27];中国科学院水生生物研究所培育了稀有鮈鲫(Gobiocyprisrarus)封闭群,现已培育至第10代[28-29]。
在鱼类封闭群培育上,总体上,发达国家优于我国,淡水优于海水,一些由于历史原因导致背景较为复杂的实验鱼群,如斑马鱼AB系等,繁殖管理方式已接近封闭群,后续如严格控制繁殖方式(避免近亲交配等)、保持群体规模、避免外源基因引入,则可培育成相对规范的封闭群。
2.2 近交系培育
哺乳类实验动物近交系已有上百年培育历史,仅小鼠近交系就达450多种[30],最高近交代数超过210代[31]。鱼类采用全同胞兄妹交配方式(full-sibling pair)培育近交系也已有50年以上的历史。斑马鱼已见报道近交系6个,分别为C32、sjA、sjC、sjD、IM和May。其中C32和IM为高度纯合的近交系。C32[15]来源于封闭群AB,最初通过雌核发育获得,1991年后以严格全同胞兄妹交配方式传代;IM和May为利用全同胞兄妹交配方式培育,IM已达20代以上[32],May已达第16代[32];sjA、sjC、sjD均为Stephen L. Johnson实验室培育[33],分别来源于AB、C32和DAR。
日本青鳉20代以上的近交系已有13个,分别为HBI-I、HNI-II、HO4C、HO5、HdrR、NCMH、HB32D、HB11 A、Kaga、Hsok、AA2、Cab和Hi3,其中HO4C品系近交代数已达到100代(表1)。
剑尾鱼属已育成近交系超过12个,分别为X.alvarezi, Dolores、X.couchianus、X.helleri, Cd、X.helleristrigatus、X.helleriguentheri、X.hellerihelleri、X.maculatus, Jp 163 A、X.maculatus, Jp 163 B、X.montezumaecortezi、X.signum、X.variatus和X.xiphidium。国际剑尾鱼种质资源中心(TheXiphophorusGenetic Stock Center)现保藏剑尾鱼属(Xiphophorus)近交有6个,分别为X.maculatus, Jp 163 A、X.maculatus, Jp 163 B、X.helleri, Cd、X.alvarezi, Dolores、X.couchianus和X.signum,其中Jp 163 A近交代数已超过100代(表1)。
孔雀鱼(P.reticulata)已报到近交系有8个[34],分别为MAC,BDZW1,BDZW2,Armatus,Guanapo,Quare6,Quare6 family II 215-3和Cumaná,其中Maculatus, BDZW1, BDZW2和Armatus品系均于实验室内近交繁殖超过50年。
孤独拟胎鳉(Poeciliopsislucida)近交系超过63代[35];光亮拟胎鳉(Poeciliopsismonacha)有2个近交系[35],分别为S68-4和S68-5,近交代数分别为34和30。
除此之外,还有通过雌核发育和自体受精产生的纯系鱼类,如亚马逊花鳉(Poeciliaformosa)和红树林鳉(Kryptolebiasmarmoratus和Kryptolebiashermaproditus)。亚马逊花鳉野生状态下几乎全为雌性,繁殖时雌鱼通过利用近缘种精子激活卵子,从而完成雌核发育,近缘种精子中遗传物质不参与受精发育[36]。两种红树林鳉[37]为目前在脊椎动物中发现的仅有的2种通过自体受精繁殖后代的物种,群体中绝大部分个体同时具有成熟的精巢和卵巢,通过自体受精完成繁殖后代。
国内鱼类近交系培育方面,中国水产科学研究院珠江水产研究所培育了5个剑尾鱼(X.helleri)近交系,分别为RR-B、RW-H、RW-K、BW-D和BY-F,其中RR-B近交系已达26代以上[38],中国科学院水生生物研究所培育的稀有鮈鲫近交系HAN已达33代以上[29],广东省实验动物监测所培育了4个诸氏鲻虾虎鱼(M.chulae)近交系,最高代数已达到第13代[26]。南华大学利用连续雌核发育方法培育了实验红鲫(Carassiusauratusred variety)纯系[39]。各品系近交系近交代数及参考文献见表1。
综上所述,国内外在实验鱼近交系培育上均开展了大量工作,已育成多个近交20代以上的近交系,但同时也发现个别鱼类近交系在培育过程中存在生命力和生殖力下降等近交衰退现象。针对此问题,国内外采取了诸多用于控制或减轻衰退的措施,如Shinya等[19]通过对斑马鱼近交系亲本的繁殖能力进行筛选,将繁殖力最强的斑马鱼作为传代亲本,用于保持近交系群体的繁殖力;吴淑勤等[38]通过创造适宜养殖环境、强化亲鱼营养条件和加强管理等措施克服剑尾鱼近交衰退。由于近交系衰退主要由遗传导致,因此在培育过程中加强人工选育和饲养管理对控制近交衰退尤为重要,人工选育可有效避免有害基因在群体中的传递,可在源头上排除对生殖力产生危害的基因,加强养殖管理可为实验鱼创造良好的生存环境,避免外界不利因素对实验鱼生长发育产生影响。
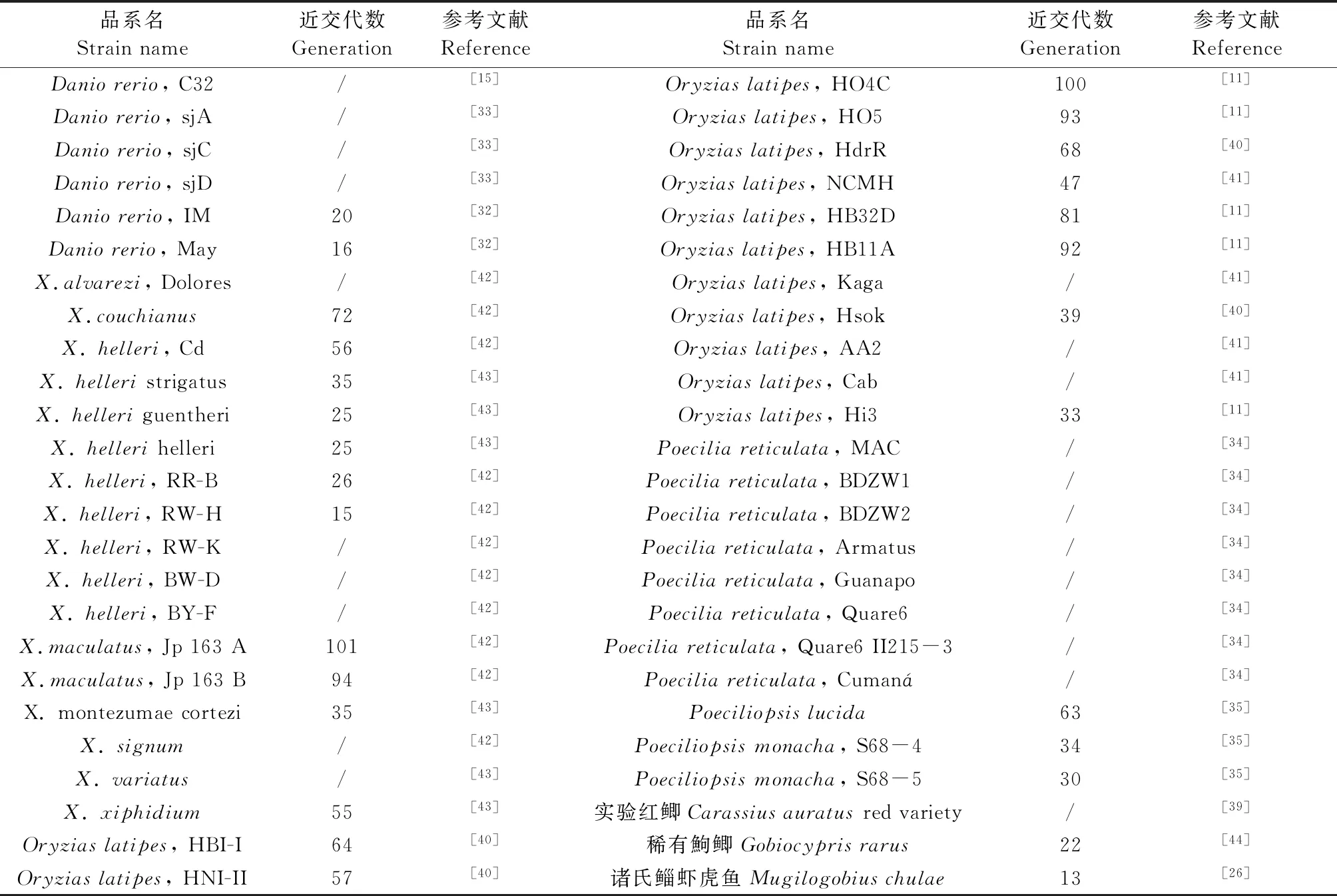
表1 实验鱼近交系统计Table 1 Statistics of inbred strain of laboratory fish
3 实验鱼繁殖和管理
3.1 实验鱼的繁殖方法
哺乳动物封闭群繁殖方法通常有最佳避免近亲交配法、循环交配法或随机交配法[7],在繁殖过程中,保持有效群体大小为雌雄各25尾,是保证传代过程中近交系数上升不超过1%的最小群体规模。由于鱼类个体小、单次繁殖量大,繁育成本低,在封闭群维持过程中,较易维持一个规模超过100对以上的群体,因此,实验鱼封闭群繁殖管理中,引种数量可适当提高,如50对以上,可选随机交配法传代。近交系常用的繁殖方法有亲子交配(parent-offspring)、全同胞兄妹交配(full-sib)、半同胞兄妹交配(half-sib)、双堂兄妹交配(double first cousin),其中全同胞兄妹交配为最经典和最常采用方式。按照全同胞兄妹交配方式培育实验鱼近交系已经有近50年历史,目前多数实验鱼近交系均通过此法获得[38, 40, 42, 44]。由于多数鱼类具有体外受精发育特点,鱼类也可利用雌核发育获得纯合后代,如实验红鲫纯系通过连续2代进行雌核发育获得、斑马鱼C32近交系的培育同时采用了雌核发育和全同胞兄妹交配。
与陆生实验动物相比,水生实验动物发展相对滞后,水生实验动物培育理论体系及相应方法亦较多参考陆生实验动物。水生和陆生实验动物虽在受精方式上差别巨大,如鱼类多数为体外受精发育(斑马鱼等)、也有体内受精(剑尾鱼等)或自体受精方式(红树林鳉等),但在封闭群培育上,二者遗传结构的变化均同属群体遗传学范畴,规律相似,在近交系培育过程中,二者等位基因纯合规律也一致。因此实验鱼封闭群和近交系培育方法可借鉴陆生实验动物方法,而在具体操作细节上在确保符合要求的前提下可根据鱼类生理特征进行调整。
3.2 实验鱼遗传管理
实验鱼的长期维持是一个非常系统和复杂的工程,培育过程中遗传物质的传递受到诸多因素影响,如封闭群和近交系培育过程中面临的遗传污染、遗传突变、遗传漂变、近亲繁殖以及人为选择等,良好的实验鱼繁育管理需对影响遗传信息的各种因素进行考虑并建立相应应对措施。
3.2.1 封闭群
在新建封闭群的管理上,需对其原始建群亲本进行严格的种质鉴定,确保种类准确无误,并建立详细的原始引种记录档案,包括种名、来源、数量、雌雄比例、种质鉴定结果、繁殖方法等,原始建群亲本一般不少于50对;一旦确立原始建群亲本,立即封闭群体,确保群体的繁殖仅限于群体内部,在封闭的条件下至少连续繁殖4代以上,并进行详细的传代谱系记录;在培育过程中,利用分子标记等方法,定期对其遗传杂合度和群体遗传平衡状态进行监测,以确保封闭群实验鱼的基因异质性及多态性[7]。
3.2.2 近交系
近交系必须有完整的繁殖记录,包括来源、品系名称、近交代数及主要生物学特征等;培育过程需严格控制繁殖方法,基础群严格按照全同胞兄妹交配繁育,用于种群的传代,生产群在繁殖代数4代以内可采用随机交配,另外,规范的命名方法是保证繁殖谱系可溯源的重要依据,确保每一箱实验鱼都有唯一且可溯源的编号,不同养殖单元的实验鱼应有明确的识别信息,包括品种/品系名称、来源、父母系资料、出生或引入日期、数量等;定期监测遗传纯合度是保证近交系培育遗传纯合度的重要手段。综上所述,实验鱼近交系遗传管理的核心在于保持动物的同基因性以及基因纯和性[7]。
3.3 实验鱼饲养管理标准化
在实验鱼的饲养管理标准化上,因管理理念的差异,国外较偏重于制订指南或准则,如联合国粮农组织[45]、加拿大动物保护协会[46]、英国皇家防止虐待动物协会[47]等均制定了关于鱼类养殖管理的指南,此外还有一些实验鱼饲养管理的经典书籍,如《The laboratory fish》[48]和《The zebrafish book》[49]等。因上述指南和书籍多为原则性要求和建议,在实际操作过程中各实验鱼生产和使用单位较难达到标准化饲养管理,如通过公共网络途径获得的美国Washington、Southflorida和Rosalind Franklin等大学斑马鱼饲养管理标准作业程序(standard operating procedures,SOP),详尽程度、具体操作指标设置以及管理措施等均差别较大。
与国外相比,我国在实验鱼饲养管理标准化上稍显滞后,通过对我国19个代表性实验鱼生产和使用单位实地调研,各实验室的饲养管理SOP均是在参考国外书籍、指南或SOP等,并结合各自实验室特点上制定。在标准制定上,2009年国家标准化管理委员会批准广东省实验动物监测所起草《实验动物 鱼类环境与质量控制标准》国家标准(编号20091329-T-469);2013年12月20日北京市质量技术监督局发布了实验用鱼质量控制地方标准(包括实验用鱼微生物学等级及监测、寄生虫学等级及监测、遗传质量控制、配合饲料、环境条件、病理诊断6个部分);2016年8月10日,稀有鮈鲫质量控制系列标准(微生物、寄生虫、遗传、营养和饲料)获得湖北省地方标准制定立项;2016年12月29日湖南省质量技术监督局批准发布了《实验鱼类 实验红鲫C1HD系遗传质量控制》。随着实验鱼的应用领域和影响力逐渐增大,虽然我国在实验鱼质量控制上开展了大量研究工作,标准化工作也取得部分进展,但仍与我国较大的实验鱼培育应用规模不匹配,标准化工作急需加强。
4 结语
鱼类实验动物资源经过几十年的快速发展,培育了众多不同生物学特性的品种和品系,建立了丰富的疾病和毒理应用模型,取得了一大批重要的新发现和新进展,有力支撑和推动了生命科学的发展。同时也应注意到,鱼类实验动物培育和应用过程中仍然面临着标准化不足等问题,如我国暂无可用的实验鱼质量控制国家标准,目前绝大部分省份未将实验鱼纳入实验动物质量检测管理体系,导致各实验室在实验鱼培育技术、管理水平以及质量上良莠不齐,因此非常有必要通过加强相关标准的制定,以规范和引导实验鱼培育和管理,对促进实验鱼行业的发展有重要意义。

