斑马鱼发育毒性与致畸性相关实验研究进展
戴明珠,黄燕烽,彭逸,张双阳,张立将,李春启,*
(1. 杭州环特生物科技股份有限公司,杭州 310051;2. 浙江省人用物品安全性评价技术研究重点实验室早期评价基地,杭州 310053)
1996年,美国食品药品监督管理局(Food and Drug Administration,FDA)规定,药物在获批准许人类使用之前需进行生殖和发育毒性评估[1]。现行的发育毒性指导原则主要包括经济合作与发展组织(Organisation for Economic Co-operation and Development,OECD)条例TG414[2]、TG416[3]、TG421[4]、TG422[5]和人用药品注册技术要求国际协调会议(International Conference on Harmonization,ICH)准则S5(R3)[6],其中建议使用的实验动物可以选择常规种属(大鼠、兔、小鼠)、非常规种属(食蟹猴、小型猪)、有限使用种属(豚鼠、仓鼠、犬、雪貂)和其他替代实验动物[7]。为快速、准确推行和实施减少(reduction)、替代(replacement)和优化(refinement)原则,实现保护动物福利和减少哺乳动物等较高级实验动物的使用量,斑马鱼(Zebrafish,Daniorerio)发育毒性实验替代哺乳动物模型已广泛应用于药物的发育毒性与致畸性研究[8-9]。本文介绍了国内外斑马鱼发育毒性与致畸性研究最新进展。
1 发育毒性试验替代方法
食品、药品和环境安全问题是当前全人类都必须面临的一个严峻的问题。如,目前人们普遍认为,膳食纤维可分为两种,可溶性膳食纤维(低聚果糖、果胶、菊粉等)和不可溶性膳食纤维(维生素等)。前者易在肠道中被细菌降解,产生短链脂肪酸等一系列益于人体的代谢产物,后者则不容易被消化酶降解,而起到促进肠道蠕动的作用。然而2018年10月18日,《细胞》(Cell)杂志发表文章表明,长期喂食水溶性纤维会导致小鼠发生癌症[10]。这里并不宣扬膳食纤维是有害的,相反,应该说经过高度处理的可溶性膳食纤维并不是那么安全,有可能会引起肠道菌群的过度生长和失调,可能会增加罹患肝癌的风险。
2009年9月,欧洲化学品管理局(European Chemicals Agency,ECHA)新闻稿就已报道,有超过143 835种已预先注册的化学品会污染食品和环境[11],但其中约86%的化学品和其他现有化学品的安全性检测数据即时缺失的[12],这些实际数字远远超过了人们的认知。又根据OECD指导方针,评估一种化学品的发育毒性需要5816只动物,费用为1 883 200英镑[13]。因此,促使研究和发展发育毒性试验的替代方法是顺势而为的。早期的替代方法大概可分为整体胚胎培养试验、哺乳动物微驴试验、爪蛙试验和胚胎干细胞试验。前两个模型仍然使用完整的哺乳动物作为实验对象,仍属于高费-低效系统,而蛙类专长于神经纤维兴奋传递类实验,胚胎干细胞本身一直是一个具有争议的领域。
因此,斑马鱼发育毒性试验替代方法似乎是适用的。斑马鱼胚胎在母体外发育,从合子期到孵化期仅72 h,且发育的完整过程均是透明的,利于实时观察和检测(斑马鱼、大鼠和人胚胎发育时期的比较见表1)。斑马鱼幼鱼长3 ~ 4 mm,拥有6-384孔板的高通量检测体系,可实现低费-高效筛选。斑马鱼与人类基因同源性达到87%[14-16],用于药物的体内快速评价实验结果可比性强。故可以利用斑马鱼早期各个阶段的发育形态,准确高效的确定药物暴露在胚胎中的毒性,广泛应用于药物的发育毒性与致畸性研究。
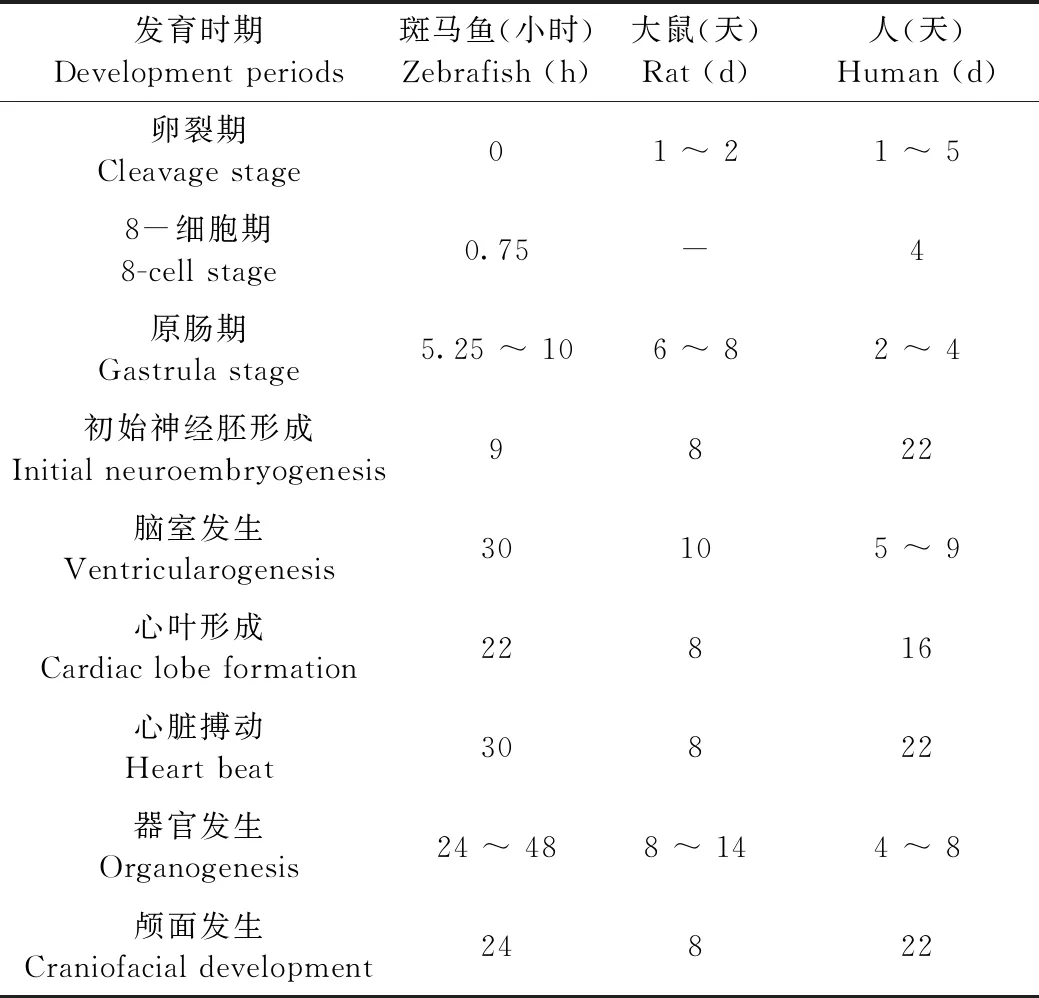
表1 斑马鱼、大鼠和人胚胎发育时期的比较Table 1 Comparison of embryonic development periods among zebrafish, rat and human
2 斑马鱼发育毒性国内外最新研究进展
2010年,Brannen等[14]利用斑马鱼胚胎评价31种已知对体内哺乳动物胚胎致畸/不致畸化合物的致畸性,证实斑马鱼与哺乳动物体内发育毒性与致畸性评价的一致性为87%。同一年,由阿斯利康(AstraZeneca)牵头的4个实验室间[15]利用斑马鱼对20种化合物的发育毒性进行盲法评估,并详细规范了斑马鱼发育毒性与致畸性的实验方法、检测指标和结果判定(毒性/畸形分级以及评分标准),最终,4个实验室的结果与哺乳动物数据的整体一致性范围在60% ~ 70%。经过进一步的调整,更多因素如pH、绒毛膜的通透性、胚胎的摄取率等考虑在内。2014年,阿斯利康又在两个实验室内平行对38种化合物的发育毒性与致畸性进行了评估,此次两个实验室间的总一致性达到62% ~ 82%[16]。近年来国外斑马鱼发育毒性研究报告汇总详见表2。
2013年,鲁疆等[17]、夏继刚等[18]先后成功利用斑马鱼胚胎评价氯化铬等重金属离子和全氟辛烷磺酸等有机污染物对水生生态的毒理学效应。2016年,许冰洁等[19]利用斑马鱼评价5种已知对人类胚胎致畸药物的毒性与安全性,证实斑马鱼胚胎模型可用于初步评价药物的发育毒性和安全性。
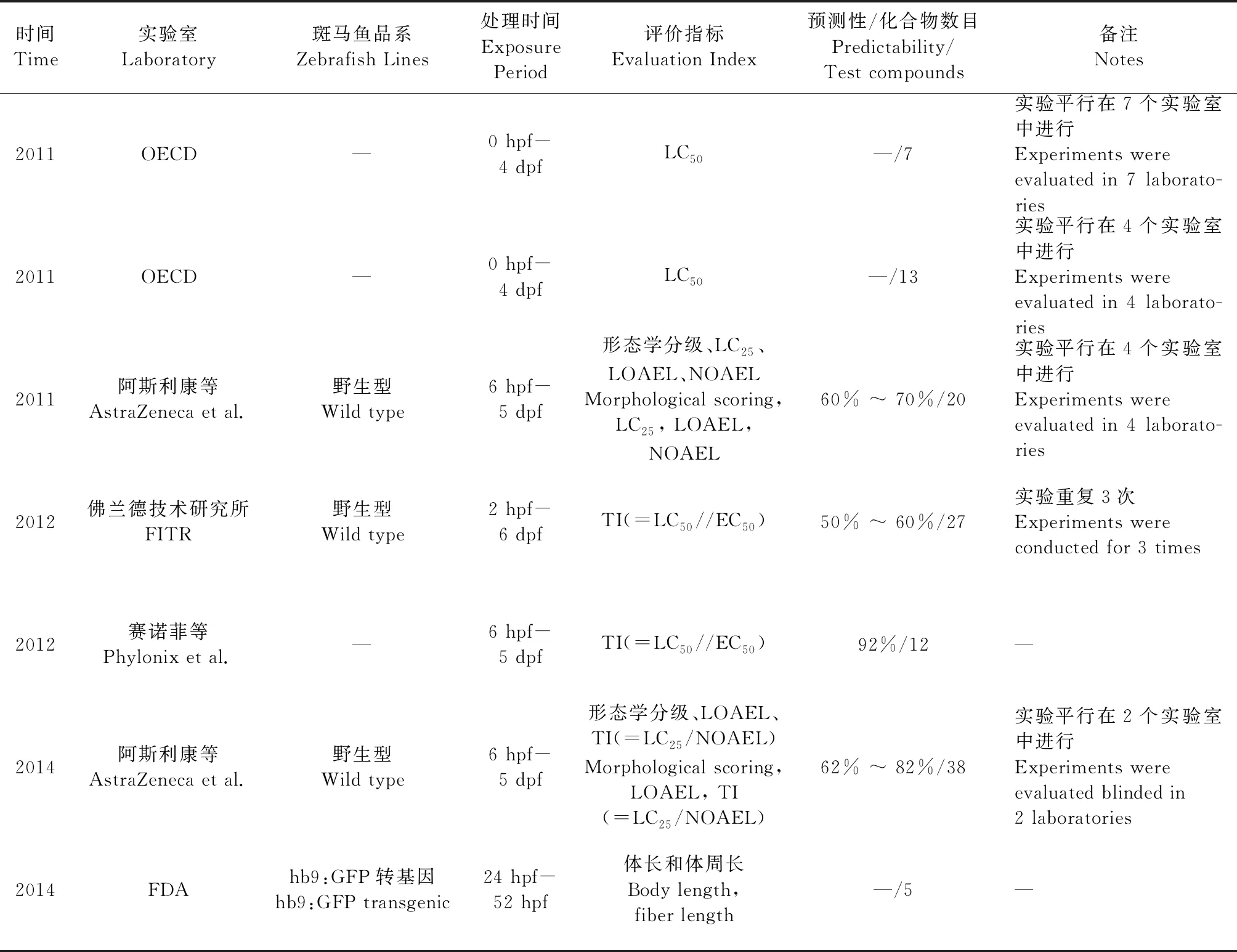
表2 斑马鱼发育毒性研究报告汇总Table 2 Summary of developmental toxicity study reports in zebrafish
3 斑马鱼发育毒性与致畸性评价实验室间比对
国外学者利用斑马鱼进行化合物发育毒性与致畸性评价,其化合物一般可归为五类:A妊娠初3个月用药,经临床对照未发现对胎儿有损害;B动物实验未显示对胎仔有危害,但缺乏临床观察资料;C动物实验显示对胎仔有危害,但未在妊娠早期临床试验中证实;D对人类胎儿有危害,但利大于弊;X妊娠妇女禁用药。实验一般规范选用受精后6 h(hours post fertilization,6 hpf)野生型AB系斑马鱼于24孔板中,每孔处理1个胚胎,每孔药液体积为1 mL,12个1组,每个化合物均统一给予五个浓度(0.1、1、10、100和1000 μmol/L浓度,调节pH使控制在6.4 ~ 8.4),在受精后第5天(day post fertilization,5 dpf)观察斑马鱼的形态学结构/器官并进行评价。最终实验结果将与哺乳动物数据进行比较,计算斑马鱼与哺乳动物的一致性,由表2可知,实验结果的预测性最低为50%,最高可达92%。
许冰洁[22]等利用斑马鱼胚胎评价了环磷酰胺、乙酸地塞米松、乙酰水杨酸、盐酸四环素和阿扎胞苷5种已知对人类胚胎致畸药物的毒性和安全性。实验选用已知的胚胎致畸性阳性药沙利度胺和阴性药维生素C建立斑马鱼胚胎发育毒性模型,并设立格列本脲、头孢噻肟钠两种阴性药对实验方法进行验证。挑选4 hpf AB系斑马鱼于6孔板中,每孔处理30个胚胎,每孔药液体积为3 mL,每个化合物均统一给予4个浓度:1/10 MNLC、1/3 MNLC、MNLC(maximum non-lethal concentration,最大非致死浓度)和LC10(10%死亡浓度),并分别以0.5%二甲基亚砜(dimethyl sulfoxide,DMSO)和人工海水为溶剂对照组和空白对照组,在28.5℃条件下发育至5 dpf,观察斑马鱼的形态学结构/器官和死亡数量并进行评价。结果表明,5种药物50%死亡浓度(median lethal concentration,LC50)由大到小为环磷酰胺 > 阿扎胞苷 > 盐酸四环素 > 乙酰水杨酸 > 乙酸地塞米松,半最大效应浓度(concentration for 50% of maximal effect,EC50)由大到小为环磷酰胺 > 盐酸四环素 > 阿扎胞苷 > 乙酰水杨酸 > 乙酸地塞米松。乙酸地塞米松毒性最强,乙酰水杨酸次之,其次盐酸四环素、阿扎胞苷,环磷酰胺毒性较弱。格列本脲和头孢噻肟钠则均未出现明显的致畸作用。
此外,斑马鱼胚胎还被广泛运用于Cd2+、Cu2+、Hg2+等重金属离子[23-24]的发育毒性效应研究;农乳602(苯乙基酚聚氧乙烯醚)、宁乳33#(苯乙烯基苯酚甲醛树脂聚氧乙烯聚氧丙烯嵌段聚醚)、农乳700号(烷基酚聚氧乙烯醚甲醛缩合物)、OP-10(辛基酚聚氧乙烯醚)、NP-10(壬基酚聚氧乙烯醚),农乳1602(三苯乙基酚聚氧乙烯聚氧丙烯醚)等多种市售表面活性剂[25]的发育毒性效应研究;甲草胺、乙草胺、丙草胺、丁草胺、异丙甲草胺等多种酰胺类除草剂[26]以及其他农药的毒理研究等。
4 斑马鱼发育毒性与致畸性量化评价指标
2012年,约翰威立国际出版公司(John Wiley & Sons)联合赛诺菲-安万特(Sanofi-Aventis)出版了书籍《斑马鱼:评估药物安全性和毒性的方法》(《Zebrafish: Methods for Assessing Drug Safety and Toxicity》),书中指出,与其他动物模型相比,斑马鱼胚胎的快速发育和透明性是其作为新型模式生物的重要优势,斑马鱼发育毒性试验是为了绘制毒-效效应曲线,并评估药物的致死性。得出LC50、EC50、TI(Teratogenic Index,=LC50/EC50,致畸指数)和畸胎指数[27]。因此,书中详细描述了5 dpf时期斑马鱼发育毒性与致畸性形态学评价指标(表3),并基于TI的截断值“1”来判定药物的发育毒性和致畸性:TI > 1,表明这种化合物是具有致畸性的,提示50%斑马鱼出现发育异常的浓度低于50%致死浓度;TI < 1,表明非致畸性的;TI=1,提示发育毒性与致畸性评估必须在精确的LC50浓度下进行,以确定斑马鱼是否在这个浓度下表现出畸形。
近年来,有学者[18]应用软件拟合出的EC50值再回到实验中去进行验证,发现拟合EC50值多低于实际半最大效应浓度,此外,仅用TI评价药物的致畸性不够全面。因此,可以见到有些学者会通过统计死亡率,得到无明显损害作用的最大染毒浓度(No Observed Adverse Effect Level,NOAEL)和产生畸形的最低浓度(Lowest Observed Adverse Effect Level,LOAEL),再通过软件拟合得到LC25(25%死亡浓度),最终计算TI(LC25/NOAEL)值。
另外,在前期多以描述的方式进行形态学评估的基础上,有学者们对其进行改进,将形态学进行0.5 ~ 5评分进而对毒性/畸形进行分级[28]。一般观察指标为躯干、脊索、尾部、鳍、心脏、面部结构(眼睛、耳石、嗅觉区域)、神经管和下颌(以上指标均进行毒性/畸形分级以及评分),肝脏、卵黄囊、鳔和色素沉着(仅描述)。评分对于的毒性/畸形分级为:“5”正常形态学,“4(=NOAEL)”微变等效,“3(=LOAEL)”轻度异常,“2”中度畸形,“1”重度畸形,“0.5”结构缺失。
2014年,FDA发表一篇文章,其中仅仅以斑马鱼胚胎体长(Fiber length)和体周长(Body length))作为毒性的统计量化终点[29]。
5 展望
发育毒理学是指研究出生前暴露于环境有害因子导致的异常发育结局及有关的发病机制、发病原理、影响因素和有毒物质动力学等。人类成功妊娠结局的比率低,且有复发性倾向,发病原因复杂[30]。我国药物毒理学研究起步较晚,化药和中药毒理基础数据较少,如仅2015版《中国药典》指出的83种有毒中药中,至少15种完全不能检索到任何一项基础毒性数据信息,过半主要毒性成分和毒性靶器官不明确[31]。常规发育毒性实验常采用啮齿类动物(鼠、兔等)进行,先将成年的正处于发情期的雌雄鼠合笼,判断雌鼠妊娠,至妊娠中后期,方才收集样本进行检测[32-33]。如此实验操作复杂,过程不可控,药物用量大,费用高,无法批量或规模性缓解目前中药/化合物(发育)毒理学评价存在的问题,且哺乳动物试验无法对胚胎及其发育体系进行时-实监测。用胚胎发育透明的斑马鱼模式生物进行药物发育毒性与致畸性的高通量筛选和机制研究,其快速-高效-经济体系克服了传统哺乳动物实验的劣势,筛选结果预测性好、可比度高,应用前景广泛。

表3 发育毒性与致畸性评价指标Table 3 Evaluation indicators of developmental toxicity and teratogenicity

