电针对糖尿病神经痛大鼠脊髓背角NF-κB p65蛋白的干预作用
邰昭霞,费雪瑜,瞿思颖,王涵芝,陈卢杭,蒋永亮,方剑乔*,何晓芬*
(1. 浙江中医药大学第三临床医学院康复医学院,杭州 310053; 2. 浙江省针灸神经病学研究重点实验室,杭州 310053; 3. 浙江中医药大学针灸研究所,杭州 310053)
糖尿病神经痛(diabetic neuropathic pain,DNP)是糖尿病最常见的并发症之一,其发病机制尚不明确,有研究表明其与代谢、细胞信号通路以及相关神经递质的改变等因素有关,严重影响患者生活质量,且缺乏有效的治疗手段[1]。寻找有效治疗糖尿病神经痛的方法,是糖尿病并发症防止领域亟待解决的问题。核转录因子κB(nuclear factor kappa B,NF-κB)是一种蛋白质复合物,其在炎症反应、氧化应激以及各种疾病的发生发展过程中都发挥着重要作用[2]。NF-κB p65是NF-κB家族最重要的成员,也是最常见的活化形式;有研究表明,NF-κB p65在大鼠DNP的发生过程起着重要作用[3]。目前电针被广泛用于治疗各种慢性疼痛,它能有效控制糖尿病神经痛[4-5],且有研究表明在大脑中动脉闭塞模型中,电针能下调梗死灶周围组织中NF-κB p65的表达[6]。但电针干预DNP是否通过下调脊髓NF-κB p65来起到干预糖尿病神经痛的作用尚有待明确。因此,本实验选取高脂高糖饲养联合链脲佐菌素(streptozotocin,STZ)腹腔注射诱导的糖尿病神经痛模型,探讨电针对糖尿病神经痛的镇痛作用是否与有效干预DNP大鼠脊髓背角NF-κB p65蛋白表达有关。
1 材料与方法
1.1 材料
1.1.1 实验动物
选用6周龄健康雄性SPF级SD大鼠30只,体重(180 ± 20)g,购自中国科学院上海实验动物中心【SCXK(沪)2013-0016】,由浙江中医药大学动物实验研究中心饲养【SYXK (浙) 2013-0184】。自由饮水,昼夜明暗周期12 h/12 h。所有实验操作均符合实验动物伦理学要求(伦理审批号为:IACUC-20180319-13)。
1.1.2 试剂与仪器
链脲佐菌素(Sigma,S0130), 兔抗NF-κB p65 抗体(CST,8242),山羊抗兔二抗(CST,7074),RIPA裂解液(碧云天,P0013B),BCA蛋白定量试剂盒(Thermo,23227),SDS上样缓冲液(碧云天,P0015B),ECL发光显色液(碧云天,P0018),足底热辐射测痛仪(意大利UGO BASILE,37360),动态足底测痛仪(意大利UGO BASILE,37450),罗氏卓越型血糖仪(Roche ACCU-CHEK Performa)。
1.2 方法
1.2.1 动物分组与造模
将30只大鼠,随机分为正常组(normal group,n=8)和造模组(n=22)。正常组用啮齿类动物标准颗粒饲料饲养,造模组用高脂高糖饲料喂养(72.5%普通饲料 + 10%猪油 + 10%蔗糖 + 2%胆固醇 + 0.5%胆酸钠 + 5%蛋黄粉;购自浙江省医学科学院实验动物中心),喂养5周后禁食16 h,造模组以小剂量链脲佐菌素(streptozotocin,STZ,35 mg/kg)腹腔注射1次,正常组仅腹腔注射相同剂量的柠檬酸缓冲液。于STZ注射后2周即第7周分别测空腹血糖(fasting blood glucose,FBG)、热痛阈(paw withdrawal latency,PWL)、机械痛阈(paw withdrawal threshold,PWT),FBG ≥ 11.1 mmol/L并且痛阈下降≥15%[7]的造模组大鼠入选糖尿病神经痛模型。其余未达到此标准者则予以剔除。将造模成功的糖尿病神经痛模型大鼠再随机分为糖尿病神经痛组(DNP group,n=9)和糖尿病神经痛+电针组(DNP+EA group,n=9)。
1.2.2 空腹血糖测定
分别于0周(base)、5周(5 weeks)、7周(7 weeks)、8周(8 weeks)这4个时间点检测大鼠的FBG。大鼠禁食8 h后尾静脉取血用罗氏卓越型血糖仪及其配套试纸测定各组大鼠的FBG。
1.2.3 机械痛阈测定
参照寿升芸等[7]测定大鼠机械痛阈方法,采用动态足底触觉仪检测各组大鼠0周(base)、5周(5 weeks)、7周(7 weeks)、8周(8 weeks)这4个时间点的PWT,每只大鼠连续测量5次,每次测量间隔5 min,去除最大值和最小值,最终取3次的平均值作为大鼠机械痛阈值。
1.2.4 热痛阈测定
参照项璇儿等[8]测定大鼠PWL的方法,采用足底热辐射测痛仪检测各组大鼠0周(base)、5周(5 weeks)、7周(7 weeks)、8周(8 weeks)这4个时间点的热痛阈。连续测量5次,每次间隔5 min,去除最大值和最小值,取3次平均值作为大鼠热痛阈。
1.2.5 电针干预
电针干预方法:大鼠固定后,参照华兴邦大鼠穴位图谱,选取双侧足三里(膝关节后外侧,在腓骨小头下5 mm)、昆仑穴(后肢外踝与跟腱之间的凹陷中),采用0.25 mm×1 mm针灸针,进针后用LH-202H韩氏穴位暨神经刺激仪连接两穴位,电针频率为2 Hz、强度为1 mA干预15 min后2 mA干预15 min,共30 min。电针干预于第7周开始,每天1次,共7次。Normal组大鼠和DNP组大鼠仅给予和DNP+EA组相同的固定。
1.2.6 苏木精-伊红(hematoxylin-eosin,HE)染色观察坐骨神经的变化
大鼠用戊巴比妥腹腔注射麻醉,开胸暴露心脏,先经生理盐水(4℃预冷)快速灌注,再4%多聚甲醛灌注后取出大鼠坐骨神经中段(距近心端3 mm,远心端2 mm)置于2.5%的戊二醛溶液中固定。再经脱水、透明、石蜡包埋、切片、染色、脱水及封固等步骤后观察。
1.2.7 免疫印迹法检测大鼠脊髓背角NF-κB p65蛋白的表达
大鼠用戊巴比妥腹腔注射麻醉,经生理盐水(4℃预冷)快速灌注后,参照杜俊英等[9]提取脊髓的方法,剪断脊柱两旁的肋骨,剪取第四腰椎节段以上约5 cm左右的脊柱,用50 mL注射器冲出脊髓。留取腰膨大部分,从正中分开成左右两侧,用刀片切取脊髓背角。用RIPA裂解液提取脊髓背角总蛋白,BCA法测定蛋白浓度,加入SDS上样缓冲液后在100℃条件下变性3 min。通过SDS-PAGE电泳转印至PVDF膜上。5%脱脂奶粉中封闭1 h后于兔抗NF-κB p65 一抗(1∶1000)稀释液中孵育过夜,洗涤后与山羊抗兔二抗(1∶5000)摇床孵育2 h。与ECL发光显色液反应显影,利用LAS4010凝胶成像仪采集图像,图片用Image J分析。
1.3 统计学分析
2 结果
2.1 各组大鼠血糖变化情况
如图1所示,各组大鼠基础(base)血糖及高脂高糖喂养5周(5 weeks)血糖均无明显差异;高脂高糖喂养5周后予以STZ单次腹腔注射2周后即第7周(7 weeks),DNP组及DNP+ EA组大鼠血糖明显上升(P< 0.01;P< 0.01);电针干预1周(8 weeks)对DNP大鼠血糖无明显作用。
2.2 各组大鼠机械痛阈变化情况
如图2所示,各组大鼠基础(base)机械痛阈及高脂高糖喂养5周(5 weeks)机械痛阈均无明显差异;高脂高糖喂养5周后予以STZ单次腹腔注射2周后即第7周(7 weeks),DNP组及DNP+ EA组大鼠机械痛阈明显下降(P< 0.01;P< 0.01);电针干预1周(8 weeks)能上调DNP大鼠的机械痛阈(P< 0.01)。
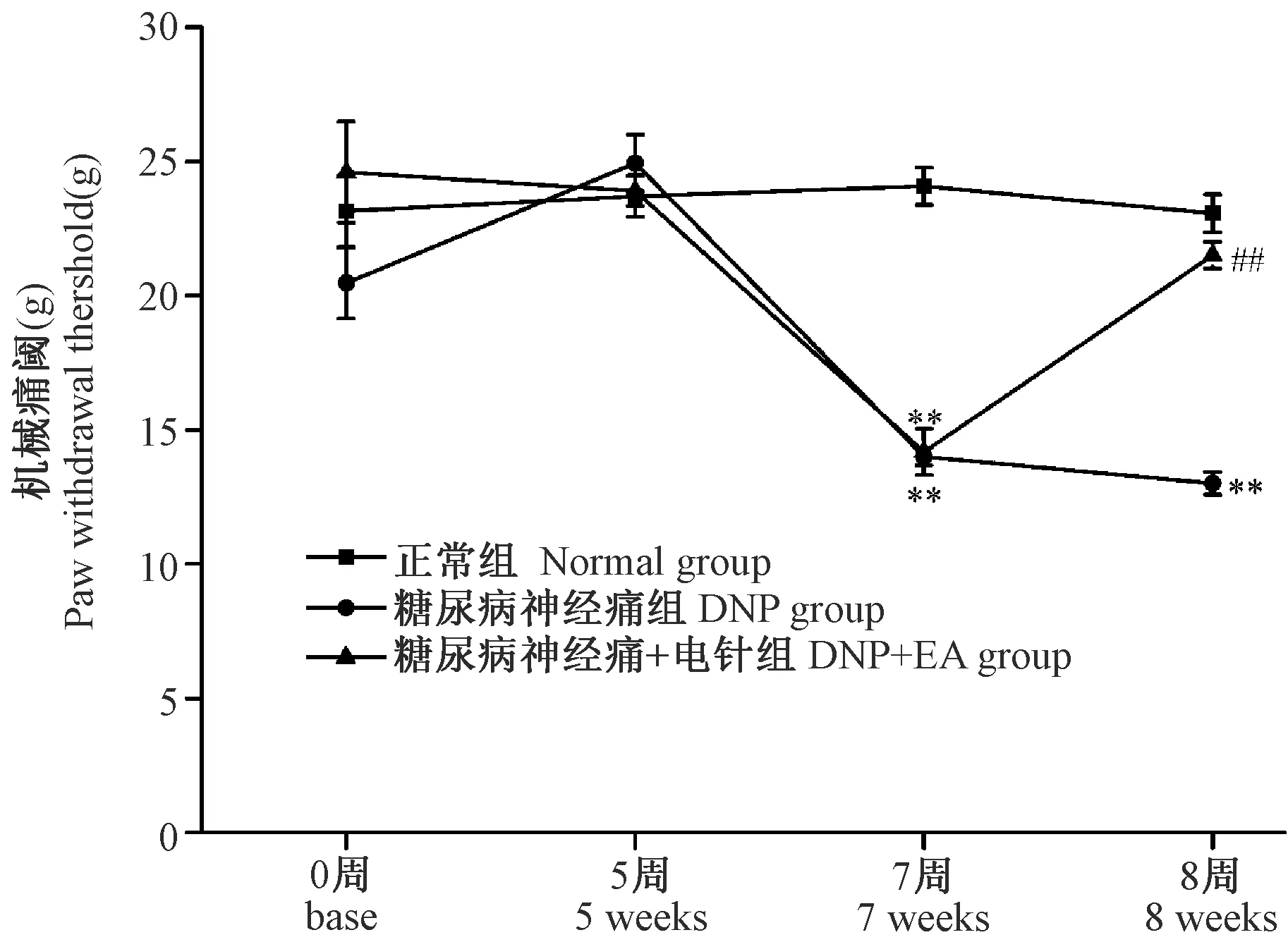
注:与正常组相比,**P< 0.01,与糖尿病神经痛组相比,##P< 0.01。图2 各组大鼠机械痛阈变化情况Note.**P< 0.01, vs the Normal group. ##P< 0.01, vs the DNP group.Figure 2 Changes of paw withdrawal threshold in rats of each group
2.3 各组大鼠热痛阈变化情况
如图3所示,各组大鼠基础(base)热痛阈及高脂高糖喂养5周(5 weeks)热痛阈均无明显差异;高脂高糖喂养5周后予以STZ单次腹腔注射2周后即第7周(7 weeks),DNP组及DNP+ EA组大鼠热痛阈明显下降(P< 0.01;P< 0.01);电针干预1周(8 weeks)能上调DNP大鼠的热痛阈(P< 0.01)。
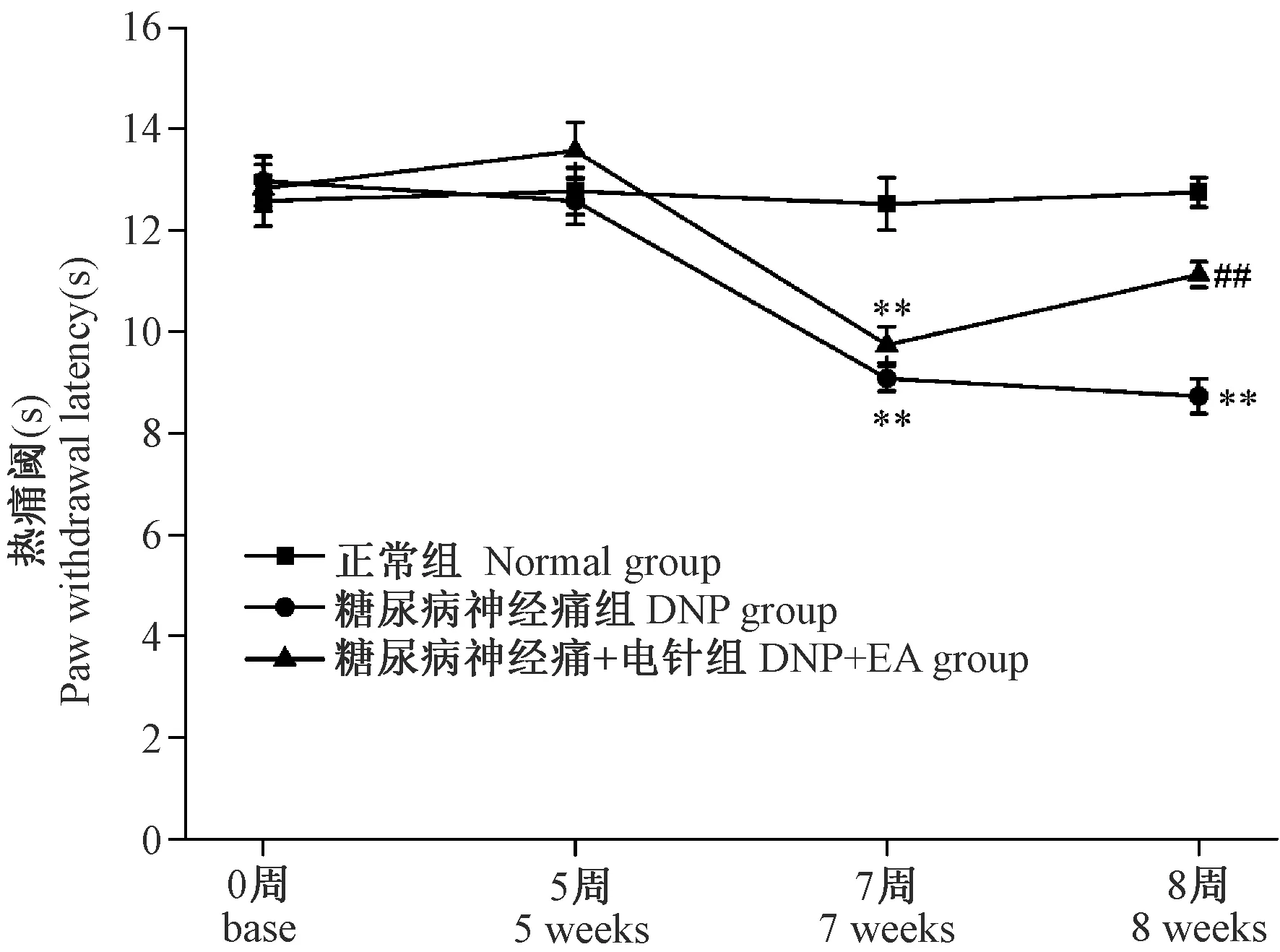
注:与正常组相比,**P< 0.01,与糖尿病神经痛组相比,##P< 0.01。图3 各组大鼠热痛阈变化情况Note. **P< 0.01, vs the Normal group.##P< 0.01, vs the DNP group.Figure 3 Changes of paw withdrawal latency in rats of each group
2.4 各组大鼠坐骨神经变化情况
HE染色观察各组大鼠坐骨神经的变化情况。如图4所示,正常组:坐骨神经有髓神经纤维排列紧密,轴索排列整齐,髓鞘结构完整;DNP组:坐骨神经有髓神经纤维排列紊乱,轴索肿胀,髓鞘密度不均匀,空泡变性。DNP+EA组:坐骨神经有髓神经纤维排列紊乱,轴索肿胀。
2.5 各组大鼠脊髓背角NF-κB p65蛋白表达的变化
采用免疫印迹法检测大鼠脊髓背角NF-κB p65蛋白的表达。如图5所示,与正常组相比,DNP大鼠脊髓背角NF-κB p65蛋白表达增多(P< 0.05),电针干预能下调DNP大鼠脊髓背角NF-κB p65蛋白的表达(P< 0.05)。
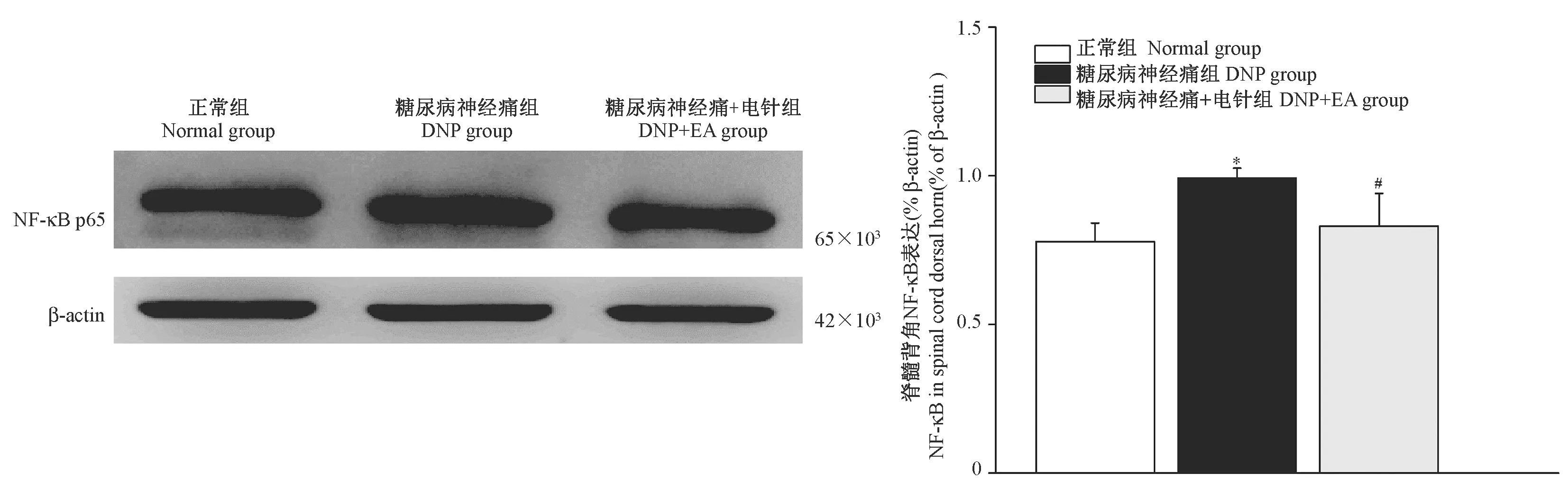
注:与正常组相比,*P< 0.05,与糖尿病神经痛组相比,#P< 0.05。图5 各组大鼠脊髓背角NF-κB p65蛋白变化Note.*P< 0.05, vs. the Normal group.#P<0.05, vs. the DNP group.Figure 5 Changes of NF-κB p65 in the spinal cord dorsal horn of rats in each group
3 讨论
糖尿病神经痛是糖尿病常见的并发症[10],既有痛觉过敏、痛觉超敏、自发痛等神经病理性疼痛的一般表现[11],也会引起不同程度的抑郁、焦虑、失眠等,严重影响患者的生存质量[12]。链脲佐菌素能针对性的损伤胰岛β细胞从而使胰腺减少胰岛素分泌,因此被广泛应用于诱导糖尿病模型[13]。本研究采用高脂高糖饲料喂养5周联合单次腹腔注射STZ建立糖尿病神经痛大鼠模型,大鼠出现血糖明显上升,机械痛阈和热痛阈下降,坐骨神经有髓神经纤维排列紊乱,轴索肿胀,髓鞘密度不均匀,空泡变性。
大量研究表明,电针对不同类型的疼痛都具有良好的镇痛效果[8,14-15],但不同频率的电针对不同性质的疼痛的镇痛效应不同。100 Hz的高频电针对于完全弗氏佐剂所致的炎性痛镇痛效应最好[8]、2/100 Hz对于骨癌痛大鼠的镇痛效应最佳[14]、而2 Hz低频电针对于脊神经结扎神经病理痛大鼠镇痛效应最佳[15]。我们前期研究发现,电针干预糖尿病神经痛存在2 Hz低频电针优于100 Hz高频电针的优势[16],故本研究采用2 Hz低频电针对糖尿病神经痛大鼠进行干预,结果显示低频电针可明显提高DNP大鼠的机械痛阈和热痛阈,表明低频电针能有效缓解糖尿病神经痛。
NF-κB家族主要有p50/p105(NF-κB1)、p50/p100(NF-κB2)、c-Rel、p65(RelA)、RelB五种蛋白组成,其中p65是NF-κB家族中最主要的功能蛋白。NF-κB在药物引起的神经痛模型大鼠脊髓背角表达上升,说明NF-κB参与了神经病理痛[17]。在本研究中免疫印记结果显示,DNP模型大鼠脊髓背角NF-κB p65蛋白较正常组大鼠增多。在高血糖的状态下,NF-κB活性持续升高,引起神经炎症反应,激活小胶质细胞和神经胶质细胞,这进一步增加了炎性介质的释放,释放的神经介质促进了神经纤维对疼痛刺激敏感的敏感程度[18]。免疫印记结果显示电针能降低糖尿病神经痛大鼠脊髓背角中升高的NF-κB p65蛋白,表明低频电针对DNP的干预作用可能与其对有效抑制脊髓背角NF-κB p65蛋白表达有关。
综上,低频电针能有效改善糖尿病神经痛,与其抑制脊髓背角NF-κB p65蛋白的表达有关,表明了低频电针在糖尿病神经痛临床中有较好的应用前景,为电针治疗糖尿病神经痛提供了部分理论依据。
——滋阴养胃 少酸宜甜

