高尿酸血症鹌鹑肠道菌群结构分析
黄胜男,林志健,张冰*,吕锦涛,王如然
(1. 中国中医科学院广安门医院南区,北京 102618; 2. 北京中医药大学,北京 100029)
高尿酸血症(hyperuricemia,HUA)是尿酸生成过多和/或排泄减少导致的一种代谢紊乱疾病。近年来,研究显示它与肠道菌群结构变化有关,例如,新疆维吾尔族和汉族高尿酸血症患者与尿酸正常人群肠道优势菌属有显著差异,高尿酸血症患者粪便中毛螺旋菌科Roseburia属、乳酸菌多于正常人群[1]。肠道菌群是人体不可或缺的一部分,参与机体物质代谢和免疫调节,菌群结构改变可引发代谢紊乱疾病[2]。本课题组前期采用高嘌呤饮食诱导鹌鹑高尿酸血症模型(禽类与人类一样缺乏尿酸酶,嘌呤类物质在体内降解后终产物为尿酸),研究发现高尿酸血症鹌鹑伴有肠道菌群结构变化,广谱抗菌药物可抑制该病理过程[3]。在此基础上,本研究采用PCR-DGGE技术分析高尿酸血症鹌鹑肠道菌群结构变化,为高尿酸血症病理机制研究提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
普通级迪法克鹌鹑20只,雄性,5周龄,体重(150 ± 15)g,购自北京市种禽场德岭鹌鹑分厂【SCXK(京) 11011360218082】,检疫合格证号: 1100546039。动物饲养于北京中医药大学普通级动物实验室【SYXK(京) 2016-0038】。饲养条件:昼夜各半循环照明,温度20 ~ 25℃,相对湿度40% ~ 60%。所有操作均符合北京中医药大学科学实验伦理学要求(伦理审查证号:1100000010039)。
1.1.2 试剂与仪器
酵母干粉(批号:1213550,英国OXOID公司生产);QIAamp DNA Stool Mini Kit(货号:51504,德国Qiagen公司生产);Poly-Gel DNA Extraction Kit(货号:D2561-02,美国OMEGA 公司生产)。16 s rRNA V3区扩增引物(上游341F:5′-CGCCCGGGGCG CGCCCCGGGGCGGGGCGGGGGCACGGGGGGCCTAC GGGAGGCAGCAG-3′;下游518R:5′-ATTACCGCG GCTGCTGG-3′)[4]由上海生工生物工程公司合成。变性梯度凝胶电泳仪 (Bio-Rad,美国);全自动生化分析仪(BECKMAN,美国);PCR仪(Biometra,德国)。
1.2 方法
1.2.1 动物分组与处理
将鹌鹑按体重随机分为正常组和模型组,每组10只。正常组给予普通饲料,模型组给予高嘌呤饲料[普通饲料∶酵母=3∶1,每日喂食酵母15 g/(kg·d)],再补充普通饲料,两组均自由饮水[5]。每7天颈静脉取血1次,分离血清,-80℃保存,取血前禁食不禁水12 h;实验第28天,取血后自由饮水饮食,次日处死,取盲肠内容物,-80℃保存;取盲肠远端1 cm处小段盲肠组织,置于4%多聚甲醛固定。
1.2.2 尿酸含量检测
全自动生化仪检测实验第0天、第7天、第14天、第21天、第28天血清尿酸含量。
1.2.3 细菌DNA提取
精密称取盲肠内容物0.2 g,按照 QIAamp DNA Stool Mini Kit试剂盒说明书提取各样本总DNA,-20℃保存。
1.2.4 PCR-DGGE电泳
PCR扩增:采用细菌通用引物GC-338F和518R为上、下游引物,扩增样品16S rRNA 基因V3可变区,扩增体系(50 μL)为:10×PCR buffer 5 μL,dNTP(2.5 mmol/L)3.2 μL,上、下游引物(浓度均为20 mmol/L)各1 μL,rTaq(5 U/μL)0.4 μL,DNA模板1 μL,补ddH2O至50 μL。扩增条件:预变性94℃ 5 min;变性94℃ 1 min,退火55℃ 45 s;延伸72℃ 1 min,30个循环;最终72℃延伸10 min。采用8%的聚丙烯酰胺凝胶配制35%~55% DGGE变性梯度凝胶,其中含化学变性剂100%尿素7 mol/L、40%(V/V)丙烯酰胺,上样10 μL PCR产物,在1×TAE缓冲液中150 V 60℃下电泳5 h,银染法染色,Gel-Doc2000凝胶成像系统拍照留图[6]。
1.2.5 差异条带分析
灭菌手术刀切下DGGE图谱中两组差异条带,应用Poly-Gel DNA Extraction Kit试剂盒回收DNA片段,以回收产物为模板进行PCR扩增:分别以338F、518R为上、下游引物;扩增体系为10×PCR buffer 5 μL,dNTP(2.5 mmol/L)3.2 μL,上下游引物(20 mmol/L)各1 μL,rTaq(5 U/μL)0.4 μL,DNA模板1 μL,补ddH2O至50 μL;扩增程序为预变性94℃ 4 min,变性94℃ 30 s,退火55℃ 30 s,延伸72℃ 30 s,30个循环,最终72℃延伸10 min。再切胶回收DNA片段,经纯化后,连接到Pmd18-T载体,转化至DH5α感受态细胞,筛选阳性克隆进行序列测定,将序列提交GenBank数据库,Blast程序进行同源性比较[7]。
1.2.6 盲肠组织病理
二甲苯常规脱蜡,乙醇梯度回水,苏木精染液染色,流水洗去玻片上多余苏木精液,1%盐酸-乙醇分色,水洗,氨水返蓝,流水冲洗,0.5%伊红液染色,蒸馏水稍洗;乙醇梯度脱水,二甲苯透明,中性树脂封片[8]。
1.3 统计学分析
2 结果
2.1 鹌鹑血尿酸水平比较
与正常组比较,模型组鹌鹑在实验第7天、第14天、第21天、第28天血尿酸水平显著升高(P< 0.05)。结果见表1。
2.2 盲肠内容物菌群结构分析
2.2.1 细菌16S rDNA PCR扩增
细菌16S rDNA PCR扩增产物经2%琼脂糖凝胶电泳,得到约200 bp的DNA片段(图1),用于DGGE分析。
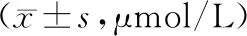
表1 鹌鹑血尿酸水平比较Table 1 Serum uric acid in
注:与对照组比较,*P< 0.05。
Note. Compared with the normal group,*P< 0.05.

注:1-6为正常组;7-12为模型组;M为DNA marker。图1 16S rRNA V3区通用引物GC-338F/518R扩增产物电泳图Note. 1-6,Normal group. 7-12,Model group. M, DNA marker.Figure 1 Electropherogram of amplification products of universal primers GC-338F/518R in V3 region of 16S rRNA
2.2.2 PCR产物的DGGE电泳分析
DGGE电泳图谱见图2,Quantity One软件对条带位置和亮度进行数据化处理和UPGMA相似性聚类分析。与正常组比较,正常组1-6号样品丰度分别为38、40、36、35、38、34;模型组7-12号丰度分别为34、29、28、31、36、32,模型组丰度小于正常组;UPGMA相似性聚类分析结果显示,正常组1、3、5可以聚为一类,相似系数为61%,2、4、6聚为一类,相似系数为66%;模型组7、8、10、11、12可以聚为一类,相似系数为66%。说明正常组和模型组各样品中菌群结构有较大的差异,除了9号样品,其余样品可根据菌群结构相似性区别出正常组和模型组。
2.2.3 差异条带序列分析
采用logistic回归分析方法筛选出两组鹌鹑DGGE电泳图谱12条差异性条带,切胶、回收、克隆测序,测序结果与GenBank数据库中微生物同源性进行比对,结果见表2。利用MEGA 6.0软件对差异条带进行系统发育学分析:差异条带归属于拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)三大类,见图3。有7种同源性大于93%的细菌,分别为厚壁菌门Megamonasrupellensis、Megamonashypermegale、Faecalibacteriumprausnitzii、Clostridiumpopuleti,拟杆菌门Bacteroidescoprocola、Prevotellahisticola和变形菌门Anaerobiospirillumsucciniciproducens。
2.3 盲肠组织病理分析
40倍镜下可见模型组鹌鹑盲肠皱襞变平,隐窝结构紊乱,200倍镜下可见隐窝内炎细胞分布,提示炎性变化(如箭头所示),见图4。
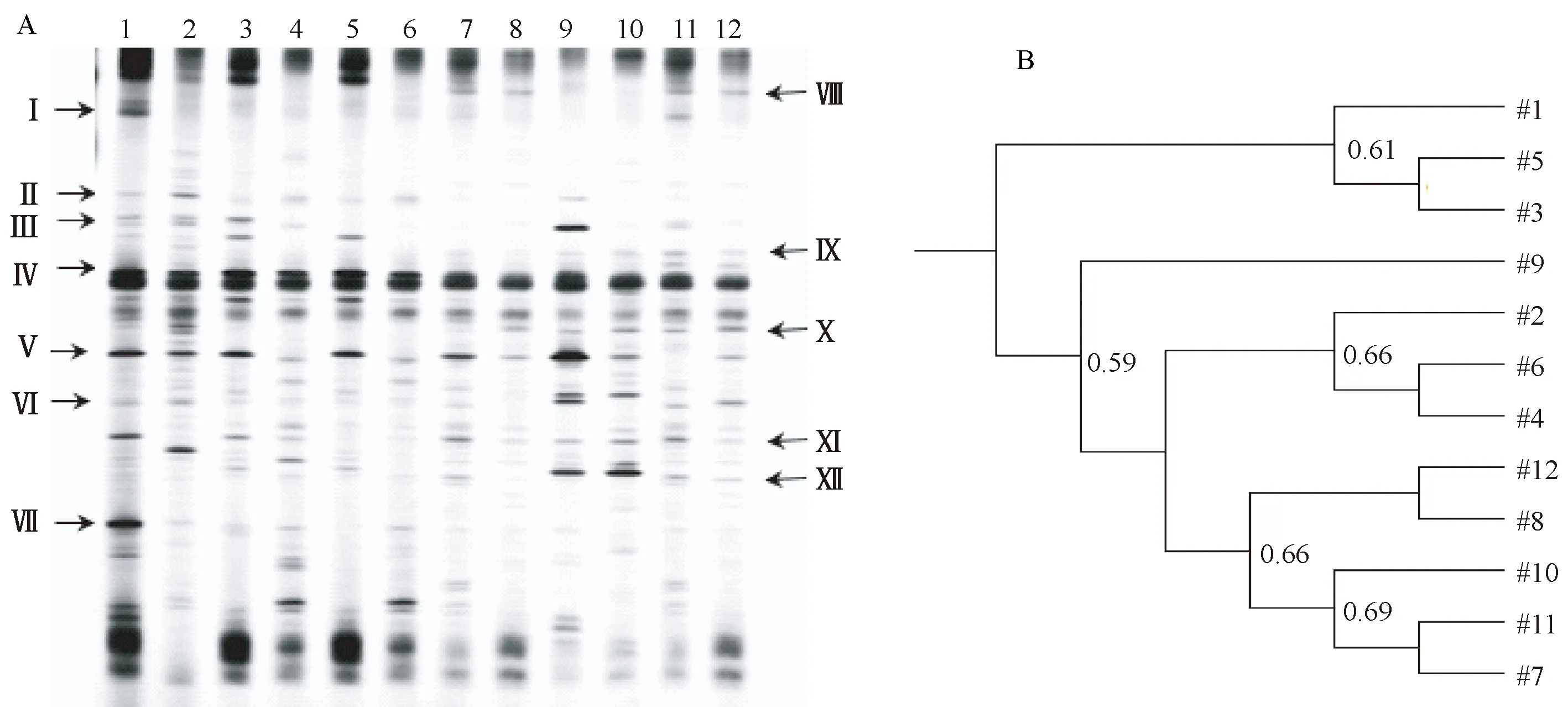
注:1-6为正常组;7-12为模型组。图2 细菌16S rDNA PCR产物DGGE电泳图谱(A)和UPGMA相似性聚类分析(B)Note. 1-6,Normal group. 7-12,Model group.Figure 2 DGGE electrophoretogram of bacterial 16S rDNA PCR products (A)and UPGMA similarity cluster analysis (B)
表2 DGGE图谱中差异条带的序列分析
Table 2 Sequence analysis of differential bands in DGGE diagram
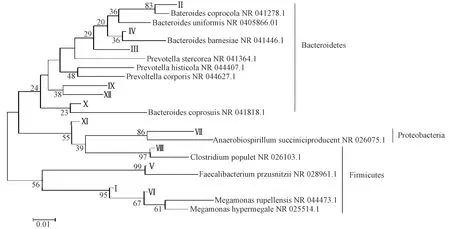
图3 DGGE差异条带系统发育树Figure 3 Phylogentic tree of DGGE differential bands

注:A: 正常组(×40);B: 模型组(×40);C: 正常组(×200);D: 模型组(×200)。箭头:隐窝内炎细胞。图4 鹌鹑盲肠病理切片Note. A, Normal Group(×40). B, Model Group(×40). C, Normal Group(×200). D, Model Group(×200). The arrow:Inflammatory cells in the crypt.Figure 4 Pathological sections of the cecum of quail
3 讨论
肠道菌群是人体不可或缺的一部分,早在上世纪初就有肠道菌群益生作用的记载,它参与人体代谢和免疫调节。近年来研究报道,痛风患者(以血尿酸升高为生化基础)与健康对照人群比较,其肠道菌群组成和分布上存在显著差异[9];维吾尔族、汉族人群中正常人与高尿酸血症患者肠道优势菌属有显著差异[1];实验研究显示,外源性补充酪酸梭菌可在一定程度上降低大鼠血尿酸[10];酿酒酵母菌影响宿主自身免疫促进嘌呤分解,使尿酸生成增多[11],这些研究提示高尿酸血症的发生可能跟某些肠道菌群有关。本研究采用高嘌呤饮食诱导鹌鹑高尿酸血症,模拟临床上饮食不节导致血尿酸水平升高,探讨该状态下肠道菌群结构变化特点,为从调节肠道菌群视角治疗高尿酸血症提供参考。
研究结果显示,高嘌呤饮食喂饲鹌鹑,在造模第7天、第14天、第21天、第28天,其血尿酸水平较正常组鹌鹑显著升高(P< 0.05),造模第28天,盲肠内容物中菌群丰度降低;从DGGE图谱及其差异条带序列分析可以看出,发生改变的菌群主要是拟杆菌门、厚壁菌门、变形菌门,模型组鹌鹑Bacteroidescoprocola、Prevotellamaculosa、Clostridiumpopuleti、Prevotellahisticola等12种细菌优势度改变。Bacteroidescoprocola、Prevotellamaculosa、Prevotellahisticola归属于拟杆菌门,革兰阴性厌氧杆菌,可参与降解多糖,产生乙酸、丁酸和琥珀酸[12];Clostridiumpopuleti归属于厚壁菌门,革兰阳性厌氧菌,也是肠道内常见的纤维降解菌,产生乙酸和丁酸[13]。研究表明,菌群代谢产物乙酸、丁酸等短链脂肪酸(short-chain fatty acid,SCFA)参与能量代谢,抑制炎症因子释放,增强黏膜屏障及免疫功能,增加尿酸肠道排泄[14-15]。拟杆菌属对机体也有致病性,其代谢产生内毒素(endotoxin,LPS)可诱导炎症反应,往往伴有尿酸生成关键酶黄嘌呤氧化酶(xanthine oxidase,XO)活性增加,使尿酸产生增多[16-17]。本研究中,观察到模型组鹌鹑盲肠隐窝结构紊乱及炎性改变,肠道屏障受损,该病理过程可能跟肠道菌群结构改变有关,是影响尿酸肠道排泄的因素之一[14]。
研究方法上,由于肠道细菌以厌氧菌为主,传统的细菌培养方法需专门的厌氧培养环境,实验操作繁琐,且传统微生物培养计数技术仅能反映肠道菌群数目变化,不能反映肠道菌群结构的多样性和种群变化。本研究采用PCR-DGGE方法可简单快速研究菌群结构及种群变化[18-19],具有灵敏度高、重复性好等优点。当然,该方法只能鉴别出数量大于1%的优势菌群的存在,而肠道还存在其他很多微生物,数量占比虽小(如双歧杆菌),但对机体产生了重要作用[20]。因此,在后续的研究中,需采用16 s测序或宏基因组测序法对肠道菌群进行深度分析,明确肠道菌群与高尿酸血症之间的关联关系及可能机制。

