一种产后小鼠束缚应激模型的造模方法以及束缚装置的制作
陈漫漫,高鹏飞
(复旦大学附属金山医院,上海 201500)
在医学动物实验研究中,小鼠属于最常用的实验动物之一,常需在非麻醉状态下对小鼠进行保定从而进行采血、注射等操作[1]。由于小鼠挣扎啃咬会对实验人员安全造成威胁,徒手操作不便,必须借助固定装置和辅助手段加以固定,从而保护实验人员安全,缩短实验时间,提高实验效率[2]。目前,运用最多的是使用金属或有机玻璃制成的固定器,利用小鼠本能进洞的思维[3],使得小鼠主动进入固定器中(图1A)。这些商品化的固定器价格较贵,如果对大批量实验鼠使用固定器,必耗费较多金钱,并且让实验鼠主动进入固定器的过程困难,效率低下。另有其他文献报道的自制新型小鼠固定装置,但是制作过程较为复杂[4]。有研究人员使用矿泉水瓶制作简易小鼠固定装置,但是瓶体质地较软,实验鼠容易挣脱[5]。亦有些装置体积较大不易存放且不易清洗[6]。鉴于上述小鼠固定器的不足,本文提出一种实验鼠固定器的简易制作方法,实验人员自制方便,大批量应用而不需花费过多钱财,有助于节约实验成本,提高动物实验效率。
作者课题组从事应激的中医药治疗研究。产后应激不但威胁产妇的身心健康并且影响婴儿的生命安全。有关研究报道[7]孕期及产后应激会造成子代的下丘脑-垂体-肾上腺轴调节作用紊乱,导致子代出现异常的精神行为。为对产后母鼠应激疾病进行研究,自制简易的小鼠束缚装置,采用束缚应激方式,制造小鼠产后束缚应激模型。该模型在本课题组两项国家自然科学基金面上项目里多次运用,实验证明模型具有稳定性和可重复性,可用于产后应激疾病的相关研究。现对模型以及造模束缚装置进行介绍。
1 材料与方法
1.1 实验动物
从上海西普尔-必凯实验动物【SCXK(沪) 2013-0016】有限公司购入60只SPF级ICR小鼠,雌雄各半。6周龄雌鼠,雌性体重(23.1 ± 1.7)g;7周龄雄鼠,雄性体重(27.2 ± 1.8)g,全部小鼠安置在上海公共卫生临床中心的动物实验室【SYXK(沪) 2015-0008】。动物房温度(21 ± 1)℃,房内照明从早上7点到晚上7点,自由饮水与摄食。本研究所有的动物实验根据美国国立健康卫生指导且经复旦大学公共卫生临床中心动物护理与使用委员会认可。
1.2 方法
1.2.1 束缚装置的制作
实验室就地取材,取实验室常规配备耗材50 mL离心管,自制简易小鼠束缚装置。该装置不仅可以用于束缚应激模型的制备,而且可以用于尾静脉采血、注射,实验室内取材方便,制作简便,操作亦是简单且使用效果良好,可实现较长时间的保定。该装置不仅能用于小鼠保定同样也适用于大鼠。为了说明方便,以小鼠举例。下文将逐步对该小鼠束缚装置的制作、使用方法及注意事项进行介绍:
(1)束缚装置的制备
选择容量规格适合小鼠身型的离心管、剪刀、胶布、橡皮筋共四样(图1B)。例如50 mL离心管可用于产后束缚应激小鼠模型(体重在30 ~ 40 g之间)的制备[8](图1C)。选择合适规格的离心管,取掉离心管的盖子,在离心管盖上用剪刀扎透气孔(图1D),然后用剪刀在离心管壁任意一侧,纵向竖直向下剪,由离心管开口剪到管底部,横向根据小鼠尾部根部粗细,在离心管一侧剪出宽为0.5 cm左右的开口(图1E),再用胶布在管壁剪开的开口周围贴上胶布(图1F),防止管壁开口毛刺划伤小鼠。经过以上的操作,一个小鼠简易束缚装置基本制作完成,后续搭配离心管盖、胶布、橡皮筋使用(图1G)。
(2)使用方法
操作者左手持小鼠束缚装置,装置管口朝外,管底部朝自身,侧壁间隙朝上。右手抓住小鼠尾部,将小鼠放在鼠笼上方或任一平面,用管口对准小鼠臀部,右手施力拖动小鼠尾巴在管壁间隙中滑行,沿着管壁间隙从管口纵行拉向管底,然后用离心管盖抵住洞口,胶布贴于离心管盖及其两侧管壁进行加固,即可把小鼠固定于装置内且小鼠尾部暴露在管壁外(图1H)。接着用橡皮筋箍紧管壁(图1I),既可以防止小鼠从管壁间隙中逃走也能限制小鼠在管内的活动空间。亦可不用离心管盖抵住洞口,选用胶布绕1~2圈小鼠尾巴根部然后环绕管底周围管壁几圈即可固定小鼠于装置内。该装置只需操作者施力即可迅速把小鼠拖入管内,不需要等待引诱小鼠主动进洞,避免小鼠挣扎紧抓洞口耗费时间,提高实验效率,非常方便。

图1 束缚装置的制作步骤Figure 1 Manufacturing procedure of the fixing device
(3)注意事项
①剪管壁间隙时,要注意间隙的宽度要适合小鼠的尾部粗细,间隙尺度要略大于尾部最粗端的尺度,但是不可以过大而让小鼠钻出。
②选择离心管盖抵住离心管口来固定小鼠时,要注意在离心管盖上用剪刀插上孔。虽然管壁上方有一纵行贯穿的间隙,已经不影响管内空气流通,但是保险起见需在离心管盖上用剪刀插上孔透气,孔不能过大以防小鼠嘴巴伸出啃咬。为了离心管盖能稳固地抵住离心管口,可以用胶布贴于离心管盖和两侧管壁进行加固。
③选择胶布固定小鼠尾部于管壁时,用胶布绕小鼠尾巴根部1 ~ 2圈,勿紧,过紧会导致小鼠尾部血液不畅。正确操作是使胶布粘住鼠尾,余下胶布缠绕管底周围管壁几圈,观察鼠尾颜色,确定不影响尾部血循即可,原则是固定而不过紧。
④橡皮筋捆于管壁,不要太靠近小鼠头部处,容易被咬断,最佳位置是捆于小鼠躯干处的管壁。如果没有皮筋,可用胶布替代捆于管壁,胶布绕过管壁间隙接触小鼠毛发处容易粘住动物毛发,所以另撕一小节胶布,反向贴于胶布粘性一侧,使不粘的一侧接触动物毛发,从而保护小鼠安全。
⑤为了加强小鼠保定束缚效果可以既用离心管盖抵住管口又用胶布粘住小鼠尾部固定于管壁,根据操作者需求进行选择。如果只是短暂的保定束缚,可以只选择用离心管盖抵住管口,如果是为了给予长时间束缚应激,可以把两种固定方式结合,加强固定效果。
⑥可以根据小鼠的身长对离心管管壁进行修剪。当离心管管壁过长,可以用剪刀适当裁剪管壁长度来匹配小鼠的身长,尽量缩小小鼠的活动空间。修剪后的管口直径仍然略小于离心管盖的直径,然后用离心管盖罩住管口,并且用胶布加固离心管盖与管壁的连结。
(4)装置适用范围
①尾静脉采血、注射。
小鼠的尾部暴露于离心管外,便于操作者进行尾静脉采血、注射。
②束缚应激模型制作。
例如把产后小鼠固定于装置内限制其行动,每天给予3 h的束缚应激,连续造模21 d即可制备产后束缚应激小鼠模型[9]。
③其它。
在管壁所需要的部位剪洞,进行腹腔注射或者背部注射。
1.2.2 小鼠产后束缚应激模型建立
(1)造模方法
小鼠适应性喂养一周后,以1只雌性搭配2只雄性小鼠交配的方式,将小鼠放在同一鼠笼4 d进行交配,4 d后取出雄性小鼠,单独饲养妊娠成功的雌性母鼠直至实验结束。在母鼠产后第2天,将母鼠移出鼠笼,母子分离,把母鼠装于于自制的束缚装置(后文详述),每天上午9点至中午12点,连续束缚3 h,结束后把母鼠移回原鼠笼,每天1次连续3周,直到断乳。
(2)分组与干预
将相似体重的产后母鼠分为2组,正常组(Control)与产后应激组(immobilization stress, IS),每组8只。产后每天记录母鼠体重与摄食量和仔鼠体重。对于产后应激组母鼠,产后第2天开始,在母子分离基础上,每天给予3 h束缚应激,对正常组母鼠不操作。在产后第22天,通过红外线计数器,测算母鼠运动量,之后人道地处死母鼠,摘取胃与下丘脑。
(3)检测指标与方法
①RT-qPCR 法测基因的mRNA相对的表达量
采用逆转录实时聚合酶链式反应(RT-qPCR)的方法测定胃内ghrelin,5-HT2b受体mRNA表达水平和下丘脑内ghrelin, 5-HT2c受体的mRNA水平。使用RN easy Mini Kit(Qiagen, Hilden, Germany)从样本组织中分离出总RNA,利用Improm-IITM逆转录系统(Promega, Madison, WI, USA)合成cDNA。使用表1列出的引物和QuantiFast SYBR Green RT-PCR(Roche,Swiss)试剂盒进行qPCR分析。循环参数设计在95℃初始化5 min,然后在95℃下10 s为周期进行连续40个循环的变性、延伸、扩增,最后在60℃退火30 s。根据其熔解曲线,以GAPDH基因作内参基因,使用2-ΔΔCt方法测定相对mRNA表达。
②蛋白质印迹(Western blot)法测蛋白的总量
将样本组织放入RIPA缓冲液中裂解。将裂解物进行聚丙烯酰胺电泳(SDS-PAGE)并电转移至聚偏二氟乙烯膜。将该膜放入1%脱脂奶粉中封闭1 h,并在4℃下分别用抗生长素释放肽,抗5-HT2b受体,抗5-HT2c受体。抗甘油醛3-磷酸脱氢酶(GAPDH)孵育过夜,再与过氧化物酶缀合的二抗孵育后,通过增强的化学发光底物检测条带信号信号值,并使用Image Studio软件相对定量分析结果。

表1 实时PCR引物序列Table 1 Primer sequences for Real-time PCR
③免疫组织化学染色法
将组织样品固定在多聚甲醛中,然后石蜡包埋切片。脱蜡和脱水后,将切片浸入3%过氧化氢中,用来阻断内源性过氧化物酶活性,再用pH6.0的柠檬酸盐缓冲液进行抗原的修复。在4℃下将切片分别与生长素释放肽,5-HT2b受体、5-HT2c受体的抗体孵育过夜,然后于室温下和二抗孵育1 h。3,3-二氨基联苯胺(DAB)溶液应用于切片,并用苏木精复染细胞核。
1.3 统计学分析

2 结果
2.1 产后束缚应激母鼠运动量的变化
如图2所示通过红外线感知计数器测量产后第22天母鼠10 min的运动量,发现压力组母鼠的运动量少于正常组母鼠(P< 0.01),两者运动量的差异具有显著性。
2.2 产后束缚应激母鼠体重与摄食的变化
两组母鼠产后记录体重与摄食,如图3所示。应激组母鼠的体重与摄食总体上低于正常组母鼠(P< 0.05;P< 0.01;P< 0.001),差异具有显著性。产后母鼠在束缚应激压力作用下体重与摄食减少。
2.3 产后束缚应激母鼠胃与下丘脑内相关基因的变化
图4显示在母鼠产后第22天,采用RT-qPCR方法,检测胃和下丘脑中与情绪以及代谢相关基因的mRNA表达水平。可以看到下丘脑中的5-HT2c受体与胃中5-HT2b受体在应激组的表达要低于正常组(P< 0.001),下丘脑中的ghrelin和胃中ghrelin在应激组的表达要高于正常组(P< 0.001),差异具有显著性。
图5显示免疫组织化学染色法和蛋白质印记法检测母鼠产后第22天胃内ghrelin、5-HT2b受体和下丘脑内ghrelin和5-HT2c受体的表达水平。图表显示胃和下丘脑标本中应激组的ghrelin蛋白表达表达高于正常组(P< 0.001),应激组胃内5-HT2b受体(P< 0.001)和下丘脑中5-HT2c受体(P< 0.05)的蛋白表达低于正常组,差异具有显著性。

注:与正常组母鼠运动量比较,**P< 0.01。图2 母鼠运动量的变化Note. Comparison of exercise amount with maternal mice in control group,**P < 0.01.Figure 2 Changes of exercise amount in maternal mice
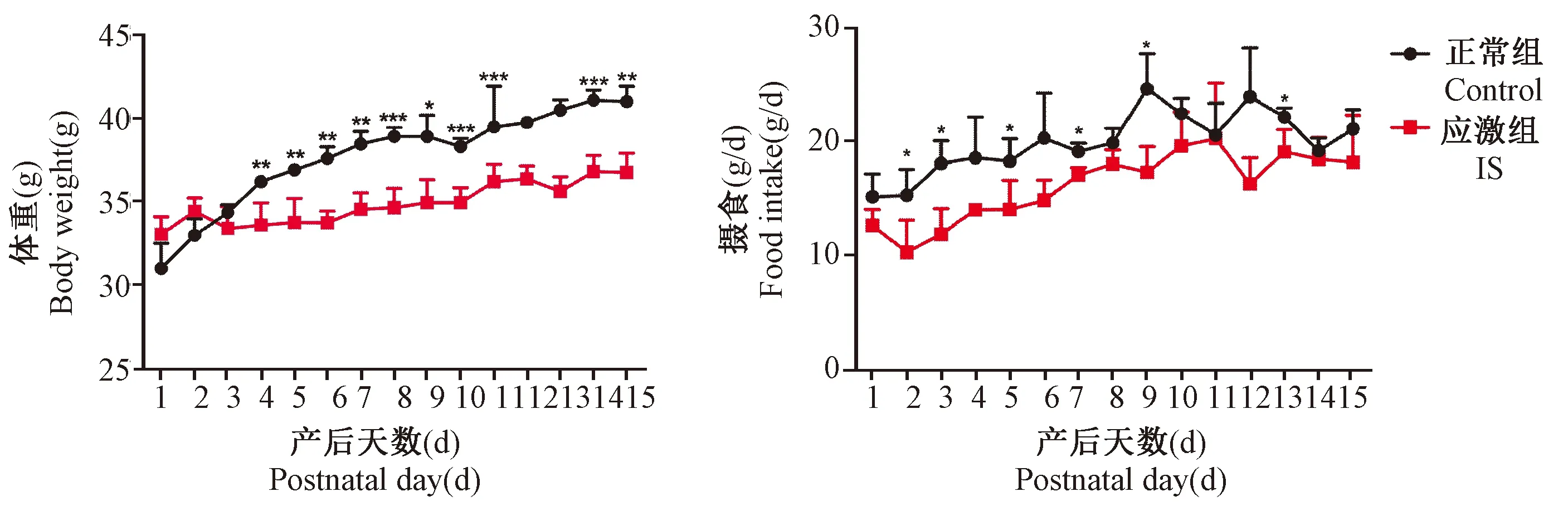
注:与正常组母鼠体重与摄食比较,*P < 0.05,**P < 0.01,***P< 0.001。图3 母鼠体重与摄食的变化Note. Compared with the weight and food intake of maternal mice in control group,*P < 0.05,**P < 0.01,***P < 0.001.Figure 3 Changes of body weight and food intake in maternal mice

注:与正常组相关基因mRNA表达相比,***P < 0.001。图4 应激影响母鼠胃与下丘脑内相关基因的变化Note. Compared with mRNA expression of related genes in control group,***P< 0.001.Figure 4 Changes of related genes in stomach and hypothalamus
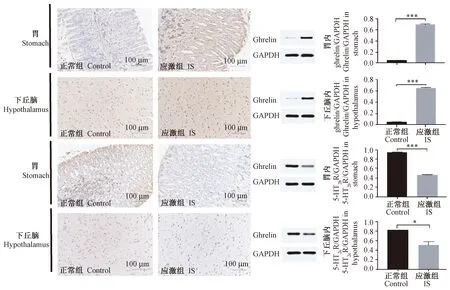
注:通过免疫组织化学染色法和蛋白质印记法检测基因表达,**P < 0.01, ***P < 0.001。图5 应激影响母鼠胃与下丘脑内相关基因的变化(×200)Note. Detection of gene expression by immunohistochemical staining and Western blot, **P < 0.01, ***P < 0.001.Figure 5 Changes of related genes in stomach and hypothalamus(×200)
2.4 产后应激母鼠对子代的影响
应激母鼠产后记录仔鼠的体重,如图6所示,应激组母鼠的仔鼠体重和身长低于正常组母鼠仔鼠(P< 0.001),差异具有显著性。虽然是给予母鼠束缚应激,但是也对小鼠造成了发育不良。体重增长曲线持续观察10周,应激组仔鼠体重仍没有追上正常组仔鼠(P< 0.01)。表明母鼠产后应激会影响子代发育,导致仔鼠持续的生长迟缓,造成子代低体重与营养不良。
另外在第8周应激组仔鼠的运动量高于正常组仔鼠(P< 0.01),差异具有显著性,表明仔鼠长大后有多动的倾向。

注:正常组母鼠的子代与应激组母鼠的子代比较发育状况,**P < 0.01, ***P < 0.001。图6 产后应激母鼠对子代的影响Note. Comparison of offspring development between normal and stressed maternal mice,**P < 0.01, ***P < 0.001.Figure 6 Effect of postpartum stressed maternal mice on the offspring
3 讨论
使用本文自制的束缚装置制作小鼠产后束缚应激模型,具有低体重低摄食,ghrelin高表达,5-HT2受体低表达的特征,并且能造成子代生长发育迟缓。本课题组之前的实验[10-12],同样采用此束缚装置制作产后束缚应激小鼠模型,与正常组相比,应激母鼠的体重与摄食同样呈现减少趋势,母鼠胃和下丘脑内ghrelin表达量升高,下丘脑中的5-HT2c受体与胃中5-HT2b受体表达下降,并且应激组母鼠的仔鼠体质量同样低于正常组母鼠的仔鼠体质量。以上实验证明该装置制作的产后束缚应激模型具有稳定性和可重复性。
近些年来,一些研究表明ghrelin在情绪调节中起着重要作用,例如自杀未遂患者的血清ghrelin水平显著增加[13]、侧脑室注射ghrelin可增加雄性幼年大鼠抑郁样行为[14]、抑郁症患者血清内高ghrelin表达,并且随抑郁的严重程度加重而表达增加[15]。
许多研究已经证实5-羟色胺(5-HT) 与情绪障碍相关[16],例如恐惧、焦虑、抑郁等不良情绪。据报道,低血清素活性可能导致许多心理障碍,如冲动性,攻击性和自杀意念,并且血清素能系统和生长素释放肽之间存在相互作用[17-19]。
在人类和动物模型中,血清素(又名5-羟色胺或5-HT)的摄取与焦虑、抑郁等情绪密切相关,是广泛使用的抗抑郁和抗焦虑药物的作用位点[20]。5-HT的受体具有许多亚型,有研究报道抑郁症患者较正常人脑内5-HT受体的数量偏低且敏感性下降[21],其中5-HT2受体与抑郁症密切相关[22]。5-HT2b受体主要分布于周围组织,有研究显示5HT2b受体的表达与抑郁症状呈相关性,在帕金森伴抑郁小鼠的脑皮质中5-HT2b受体表达下降[23]。在慢性应激导致快感缺乏的小鼠中,5-HT2b受体表达显著降低[24]。激活胃内5-HT2b受体能够抑制ghrelin的分泌[25]。5-HT2C受体是5-HT受体的另一种亚型,广泛分布于中枢神经,在抑郁症新治疗策略的开发受到重要的关注[26]。5-羟色胺再摄取抑制剂治疗对5-HT2C受体的间接激活,可能有助于改善厌食和焦虑作用[27]。
本文介绍的产后小鼠束缚应激模型具有低体重低摄食,胃与下丘脑以及血清内ghrelin表达量增加,5-HT2受体等基因表达量减少,运动量减少等抑郁样症状,能造成子代生长发育迟缓并有多动倾向,可供产后应激疾病等研究。并且多次实验[8,10-11,28]证明此束缚装置对于束缚应激模型的造模是具有可重复性和稳定性。
此文章讲述的自制简易小鼠束缚装置,材料准备方便,制作简便,成本低廉,体积小巧,便于收纳保存。该装置只需选取合适容量规格的离心管,能够对大小不同的实验鼠进行固定限位。只需操作者施力即可迅速把实验鼠拖入管内,不需要等待实验鼠主动进洞,避免实验鼠挣扎紧抓洞口耗费时间,有利于提高实验效率。使用该装置进行尾静脉采血或注射,能保护实验人员不被小鼠咬伤,且透明管壁有助于观察小鼠的情况。
除了运用于小鼠束缚应激模型的制备外,该装置还可以用于尾静脉采血、注射。根据实验鼠身型大小选择合适容量的容器,用上述方法制作简易束缚装置,既能运用于小鼠又能用于大鼠。以上全部内容就是产后束缚小鼠应激模型以及束缚装置的制作方法介绍,供实验人员借鉴与使用。

