糖尿病下肢溃疡小鼠模型的建立与评价
鲁珽,辛永萍,林家彬,陈民利
(1. 浙江大学医学院附属第二医院临床研究中心,杭州 310009;2. 浙江中医药大学动物实验研究中心,杭州 310053)
糖尿病是继肿瘤、心血管疾病之后,严重威胁人类健康的主要疾病之一。因糖尿病引起的外周血管病变(peripheral arterial disease,PAD)是正常人的2 ~ 4倍,可累及全身重要血管,导致多种血管并发症,广泛影响着世界范围内的糖尿病患者[1]。其中,糖尿病下肢血管病变在糖尿病患者中约占20%,常发展为严重下肢缺血,最终伤口难愈合、坏疽,甚至导致截肢[2]。目前,临床上对于糖尿病下肢血管病变仍面临巨大困难,迄今也未发现特别有效的药物和治疗措施[3],当病人足部发生坏疽时,截肢往往是患者和医生的唯一办法。模拟糖尿病并发外周血管疾病的动物模型,对糖尿病血管疾病研究至关重要。良好的动物模型可以帮助我们探究疾病的发病机制,筛选有效的治疗药物和措施。本实验在糖尿病小鼠模型的基础上建立下肢溃疡模型,用激光多普勒监测血流变化,观察模型足部坏死情况和缺血组织病理改变。并与单纯下肢缺血模型相比较,发现糖尿病下肢溃疡模型的特殊性。为研究糖尿病外周血管病变的发病机制和治疗措施提供依据和基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雄性ICR小鼠,8周龄,体重(35 ± 2)g,90只,来源于上海斯莱克实验动物有限责任公司【SCXK(沪) 2017-0005】。饲养于浙江大学医学院附属第二医院实验动物中心屏障环境【SYXK(浙) 2015-0010】,饲喂60Co辐照全价营养颗粒饲料,温度(22 ± 2)℃,相对湿度50% ~ 70%,12 h/12 h明暗交替,实验动物伦理批件号:浙医二院(2019年度)第(085)号。
1.1.2 试剂及仪器
链脲霉素(STZ,上海生工生物工程股份有限公司);Anti-CD31抗体(ab28364,abcam);Anti-alpha smooth muscle Actin抗体(ab124964,abcam);Periscan PIM II激光多普勒血流成像仪扫描(瑞典帕瑞医学科技有限公司);滨松NanoZoomer数字病理切片扫描仪(日本滨松);罗氏卓越型血糖测试仪(德国罗氏)。
1.2 方法
1.2.1 分组与造模
所有ICR小鼠适应性饲养1周后,随机分成3组,每组30只,即糖尿病下肢溃疡组、下肢缺血组和糖尿病组。糖尿病下肢溃疡组和糖尿病组小鼠建立糖尿病模型;糖尿病下肢溃疡组和下肢缺血组小鼠建立下肢缺血模型。
1.2.2 小鼠糖尿病模型的建立
造模前,小鼠禁食不禁水8 h,腹腔注射链脲佐菌素(STZ)溶于pH=4.5的柠檬酸缓冲液,连续给药3 d,剂量分别为第一次80 mg/kg、第二次60 mg/kg、第三次80 mg/kg。继续饲养1周后尾部采血检测血糖(重复3次),随机血糖 > 16 mmol/L 或空腹血糖11.1 mmol/L 认定为糖尿病小鼠模型成功。
1.2.3 小鼠下肢缺血模型的建立
糖尿病模型建立成功后,糖尿病下肢溃疡组和下肢缺血组小鼠采用高位结扎股动脉、股静脉并断离股动脉的方法建立下肢缺血模型,糖尿病组小鼠仅采用假手术处理,术后无动物死亡。
小鼠使用0.3%戊巴比妥钠腹腔注射麻醉,剂量为0.25 mL/10 g,待小鼠肌肉松弛,四肢无活动,触碰胡须无反应时,将小鼠仰卧固定于手术台上,用脱毛膏去除双下肢鼠毛,75%酒精消毒皮肤,右下肢为手术区,在体视显微镜下近卵圆窝处剪开皮肤,暴露股动脉,分离伴行静脉和神经,用 4 ~ 0 丝线结扎股动脉和静脉,在近膝关节处动脉分叉上端也相应结扎血管,剥离血管,用眼科剪离断动脉,无菌棉球按压止血5 min,然后用 6 ~ 0 线缝合皮肤,75%酒精消毒一遍,俯卧置于37℃恒温电热毯上保温30 ~ 60 min至小鼠苏醒。
1.2.4 指标观察和检测
(一)一般体征观察
动物分别于糖尿病造模前,下肢缺血手术前,术后第7、14、21天称量体重。手术后第14天,观察小鼠肢体缺血情况,用以下评估参考分值来判断:肤色、皮温未发生明显改变计0分;坏死局限于脚趾计1分;坏死局限于足背计2分;坏死局限于小腿计3分;坏死范围波及大腿以上计4分。
(二)激光多普勒检测
激光多普勒血流成像仪分别于缺血手术术前,术后第0、3、7、14、21天动态监测各组小鼠下肢血流变化情况,取缺血部位平均灌注量/正常部位平均灌注量进行统计分析。
使用激光多普勒血流成像仪扫描,每只小鼠记录约为20 s。小鼠麻醉后放在37℃恒温垫上保持体温,并去除下肢新生鼠毛,待小鼠循环呼吸平稳后仰卧固定于检测垫上,未手术左下肢为参照,计算右下肢相对血流灌注情况。检测完成后俯卧置于37℃恒温电热毯上保温30 ~ 60 min至小鼠苏醒。
(三)组织取材
缺血手术第21天,过量麻醉处死动物,取腓肠肌,中性福尔马林固定、常规脱水、浸蜡、包埋、切片。进行HE染色,CD31及SMA免疫组化染色。
1.3 统计学分析
2 结果
2.1 一般体征与体重变化
糖尿病下肢溃疡组和糖尿病组小鼠在造模成功后,能出现典型的“三高一低”糖尿病症状。缺血术后第21天,糖尿病下肢溃疡组存活28只,下肢缺血组存活27只,糖尿病组存活29只。如图1所示,注射STZ后,糖尿病下肢溃疡组和糖尿病组体重略有增加,但不明显;缺血术后7 d,三组小鼠体重皆有下降,糖尿病下肢溃疡组变化最大;术后第14天,三组小鼠体重开始增长,下肢缺血小鼠体重增长最快;术后第21天,只有下肢缺血组小鼠体重继续增长,其余两组都有不同程度体重下降,其中糖尿病下肢缺血组下降更明显,甚至较缺血术后仍有很大程度下降。
2.2 缺血下肢坏死评价
下肢缺血手术后第14天,小鼠缺血腿会发生不同程度坏死(见图2),并评价小鼠下肢缺血坏死程度,标准如下:肤色、皮温未发生明显改变计0分;坏死局限于脚趾计1分;坏死局限于足背计2分;坏死局限于小腿计3分;坏死范围波及大腿以上计4分。
术后第14天,各组评分情况如表1所示。糖尿病下肢溃疡组平均评分最高,单纯下肢缺血组次之,糖尿病组接近于正常状态(见图3)。糖尿病下肢溃疡组小鼠多为1分和2分;单纯下肢缺血小鼠多为0分和1分(见图4)。
表1 糖尿病下肢溃疡组、糖尿病组和下肢缺血组小鼠坏死评分
Table 1 Necrosis scores of mice in diabetic hindlimb ulcer group, diabetic group and hindlimb ischemia group

组别Groupsn0分0 point1分1 point2分2 point3分3 point4分4 point糖尿病下肢溃疡组Diabetic hindlimb ulcer group28214732下肢缺血组Hindlimb ischemia group27158220糖尿病组Diabetic group29272000

图3 糖尿病下肢溃疡组、糖尿病组和下肢缺血组小鼠平均评分Figure 3 Mean scores of mice in diabetic hindlimb ulcer group,diabetic group and hindlimb ischemia group

图4 糖尿病下肢溃疡组、糖尿病组和下肢缺血组小鼠评分分布Figure 4 Distribution of scores indiabetic hindlimb ulcer group, diabetic group and hindlimb ischemia group
2.3 下肢血流灌注变化监测结果
为了监测糖尿病下肢溃疡组、下肢缺血组和糖尿病组小鼠在缺血手术前后下肢血流灌注变化,用激光多普勒成像仪分别于术前,术后当天,术后第3、7、14、21天,监测小鼠下肢的血流情况(见图5)。
由各时间点多普勒血流灌注变化可知,糖尿病组小鼠下肢并未出现明显血流变化;下肢缺血组和糖尿病下肢溃疡组小鼠,术后缺血肢血流明显减弱,说明下肢缺血模型建立成功。术后,缺血肢皆有不同程度的恢复。单纯下肢缺血小鼠组的程度明显优于糖尿病下肢缺血组。如图5所示,术后第14天,下肢缺血组的血流灌注已比较充分,第21天几乎完全恢复。而糖尿病下肢溃疡组,术后第7、14、21天,恢复都不显著,甚至有加重趋势。用手术肢(右腿)/健全肢(左腿)的比率表示缺血下肢的血流灌注比,如图6所示,术后糖尿病下肢溃疡组和下肢缺血组的灌注比都明显下降,术后灌注比都有显著恢复下肢缺血组略好于糖尿病下肢溃疡组。第14天下肢缺血组灌注比继续恢复,第21天接近于正常,而糖尿病下肢缺血组灌注比却有明显下降。糖尿病组全程灌注比几乎不发生变化。
2.4 缺血下肢组织病理改变
术后第21天,取手术肢(右腿)腓肠肌HE染色(图7A):下肢缺血造模21 d后,糖尿病下肢溃疡组和下肢缺血组肌肉组织结构破坏,肌纤维呈现出明显的间隙,有炎症细胞浸润。其中,糖尿病下肢溃疡组肌肉组织结构破坏更加严重,间隙更明显。而糖尿病组肌肉组织变化不明显,结构未破坏。CD31存在于内皮细胞内,可用于评估血管新生。如图7B所示,糖尿病下肢溃疡组和下肢缺血组肌肉组织中,CD31表达明显,而糖尿病组几乎没有表达。如图7C所示,SMA在糖尿病下肢溃疡组和糖尿病组的肌肉组织都有显著的表达,而下肢缺血缺血组表达不明显,提示SMA的表达可能与糖尿病相关。
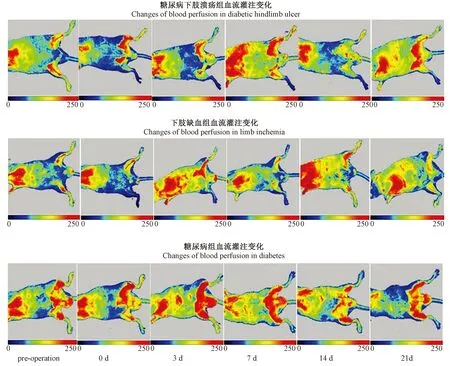
图5 糖尿病下肢溃疡组、糖尿病组和下肢缺血组小鼠血流变化Figure 5 Changes of blood flow in diabetic hindlimb ulcer group, diabetic group and hindlimb ischemia group

图6 糖尿病下肢溃疡组、糖尿病组和下肢缺血组小鼠血流灌注比变化Figure 6 Changes of blood perfusion ratio in diabetic hindlimb ulcer group, diabetic group and hindlimb ischemia group

图7 糖尿病下肢缺血组、糖尿病组和下肢缺血组小鼠手术肢腓肠肌HE染色(A),CD31(B)和SMA(C)表达Figure 7 HE staining(A), CD31(B) and SMA(C) expression in the gastrocnemius muscle of operated limbs of mice in diabetic hindlimb ulcer group, diabetic group and hindlimb ischemia group
3 讨论
糖尿病外周血管病变(peripheral arterial disease,PAD)是导致糖尿病足溃疡,下肢截肢的主要原因。糖尿病足作为糖尿病常见的难治性慢性并发症之一,发病率高达25%[4]。目前,临床上PAD的治疗有很大的局限性,外科旁路手术或血管内介入无法处理糖尿病下肢广泛又弥漫性血管狭窄、闭塞。对于缺乏代偿性侧支的患者,采用任何手段都难使血管再通[5]。糖尿病血管病变的发病机理复杂,确切的分子病因和发病机制仍未完全阐明[6]。因此,仍需进一步研究糖尿病外周血管病变的机制,探索新的有效治疗方法。建立可靠的由缺血引起的下肢溃疡动物模型是研究PAD发病机制,评价其治疗方法的基础。目前,常用的动物模型可分为模拟病理因素和模拟临床病征的动物模型两大类[7]。由于糖尿病动物自发病变形成足部溃疡耗时较长,不确定因素大,因此人为的阻断下肢血供从而造成缺血是构建下肢溃疡模型有效而可行的方法之一。小鼠下肢缺血模型造模方法有很多,根据不同的需要,模型可分为暂时性缺血和永久性缺血。永久性缺血模型又可以分为结扎切除法和缩窄栓塞法[8]。本实验在前期的研究中发现采用高位结扎股动脉、股静脉并断离股动脉的方法建立下肢缺血模型,肢体缺血明显、稳定且持久,对小鼠的创伤较小。腹腔注射STZ是常用的建立糖尿病模型的方法,给药连续3 d后,小鼠便出现“三多一少”的糖尿病典型症状,连续3次随机血糖 >16或空腹血糖≥11.1 mmol/L 认定为糖尿病小鼠模型成功。
体重的变化可以反应小鼠的生理状况和缺血恢复。实验显示,糖尿病造模成功后,糖尿病小鼠体重变化不明显,增幅略小于正常小鼠。缺血术后,小鼠体重都有显著下降;术后7 d,各组小鼠体重都有明显的回升;术后第14天,糖尿病下肢溃疡组体重却有显著的降低,甚至较术后低值仍有下降,而下肢缺血组体重逐渐恢复到正常水平。显然糖尿病下肢溃疡小鼠受到了糖尿病和下肢缺血的共同影响,恢复较下肢缺血小鼠差。这说明下肢缺血能在短期内对小鼠造成损伤,但机体能在短时间内自我修复;而糖尿病并发下肢缺血对小鼠的损伤更大,短时间无法恢复,甚至可能造成二次损伤。
肢体坏死是缺血的严重病症表现,通常坏死和溃疡也是同时存在的。糖尿病下肢溃疡组小鼠缺血肢基本都有不同程度的坏死,且多数坏死波及脚掌以及脚掌以上;下肢缺血组多数已经复原,坏死也仅限于脚趾。Kant等[9]发现使用经典的抗炎、抗氧化药物姜黄素能提高抗氧化酶和抗炎因子的水平,在修复糖尿病溃疡上有较大应用前景。我们也在实验中发现,仅限于脚趾的溃疡是可以恢复的,但溃疡坏死波及到脚掌及以上是很难恢复的,甚至可能发生肢体坏死脱落,这可能与小鼠自身的抗炎抗氧化能力有关。
持续肢体缺血的动物模型必须具备以下4个条件[10]:(1)出现一定程度的缺血;(2)缺血可以保持一段时间;(3)缺血可以通过实验测得的数值所证实;(4)缺血的肢体和正常的肢体可以进行比较。多普勒血流监测结果显示,糖尿病下肢溃疡和下肢缺血小鼠术后第0、3、7天缺血明显;术后第14、21天,下肢缺血小鼠血供趋于正常,而糖尿病下肢溃疡小鼠仍明显可见血供不足。这说明糖尿病下肢溃疡小鼠缺血时间长,自体恢复差,该模型缺血明显且稳定。本实验用手术肢(右腿)/健全肢(左腿)的比率显示血流变化,这样可以排除环境和动物个体差异。结果显示,缺血术后,糖尿病下肢溃疡组和下肢缺血小鼠患肢血流都有显著的增加,可能是机体对缺血的反应,是缺血肢侧支循环的重建和再通。术后第14、21天,下肢缺血组血流继续恢复,并接近正常状态;糖尿病下肢溃疡组却趋于平台期,甚至有所恶化。手术肢腓肠肌病理切片显示糖尿病下肢溃疡组和下肢缺血组肌肉组织结构破坏,并有炎症细胞浸润,糖尿病下肢溃疡组肌肉组织结构破坏更严重。CD31存在于内皮细胞内,用于评估血管新生。免疫组化结果显示糖尿病下肢溃疡组和下肢缺血组肌肉组织都有CD31表达,下肢缺血组CD31表达量高于糖尿病下肢溃疡组,说明糖尿病可能阻碍了血管新生。有研究表示[11]:糖尿病导致的外周血管病变会使局部缺血缺氧,血管内皮生长因子(VEGF)表达量下降,造成伤口久治不愈。SMA表达体现了平滑肌细胞的增殖,本实验显示,SMA的表达和下肢缺血无明显相关,但与糖尿病有密切关系,可能在糖尿病导致的外周血管病变中,平滑肌细胞增殖阻碍了血管新生,进而影响侧支循环的恢复,造成患肢继续缺血溃疡坏死。
糖尿病溃疡的发病是由血管病变、神经病变、感染和其他多种致病因素综合作用的结果[12]。本动物模型诱发糖尿病发生并继发下肢缺血,能很好的模拟临床诱导自发性的糖尿病下肢溃疡、糖尿病足,稳定而持久。结合多普勒血流监测和坏死评价,便于定量分析,可信度高,成模率较高,可以用于糖尿病导致的外周血管病变、糖尿病足的发病机制研究和治疗药物的筛选。但本模型建立的是急性下肢缺血,可能与临床糖尿病引起的慢性缺血造成的糖尿病足有所区别,仍需要对模型进行改进使之更贴近于临床。

