炎症性肠病发生消化道狭窄的临床特点分析
杨善兵, 杜树文, 张丽敏, 贾康妹, 陆晓娟, 范 鑫, 李 舒, 贾 燕, 杨欣艳, 金 鹏, 王继恒
中国人民解放军总医院第七医学中心消化内科,北京 100700
炎症性肠病(inflammatory bowel disease,IBD)是一类病因不明的慢性非特异性的肠道炎性疾病,在世界大部分地区IBD的发病率和患病率呈稳步上升趋势。随着我国经济的不断发展,生活方式的不断“西式化”,IBD发病率急剧上升[1],我国流行病学资料显示,IBD的标化发病率为1.77/10万和3.14/10万[2-3],随之而来的是日益增多的并发症、患者劳动能力的丧失、医疗资源的大量投入,严重降低了患者的生活质量。消化道狭窄是IBD患者最常见的严重并发症之一,增加了患者的住院率,降低了生活质量。目前我国尚无关于IBD患者合并消化道狭窄的大样本临床数据,故探讨IBD患者消化道狭窄的发生率、治疗及转归等情况对该疾病人群诊疗规范的制定有一定帮助。本研究回顾了2010年1月至2018年12月中国人民解放军总医院第七医学中心发生消化道狭窄的住院IBD患者的诊治及随访情况,并报道如下。
1 资料与方法
1.1 一般资料2010年1月至2018年12月在中国人民解放军总医院第七医学中心诊治的住院IBD患者共510例,男328例,女182例,男女比1.8∶1,发病年龄(37.9±14.9)岁(7~85岁)。中位患病病程48个月(1~492个月)。筛选出发生消化道狭窄患者118例。
1.2 IBD的诊断标准参照我国2018年炎症性肠病诊断与治疗的共识意见[4]。消化道狭窄:由疾病直接或间接引起的消化道管壁炎性增生、纤维增生、瘢痕挛缩、肠腔占位等因素造成的消化道管腔狭窄,通过消化内镜检查(包括电子胃镜、结肠镜及小肠镜等)确诊。
1.3 研究方法采用回顾性研究方法,对发生消化道狭窄的118例IBD患者临床特征、发病年龄、消化道狭窄发生部位、内镜检查、外科手术及随访情况进行分析。

2 结果
2.1 一般资料共纳入510例住院IBD患者,419例患者的病程为0~10年,91例患者的病程>10年。克罗恩病(Crohn’s disease,CD)患者122例,溃疡性结肠炎(ulcerative colitis,UC)患者315例,IBD类型待定(IBD unclassified,IBDU)患者73例。发生消化道狭窄的住院IBD患者118例,其中CD 72例,UC 21例,IBDU 25例。CD、UC和IBDU患者消化道狭窄的发生与男女性别比例比较,差异无统计学意义(P>0.001)(见表1)。
IBD患者消化道狭窄的总体发生率为23.14%,CD、UC和IBDU各自的消化道狭窄发生率分别为59.02%、6.67%和34.25%,三者两两比较,差异均有统计学意义(P<0.001)。病程0~10年的患者发生消化道狭窄105例,发生率为25.06%(105/419),而病程>10年的患者发生消化道狭窄13例,发生率为14.29%(13/91)。两组消化道狭窄发生率比较,差异有统计学意义(χ2=4.880,P=0.027)。
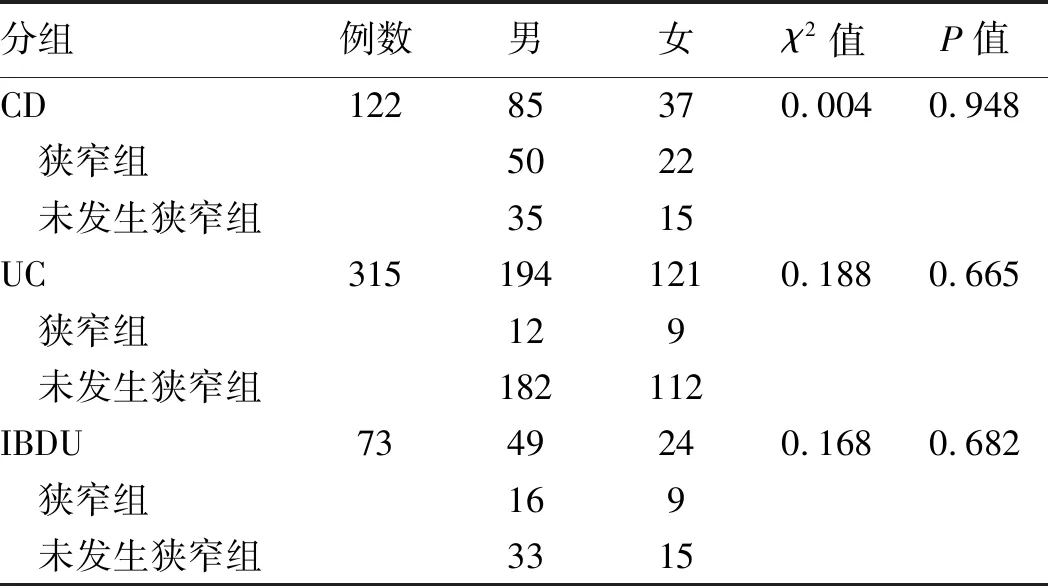
表1 住院IBD患者消化道狭窄发生的性别差异Tab 1 The differences of gender between hospitalized IBD patients with or without digestive tract stenosis
2.2 消化道狭窄发生的部位72例CD患者消化道狭窄的发生部位主要位于末端回肠及回盲部(46例)(其中1例合并食管及结肠两处狭窄)。21例UC患者消化道狭窄的部位均位于左半结肠。25例IBDU患者消化道狭窄的发生部位主要位于末端回肠及回盲部(13例)(见图1)。
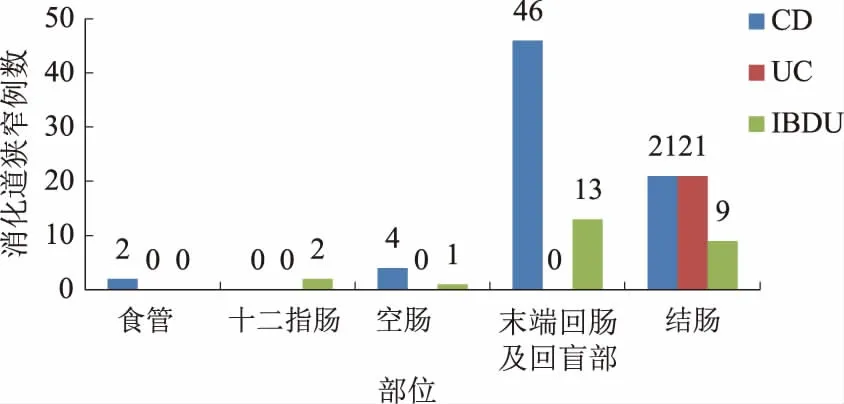
图1 住院IBD患者消化道狭窄的发生部位
2.3 消化道狭窄的治疗及预后33.90%(40例)发生消化道狭窄的IBD患者予以内科药物及营养治疗有效。56.78%(67例)的消化道狭窄患者予以外科手术治疗,CD、UC和IBDU的手术率分别为72.22%、14.29%和48.00%,三者手术率两两比较,差异均有统计学意义(P<0.05);外科手术术后并发症发生率为17.91%,三者术后并发症发生率比较,差异无统计学意义(P>0.05);再次手术率为10.45%。27.12%的消化道狭窄患者予以内镜下治疗(32例),其中81.25%的患者内镜治疗有效(包括单纯内镜治疗有效11例,外科治疗术后吻合口狭窄内镜治疗有效15例);18.75%的患者内镜治疗无效后行外科手术治疗(内镜治疗无效后行外科手术治疗患者5例,吻合口狭窄内镜扩张无效后行外科手术1例)(见表2)。内镜治疗术后并发症发生率为3.13%(1/32),为1例CD患者术后出血。
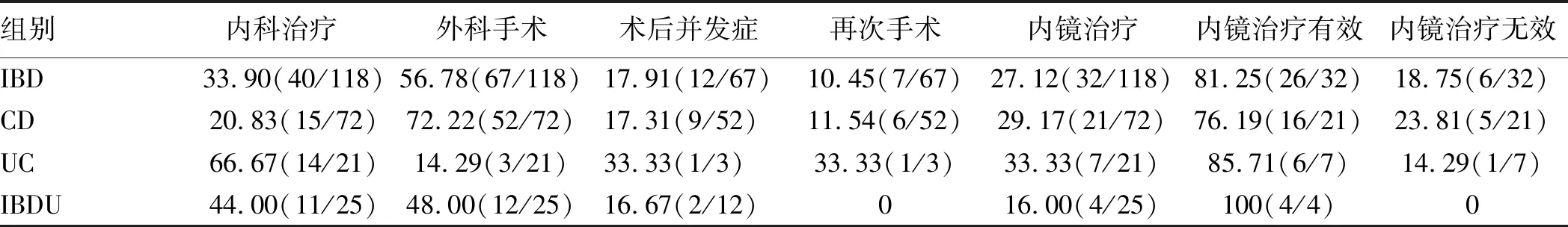
表2 发生消化道狭窄住院IBD患者的治疗情况
3 讨论
消化道狭窄是IBD的严重并发症之一,一般认为消化道狭窄的发生是由该疾病的生物学行为所决定的,其发生、发展过程则与疾病控制欠佳相关。IBD患者消化道狭窄的发生率较高,约11%的CD患者在诊断之初即已出现消化道狭窄[5],随着病程进展,30%~50%的CD患者将会出现不同程度的消化道狭窄[6-7]。本研究中,住院IBD患者的消化道狭窄总发生率为23.14%,其中,CD、UC和IBDU患者的消化道狭窄发生率分别为59.02%、6.67%和34.25%,且三组消化道狭窄发生率比较,差异有统计学意义,这考虑是由CD疾病行为更具有侵袭性、穿透性造成的。目前为止,尚无可靠治疗方法阻止消化道组织纤维化及预防狭窄的形成[8],而既往研究显示,应用免疫抑制剂或生物制剂治疗,虽可有效控制消化道的炎症从而达到黏膜愈合,却难以阻止消化道纤维化、狭窄的进展[9-10]。目前IBD患者发生消化道狭窄的性别差异方面研究较少,本研究中IBD患者发生消化道狭窄的男女比例比较,差异无统计学意义。
IBD消化道纤维性狭窄主要由消化道管壁组织纤维化和细胞外基质(extracellular matrix,ECM)过度沉积造成,这与机体其他组织、器官发生纤维化的机制相似,同时还与肠道微生态密切相关[10]。根据狭窄病理类型可分为炎性狭窄和纤维性狭窄。炎性狭窄可以通过积极的内科药物及营养治疗控制炎症、减轻局部组织水肿、诱导疾病缓解而得以缓解。纤维性狭窄是由于长期慢性炎症积累,消化道管壁纤维组织过度增生、沉积及挛缩造成,往往需要内镜或外科手术治疗。本质上,两种类型的狭窄是同一疾病不同阶段、不同程度的表现,往往同时存在。有学者[11-13]认为,患病病程、疾病严重程度、病变累及回肠、存在肛周疾病、CD的诊断年龄<40岁和诊断时即需要使用皮质类固醇激素治疗等与消化道狭窄的发生显著相关。同时,也有学者认为,合并瘘管对于消化道狭窄的发生具有较高的阳性预测价值(86.2%)[14-15]。
CD患者可在消化道的任何部位发生狭窄,常见部位是回肠、盲肠、十二指肠、直肠肛管处[16]。本研究中,CD、UC患者狭窄好发于末端回肠及回盲部、左半结肠处,与既往研究类似。过去认为UC是一种非纤维狭窄性疾病,而近年来的研究发现:在UC患者的结肠切除标本中,可100%发现不同程度的黏膜下纤维化[17],UC患者结肠纤维性狭窄的发生率为2%~11.2%[18-19]。本研究中,UC患者消化道狭窄发生率为6.67%。
在治疗发生消化道狭窄的IBD患者中,我中心强调依托多学科团队协作(multiple disciplinary team,MDT)制定“个体化”诊疗方案,突出营养治疗的重要作用。营养治疗不仅可以提供足够的营养、能量支持,还可减轻胃肠道的功能负担、调节肠道微生态、减少食物中外源性抗原的刺激,控制疾病活动、改善临床症状,进而可以延缓狭窄及纤维化的进展,尤其是以轻中度不全性肠梗阻为主要症状的初发患者,实验室及影像学检查明确提示狭窄肠段存在明显炎症反应患者。英国胃肠病学会认为成人IBD患者全肠内营养(exclusive enteral nutrition,EEN)治疗优于皮质类固醇、免疫抑制剂或手术[20],而在日本,EEN则作为成人IBD患者首选的一线治疗[21]。本研究中,33.90%的IBD患者予以药物及营养治疗后消化道狭窄症状得以缓解。同时,我们还发现,病程0~10年的IBD患者消化道狭窄的发生率显著高于病程>10年患者,考虑到我中心非多数IBD患者的首诊医院,接诊时大多经过非系统地诊治,由此可见我中心“个体化”药物及营养治疗可以延缓甚至减少消化道狭窄的发生,但由于本研究随访时间较短,需要进一步的随访研究。肠内营养(enteral nutrition,EN)剂型的选择应根据患者实际的疾病状态、营养状况及经济条件等多种因素综合考虑,努力提高患者依从性,使其尽可能地采取EEN治疗。肠道功能较为完整患者,予以整蛋白型肠内营养剂;肠道较短、功能受损、处于疾病活动期、药物治疗效果较差等患者,予以短肽型或氨基酸型肠内营养剂;处于急性活动期伴有或不伴有肠梗阻、中毒性巨结肠、活动性消化道瘘管等,合并严重营养不良、贫血或重要脏器功能不全,以及需要行外科手术治疗等情况时,予以全肠外营养(total parenteral nutrition,TPN),病情有所缓解之后,尽快过渡到EEN治疗。一项来自英国的研究显示,外科治疗术后尽早联合EN营养支持治疗,可减少炎症并诱导缓解,并可通过局部免疫刺激作用促进病变黏膜愈合[22]。
消化道狭窄通常与生活质量急剧下降密切相关,往往需要外科手术治疗。外科手术术式主要分为切除术和狭窄成形术。约80%的CD患者在确诊后10年内进行第1次外科手术[8,23-24],高达65%的患者将在10年内进行第2次切除[23]。本研究中,CD患者的外科手术率与上述报道大体相当,而CD患者的再次手术率仅为11.54%,显著低于上述报道,这或许可以表明“个体化”的药物及营养治疗方案可有效降低外科手术率。由于疾病自身生物学行为特征,CD的手术率为72.22%,显著高于UC的14.29%和IBDU的48.00%。外科手术治疗带来治疗收益的同时,其术后并发症值得重视,文献报道IBD患者结肠切除术后并发症相关的再手术率为54%[25]。而恰当的手术时机,合理的术前准备、手术术式和术后支持治疗,可有效降低术后并发症发生率,近年来有文献报道手术并发症的发生率降为10%以下[26]。我中心发挥MDT优势,根据患者消化道狭窄的部位、狭窄数量,有无腹腔感染、脓肿,与周围肠道、脏器有无粘连,营养状态,其他脏器功能,内科合并用药情况以及患者治疗意愿等因素确定合适的手术时机和合理的术式。术后予以TPN支持治疗,尽快过渡到EEN治疗,并及早使用药物治疗控制炎症和预防复发,总体术后并发症发生率为17.91%。
随着内镜技术的不断发展,内镜治疗以其治疗效果明确、并发症较少的优势,已经成为治疗IBD患者消化道狭窄及吻合口狭窄的重要方式。内镜治疗主要包括:内镜下球囊扩张术(endoscopic balloon dilation,EBD)、内镜下狭窄切开术(endoscopic stricterotomy,EST)和内镜下支架置入术。EBD主要应用于炎性狭窄、纤维性狭窄、混合性狭窄、短狭窄及吻合口狭窄患者,即时成功率高,为70%~89.6%[27-28],而并发症发生率较低,为2.7%[29],可有效降低外科手术率并延长再次手术时间间隔。文献报道,34%的CD患者EBD术后在中位随访4.8年内发生外科手术事件[28]。EBD治疗吻合口狭窄要优于外科手术[29-30],但存在需多次住院、扩张治疗、适应证严格(<4 cm的短段单发狭窄,处于缓解期,狭窄段消化道走行直、无成角,狭窄管腔对称等)、远期疗效较差、部分患者仍难以避免外科手术等不足。文献报道,狭窄段长度每增加1 cm,EBD术后再手术风险将增加8%[31]。经EBD治疗后,有32.8%~75%的患者最终仍需要行外科手术治疗[27,32-33]。EST相较于EBD具有扩张效果好、穿孔风险低的优势,但也存在更高的出血风险[16],并且要求内镜医师需具备更高的内镜技术。治疗中局部注射、喷洒糖皮质激素或生物制剂,可提高扩张效果,延长再次扩张或手术的时间间隔[34-35]。内镜下支架置入术可用于长段纤维性狭窄,但由于支架易移位、脱落,一般作为临时治疗方式。一项来自英国的研究[36]认为,内镜治疗术后常规继续使用生物制剂或免疫抑制剂治疗,降低再扩张或手术率。本研究中,内镜治疗总体有效率达81.25%,随访期内仅有18.75%的患者最终需要外科手术,术后并发症仅为3.13%,显著低于行外科手术治疗患者,这些均与我中心在内镜治疗术后继续予以有效内科及营养治疗相关,但仍需要继续的随访研究。
综上,发生消化道狭窄IBD患者的治疗,采取“个体化”的药物及营养治疗方案,相当一部分患者的狭窄症状能得以缓解,从而避免外科手术治疗。内镜治疗具有成功率高、并发症发生率低的优势,但其存在适应证较为严格,对实施者的内镜技巧、患者的依从性要求较高的局限。

