血清IL-6与TNF-α在克罗恩病疾病评估中的应用
陈 丹, 陈 洋, 李 骥, 谭 蓓, 张鑫垚, 张 丽, 钱家鸣
中国医学科学院 北京协和医学院 北京协和医院 1.消化内科; 2.检验科,北京 100730
克罗恩病(Crohn’s disease,CD)是一种可累及全消化道的炎症性肠病,其发病率在我国呈上升趋势,临床上评估其疾病的活动度和预后至关重要。目前用于评估的指标有炎症指标、克罗恩病疾病活动指数(Crohn’s disease activity index,CDAI)、内镜直视肠黏膜病变、黏膜组织病理等方法。但内镜及黏膜组织病理评估有创,患者接受度低;炎症指标、CDAI更易获得。C反应蛋白(C-reactive protein,CRP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)是评估CD活动程度和疗效的经典炎症指标。但有时与CDAI、内镜或病理评估不一致。白介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)在CD患者病变黏膜中明显升高,作为促炎因子参与CD黏膜损伤的发生[1]。近年来,血清IL-6、TNF-α的检测逐渐应用于临床,也有应用超敏C反应蛋白/白蛋白(high-sensitivity C-reactive protein/albumin,hsCRP/Alb),它们是否能替代经典炎症指标,或作为CD生化评估的补充指标是临床医师关注的问题。本文旨在探究血清IL-6、TNF-α与经典炎症指标的相关性,及其在CD评估中的应用价值。
1 资料与方法
1.1 一般资料收集2017年4月至2018年3月在北京协和医院住院并确诊为CD的患者。CD的诊断标准参照我国《炎症性肠病诊断与治疗的共识意见(2018年,北京)》[2]。且住院期间同一天内完成血清IL-6、TNF-α、hsCRP和ESR检查。排除标准:不能确诊CD者;此次住院期间未完成血清IL-6、TNF-α、hsCRP或ESR中任何一项检查或以上检查未在同一天内完成者。经病案科住院资料数据库检索,该时间段内我院共计121例住院CD患者,其中70例因未查IL-6或TNF-α予以排除,最终纳入51例CD患者。本研究经北京协和医院伦理委员会批准(S-K726)。
1.2 研究方法
1.2.1 回顾性总结患者基本情况:包括性别、年龄、蒙特利尔分型、CDAI、8周内英夫利西暴露比例、消化道内镜完成情况。蒙特利尔分型[3]根据诊断年龄分为A1(≤16岁)、A2(17~40岁)、A3(≥40岁);根据病变累及部位分为L1(仅累及回肠)、L2(仅累及结直肠)、L3(累及回肠和结直肠)、L4(累及空肠及其以上部位消化道),其中L4可以与L1~L3同时存在或单独存在;根据疾病行为分为B1(非狭窄非穿通型)、B2(狭窄型)、B3(穿通型)、p(肛周病变),其中p可以和B1~B3同时存在。疾病活动度通过CDAI评估,CADI总分≤149分定义为缓解期,总分≥150分定义为活动期,其中150~220分为轻度活动期,221~450分为中度活动期,451~1 100分为重度活动期。对于完善消化道内镜评估的患者,黏膜愈合定义为消化道内镜下未见黏膜溃疡、糜烂或充血等表现;对于未完善消化道内镜评估的患者,根据手术病理、小肠CT成像等影像学检查辅助评估是否达黏膜愈合。
1.2.2 分组:将CD患者分为疾病活动期组和缓解期组,或黏膜愈合组和黏膜未愈合组进行分析。
1.2.3 血清IL-6和TNF-α水平检测:应用西门子全自动化学发光免疫分析仪(IMMULITE 1000)行化学发光法测定,IL-6测定试剂盒(编号LK6P1)和TNF-α测定试剂盒(LKNF1)均购自英国西门子医学诊断产品有限公司。采用常规方法测定ESR和hsCRP,均由我院检验科完成。

2 结果
2.1 患者基本情况51例CD患者中,男36例,女15例;年龄(32.0±13.2)岁(14~66岁);缓解期患者21例(41.2%),活动期患者30例(58.8%)。39例患者完成病变部位消化道内镜评估,根据内镜结果判断为黏膜愈合8例,未达黏膜愈合31例;12例未行消化道内镜评估的患者,经手术大体病理、影像学是否存在肠瘘等指标辅助判断均未达黏膜愈合。综上,黏膜愈合的患者8例,未达黏膜愈合的患者43例;5例(9.8%)患者在距离检测血清TNF-α 8周内有英夫利西暴露(见表1)。

表1 51例CD患者临床特征[n(%)]Tab 1 Clinical characteristics of 51 patients with CD [n(%)]
2.2 血清IL-6、TNF-α、hsCRP、ESR、hsCRP/Alb及CDAI相关性分析51例CD患者行Pearson相关性分析显示,IL-6与hsCRP、ESR、hsCRP/Alb、CDAI呈正相关(P<0.05)。hsCRP(r=0.593,P=0.000)、ESR(r=0.559,P=0.000)、hsCRP/Alb(r=0.626,P=0.000)均与CDAI呈较强正相关。46例未暴露于英夫利西的CD患者行Pearson相关性分析显示,TNF-α与CDAI呈弱负相关(r=-0.352,P=0.016)(见表2)。
2.3 血清IL-6、hsCRP、ESR、hsCRP/Alb判断CD患者疾病活动期或黏膜未愈合的价值根据CDAI,将51例CD患者分为疾病活动期组和缓解期组,血清IL-6、hsCRP、ESR、hsCRP/Alb在疾病活动期患者中水平显著高于疾病缓解期(见表3)。当设定血清IL-6临界值为7.50 pg/ml(≥7.50 pg/ml),hsCRP临界值为6.71 mg/L(≥6.71 mg/L),ESR临界值为10.50 mm/h(≥10.5 mm/h),hsCRP/Alb临界值为0.175(≥0.175)时,判断疾病活动期的ROC曲线下面积(areas under theROCcurve,AUC)(95%CI)分别为0.851(0.744~0.985)、0.825(0.706~0.945)、0.810(0.692~0.928)、0.834(0.720~0.948)(P均<0.01)。且在hsCRP<6.71 mg/L的24例CD患者中,7例根据CDAI判断处于疾病活动期,其中4例(57.14%)患者IL-6 ≥7.50 pg/ml(见表4、图1)。
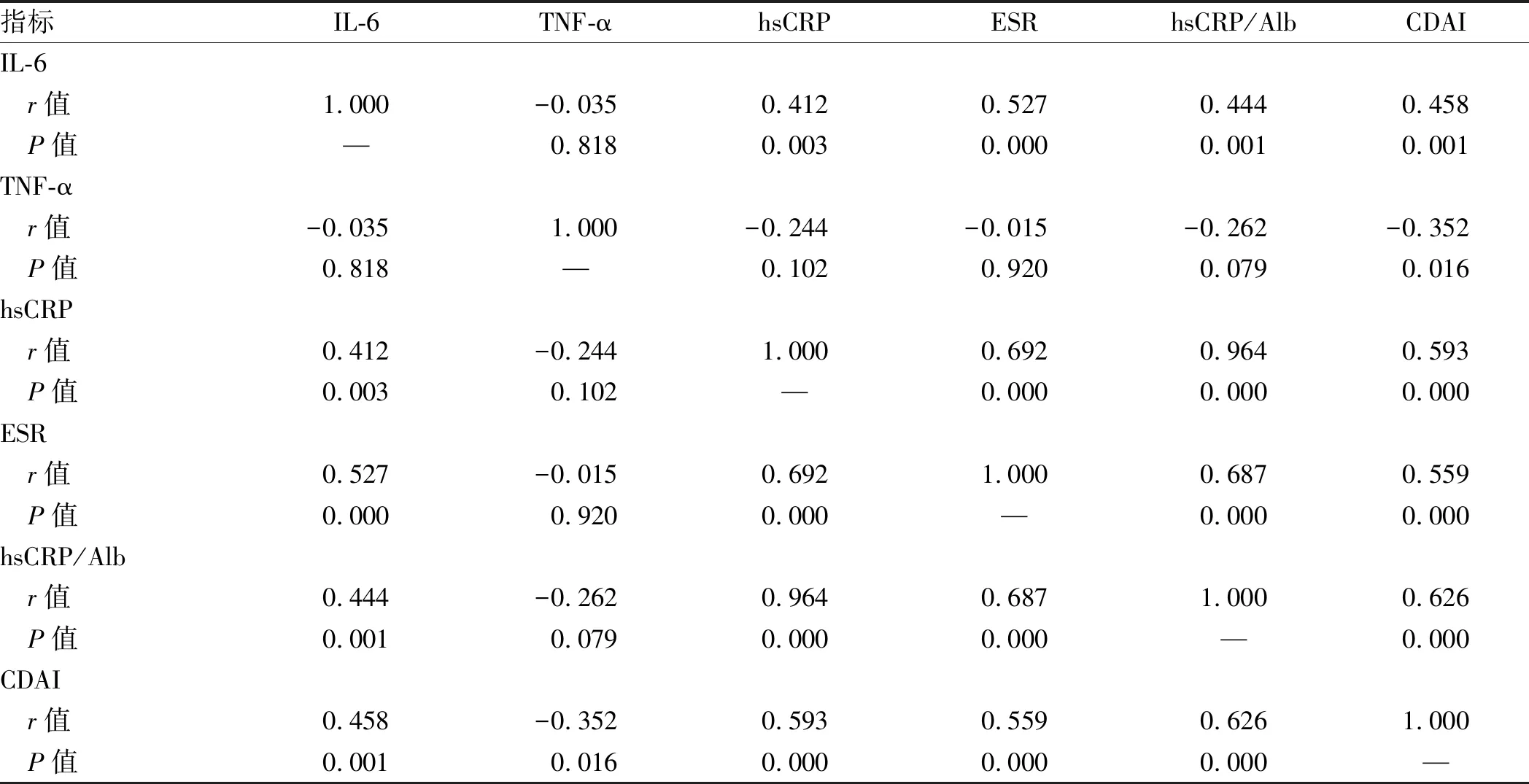
表2 IL-6、TNF-α、hsCRP、ESR、hsCRP/Alb及CDAI相关性分析Tab 2 Correlation analysis of IL-6, TNF-α, hsCRP, ESR, hsCRP/Alb and CDAI
注:IL-6、hsCRP、ESR、hsCRP/Alb及CDAI之间相关性分析纳入51例CD患者;TNF-α与IL-6、hsCRP、ESR、hsCRP/Alb、CDAI之间相关性分析纳入46例未暴露于英夫利西的CD患者。
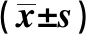
表3 比较CD缓解期和活动期患者血清IL-6、hsCRP、ESR和hsCRP/Alb水平Tab 3 Comparison of levels of serum IL-6, hsCRP, ESR and hsCRP/Alb between CD patients in remission stage and active stage
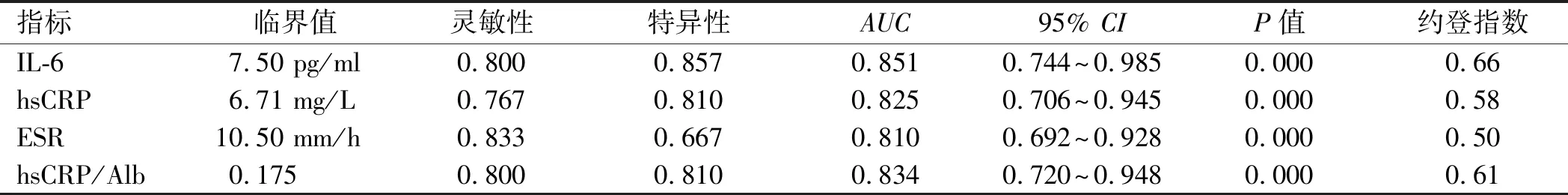
表4 IL-6、hsCRP、ESR、hsCRP/Alb判断疾病活动期价值Tab 4 The values of IL-6, hsCRP, ESR and hsCRP/Alb in assessing the disease activity
hsCRP、hsCRP/Alb在黏膜愈合组患者中显著低于黏膜未愈合组(P<0.05)。而IL-6与ESR在以上两组患者中差异无统计学意义(见表5)。当设定血清IL-6临界值为3.70 pg/ml (≥3.70 pg/ml),hsCRP临界值为1.43 mg/L(≥1.43 mg/L), hsCRP/Alb为0.035(≥0.035),CADI临界值为151分(≥151分)时,判断黏膜未愈合的AUC(95%CI)分别为0.727(0.523~0.931)、0.833(0.668~0.998)、0.839(0.680~0.998)和0.884(0.785~0.983)(P均<0.05)。而ESR判断黏膜未愈合差异无统计学意义(P>0.05)(见表6、图2)。
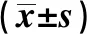
表5 比较CD黏膜愈合组和黏膜未愈合组患者血清IL-6、hsCRP、ESR和hsCRP/Alb水平Tab 5 Comparison of serum levels of IL-6, hsCRP, ESR and hsCRP/Alb between CD patients with mucosal healing and without reaching mucosal healing
表6 IL-6、hsCRP、ESR、hsCRP/Alb、CDAI判断黏膜未愈合价值Tab 6 The values of IL-6, hsCRP, ESR, hsCRP/Alb and CDAI in assessing the mucosal healing
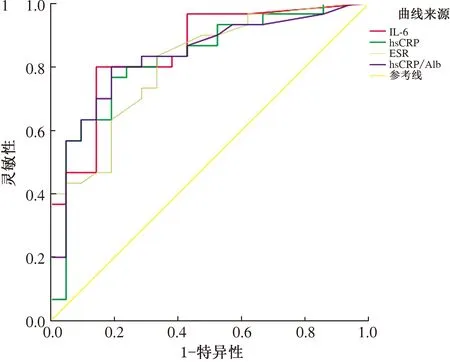
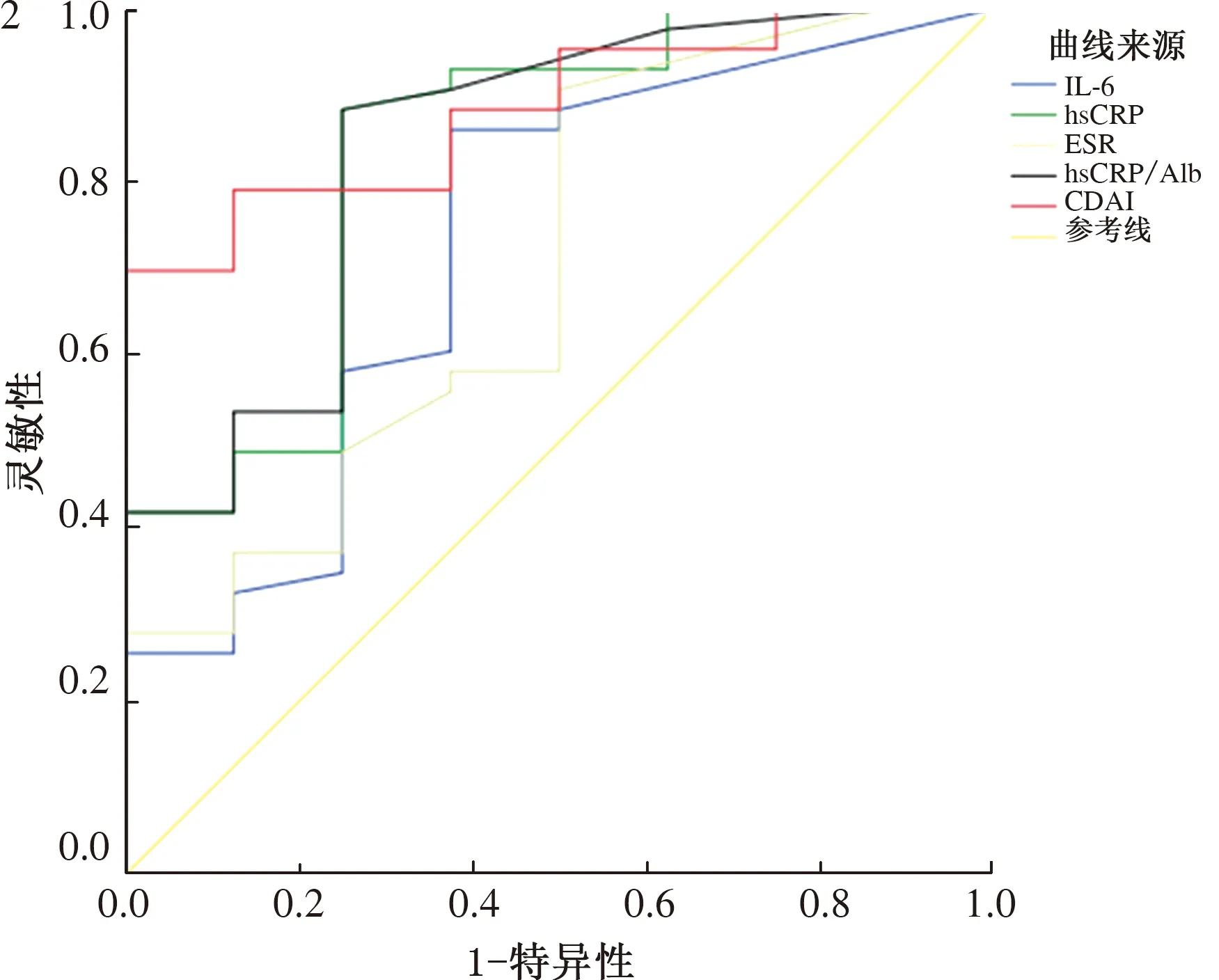
图1 IL-6、hsCRP、ESR、hsCRP/Alb判断疾病活动期ROC曲线分析;图2 IL-6、hsCRP、ESR、hsCRP/Alb、CDAI
判断黏膜未愈合ROC曲线分析
Fig 1ROCanalysis values of IL-6, hsCRP, ESR and hsCRP/Alb in assessing the disease activity; Fig 2ROCanalysis values of IL-6, hsCRP, ESR, hsCRP/Alb and CDAI in assessing the mucosal healing
2.4 血清TNF-α判断CD患者疾病缓解期及黏膜愈合的价值51例CD患者中,5例于8周内应用英夫利西且均处于缓解期,其中3例达黏膜愈合。血清TNF-α在英夫利西暴露组显著高于未暴露组[(242.00±136.05)pg/mlvs(38.37±35.18)pg/ml,P=0.028]。
在未暴露英夫利西的46例CD患者中,血清TNF-α在CD患者疾病活动期水平(30.82±24.75)pg/ml与缓解期(52.53±46.92)pg/ml比较,差异无统计学意义(P=0.100)。当设定血清TNF-α临界值为36.80 pg/ml(≥36.80 pg/ml)时,其判断未暴露于英夫利西的CD患者疾病缓解期的灵敏性为0.625,特异性为0.767,AUC(95%CI)为0.625(0.474~0.824),P=0.099,约登指数为0.39。
在未暴露英夫利西的46例CD患者中,血清TNF-α在黏膜愈合组显著高于黏膜未愈合组[(68.78±60.10)pg/mlvs(34.66±30.03)pg/ml,P=0.039]。当设定血清TNF-α临界值为37.35 pg/ml(≥37.35 pg/ml)时,其判断未暴露于英夫利西的CD患者黏膜愈合的灵敏性为0.800,特异性为0.732,AUC(95%CI)为0.732(0.481~0.982),P=0.094,约登指数为0.53。
3 讨论
CD是Th1细胞为主介导的免疫性肠病,细胞因子通过不同的机制参与其炎症的产生及持续,导致肠组织慢性损伤。本研究证实了血清IL-6与经典炎症指标、疾病活动度呈正相关,是判断疾病活动的良好指标,且其对判断黏膜是否愈合也有一定价值;还发现在未暴露于英夫利西的CD患者中,血清TNF-α与疾病活动度呈弱负相关,但应用血清TNF-α水平判断CD患者处于疾病活动期或缓解期、是否达到黏膜愈合的价值有限。
目前评估CD疾病活动度最常用的生化指标是CRP,它是在炎症状态下,肝细胞经IL-6、TNF-α或IL-1β刺激后产生的急性反应蛋白,其中以IL-6刺激生成为主[4]。已有较多研究表明,血清hsCRP与CD患者疾病活动度呈较强的正相关性[4-6]。本研究也证实hsCRP、hsCRP/Alb与疾病活动度呈正相关,在判断疾病活动度或黏膜是否愈合方面有一定的价值。但约1/3的活动期CD患者CRP正常,1/3的缓解期CD患者CRP升高[6]。故仍必须寻找其他生化指标辅助评估CD患者疾病状态。
IL-6主要为急性炎症部位的单核巨噬细胞或慢性炎症部位的T细胞分泌产生,被认为是炎症持续的标志[6]。CD的发病中,IL-6可激活NF-κB通路、增强上皮细胞通透性、导致肠黏膜微循环障碍等。已有研究[6-7]表明,活动期CD患者中血清IL-6显著升高,但其与疾病活动度的相关性结论尚不一致。本研究显示,CD患者血清IL-6水平与hsCRP、ESR、hsCRP/Alb呈正相关,当IL-6≥7.50 pg/ml时,判断疾病处于活动期的AUC(95%CI)可达0.851(0.744~0.985),灵敏性及特异性均较高,为理想的判断疾病活动状态指标,不劣于hsCRP或hsCRP/Alb,而且在疾病处于活动期但hsCRP升高不明显的CD患者中,约1/2患者仍存在IL-6升高。目前有文献报道血清IL-6水平与CD内镜下严重指数(Crohn’s disease endoscopic index of severity, CDEIS)无相关性[6],其判断黏膜是否愈合的价值尚不明确,本研究显示,当IL-6≥3.70 pg/ml,判断黏膜未愈合的AUC(95%CI)为0.727(0.523~0.931),灵敏性及特异性分别为0.860、0.625,其升高对判断未达黏膜愈合具有一定价值,其AUC较hsCRP、hsCRP/Alb或CDAI判断黏膜未愈合AUC小,但差异无统计学意义,以上结论有待更多大样本研究的证实。
TNF-α主要由活化的单核细胞和巨噬细胞产生。在CD的发病过程中,TNF-α能趋化并活化中性粒细胞和单核细胞;促进微血栓形成,导致黏膜微循环障碍;破坏肠道黏膜屏障功能。TNF-α分子在体内以跨膜形式(transmembrane TNF-α,tmTNF-α)或游离形式(soluble TNF-α,sTNF-α)存在。
与Eder等[8]研究一致,本研究发现,英夫利西暴露组CD患者血清TNF-α水平显著高于未暴露组。抗TNF-α单抗治疗后,血清sTNF-α显著升高的患者较sTNF-α降低的患者更可能对抗TNF-α单抗长期有效[8]。英夫利西对tmTNF-α或sTNF-α均有很高的亲和力,但其发挥抗炎作用的关键是拮抗tmTNF-α,而不是中和循环血中的sTNF-α[9]。提示血清sTNF-α水平升高与病情缓解并不矛盾。文献报道的CD患者血清TNF-α水平与疾病活动度之间的相关性不一致,有研究[10]表明,CD患者血清TNF-α与CDAI有较弱的正相关性。也有研究[11]表明,少年CD患者血清TNF-α水平较正常人高,而成人CD患者血清TNF-α与正常人无差异;血清TNF-α水平与CDAI无相关性[6]。而本研究发现,在未暴露于英夫利西的CD患者中,血清TNF-α水平与CDAI呈较弱的负相关;在黏膜愈合组中显著高于黏膜未愈合组。虽然TNF-α被认为是炎症因子网络中的启动因子,但不同于tmTNF-α,目前逐渐增多的证据表明,血清sTNF-α具有免疫调节和抗炎作用[12],也许可解释本研究发现的血清TNF-α水平与CDAI呈负相关,在黏膜愈合组显著升高的现象。由于血清TNF-α水平在不同发病年龄[11]、不同疾病累及部位[8]的患者中不同,且受是否暴露于抗TNF-α单抗的影响,可能造成不同研究的结果不同。
本研究仍存在一定局限性。首先,本研究为回顾性研究,部分资料不完备;其次,本研究为横断面研究,未纳入随访资料,上述生物标志物预测疾病复发的价值无法评价。
综上,CD患者血清IL-6水平与经典炎症指标及疾病活动度之间均具有良好的相关性,可作为经典炎症指标的补充指标用于协助判断CD疾病活动度。IL-6≥7.50 pg/ml对判断疾病处于活动期有较高的价值,IL-6≥3.70 pg/ml对判断未达黏膜愈合有一定价值。未暴露于英夫利西的CD患者中,血清TNF-α水平与疾病活动度呈较弱的负相关,但其用于判断疾病活动程度、黏膜是否愈合的价值非常有限,有待扩大样本量,根据年龄、疾病部位、药物暴露等因素分组分析以获得更准确的结论。

