生菜污染隐孢子虫卵囊洗脱与巢式PCR检测方法的研究
李俊强,张凯慧,崔朝辉,王荣军,菅复春,张素梅,宁长申,张龙现
隐孢子虫(Cryptosporidium)是一种重要的人兽共患肠道原虫,已经在世界范围内导致多起食源性和水源性隐孢子虫病暴发[1-2],主要引起腹泻、腹痛、恶心、呕吐等胃肠道症状,特别是儿童或免疫缺陷病人对其更为敏感[1,3]。新鲜蔬菜是每日健康饮食中一个重要的组成部分,也是一些病原重要的传播媒介[4-5]。近年来与新鲜蔬菜有关的食源性疾病相关报道数量急剧增加,大量研究表明许多肠道寄生虫的感染与食入生的或未经煮熟的蔬菜具有显著的相关性[6-9]。自上世纪90年代以来,在世界范围内时有隐孢子虫暴发感染的报道,溯源研究表明生食蔬菜存在隐孢子虫感染风险[1,10]。然而要检测蔬菜表面携带的病原体,其洗脱和检测方法至关重要。本研究以生菜为研究对象,创建了一种巢式PCR检测生菜表面的微小隐孢子虫卵囊的检测方法,为蔬菜的食品安全提供新的技术方法。
1 材料与方法
1.1 试验材料
1.1.1生菜样品来源 新鲜生菜样品分批次购自郑州市区某大型生活类超市,使用前置于4 ℃冰箱,在购置24 h内使用完毕。
1.1.2隐孢子虫卵囊 隐孢子虫(Cryptosporidiumparvum)卵囊是由河南农业大学寄生虫学实验室保存并提供,通过收集隐孢子虫连续传代的犊牛粪便,经蔗糖及氯化铯(CsCl)密度梯度离心法纯化获得隐孢子虫卵囊[11]。
1.1.3洗涤溶液种类 参照相关文献[12-14],洗涤液种类有:去离子水;0.1 mol/L 甘氨酸;0.1 mol/L PBS;1% SDS(十二烷基硫酸钠);1% Tween-20;1% Alconox。
1.2卵囊计数及种植方法 使用血球计数板在显微镜(OLYMPUS CX21)下进行隐孢子虫卵囊计数。然后将隐孢子虫卵囊液分别制备为每份4.4×105个卵囊(体积为100 μL),用于生菜表面卵囊的人工“种植”。将新鲜生菜样品(每份25 g)分开置于实验台(避免样品交叉污染),使用微量移液器将含有4.4×105个隐孢子虫卵囊液(100 μL)多点(8~10个)“种植”于生菜表面。每组试验均设置1个空白对照组(“种植”同体积去离子水)与3个平行试验组。
1.3卵囊的洗脱方法优化 使用BagPage400无菌过滤袋(19 cm×30 cm, 400 mL, Interscience Lab. Inc., Boston, MA, US),洗脱方法在Shields等[13]研究基础上进行适当优化。
1.3.1洗脱次数的比较 制备4份生菜样本(编号1~4号),分别“种植”隐孢子虫卵囊(1号:去离子水100 μL;2~4号:卵囊液100 μL);室温(15~20 ℃)放置3 h,将生菜样品转移入BagPage无菌过滤袋中,再加入洗涤液(去离子水)100 mL,然后封口并标记。振荡方式设置为回旋振荡,振荡频率设置为200次/min,振荡总时间为1 h(期间每15 min翻转1次)。振荡完毕后,将第1次洗脱液转移到2个50 mL离心管中;再将100 mL洗涤液加入同一过滤袋充分混匀后,将其洗脱液再转移到另2个50 mL离心管中,依次进行,共进行6次洗脱。
1.3.2振荡方式的优化 制备8份生菜样本(编号5~12号),分为2组。分别“种植”隐孢子虫卵囊,室温放置3 h,将生菜样品转移入过滤袋中,再加入洗涤液(去离子水)100 mL。振荡频率为200次/min,振荡时间为1 h。振荡方式分别设置为往返振荡(5~8号)与回旋振荡(9~12号)。
1.3.3振荡频率的优化 制备16份生菜样本(编号13~28号),分为4组。振荡方式为往返振荡,振荡时间为1 h。振荡频率分别设置为0次/min(13~16号)、100次/min(17~20号)、200次/min(21~24号)和300次/min(25~28号)。
1.3.4振荡时间的优化 制备16份生菜样本(编号29~44号),分为4组。振荡方式为往返振荡,振荡频率为100次/min。振荡时间分别设置为0 h(29~32号)、0.5 h(33~36号)、1 h(37~40号)和3 h(41~44号)。
1.3.5洗涤液的优化 制备28份生菜样本(编号45~72号),分为7组。振荡方式为往返振荡,振荡频率为100次/min,振荡时间分别为1 h。洗涤液分别设置为去离子水(45~48号)、0.1 mol/L PBS(49~52号)、1% NaCl(53~56号)、1 mol/L甘氨酸(58~60号)、1% SDS(61~64号)、1% Alconox(65~68号)和1% Tween-20(69~72号)。
1.4洗脱液的回收与卵囊计数 振荡完毕之后,将无菌袋中的第1次洗脱液收集于两个50 mL的离心管中,然后再加入与之前该样品相同的洗涤液,并进行充分混匀收集第2次洗脱液。方法1.3.1共进行了6次洗脱液的收集,而方法1.3.2~1.3.5中分别进行2次洗脱液的收集。将收集洗脱液置于高速离心机中,3 500 r/min(2 150 g)离心10 min,弃上清,将得到的洗脱液转移到2 mL的离心管中。再将2 mL离心管在15 000 r/min(15 160 g)离心5 min,弃上清,最后浓缩为500 μL洗脱液。最后使用血球计数板计数,每个样本分别计数至少3次,求其平均数。根据洗脱液的体积计算其回收的隐孢子虫卵囊总数,并计算其总体回收率。
1.5 洗脱液中卵囊DNA提取的优化
1.5.1卵囊DNA的提取 制备36份相同数量的隐孢子虫卵囊液(每份4.4×105个卵囊),平均分3组。3种商业化DNA提取试剂盒分别为:土壤DNA提取试剂盒(FastDNA SPIN Kit for Soil,MP bio)、粪便DNA提取试剂盒(E.Z.N.A Stool DNA kit)和组织DNA提取试剂盒(CW0546,康为世纪),按照说明书分别进行病原体DNA的提取。
为比较不同试剂盒提取DNA的含量和纯度的稳定性,提取的DNA使用微量紫外分光光度计(Nanodrop,ND-1000)测量其浓度,以及OD260/OD280比值检测其纯度,每份样品测定3次,计算其平均数,以及DNA的提取率[15-16],用平均数表示。
为比较不同试剂盒提取DNA的敏感性,分别制备不同浓度的隐孢子虫卵囊液103个、102个、101个、100个(体积:200 μL,溶液:去离子水),分别使用土壤DNA提取试剂盒和粪便DNA提取试剂盒提取含有不同数量的隐孢子虫卵囊DNA。
1.5.2隐孢子虫特异性基因的扩增 提取的隐孢子虫卵囊DNA,使用巢式PCR扩增其gp60基因片段[17]。外引物:AL3531(5′-ATAGTCTCCGCTGTATTC-3′)/ AL3534(5′-CGAGGACGGTTCCAAAGG-3′),内引物:AL3532(5′-TCCGCTGTATTCTCAGCC-3′)/AL3533(5′-GAGATATA-TCTTGGTGCG-3′),预计扩增片段大小为531bp。引物由生工生物工程(上海)股份有限公司合成部合成。PCR扩增酶为KOD-Plus-Neo(KOD-401),模板量为1 μL,两次PCR的退火温度均设定为55 ℃。分别进行12份平行样本的巢式PCR扩增,第2次扩增产物在1%的琼脂糖凝胶中进行电泳,置于紫外成像仪下进行鉴定。
1.6统计学分析 所获得的隐孢子虫卵囊回收率和提取的DNA浓度分别进行χ2检验比较其差异。使用SPSS 22.0软件,检验水准α=0.05。
2 结 果
2.1不同洗脱次数的对比 所检测的4份生菜样本洗脱液中,种植了去离子水的1号样本使用显微镜未检测到隐孢子虫卵囊。种植了隐孢子虫卵囊的洗脱液中,第1次洗脱回收的隐孢子虫卵囊数量最多,随后依次减低;然而到第5次及第6次洗脱液,显微镜计数显示均为0(表1)。由此可见,第1次和第2次洗脱液可回收较高的隐孢子虫卵囊(χ2=81.21,P<0.01)。
表1 不同洗涤次数条件下隐孢子虫卵囊的回收情况
Tab.1 Recovery ofCryptosporidiumoocysts by different elution times
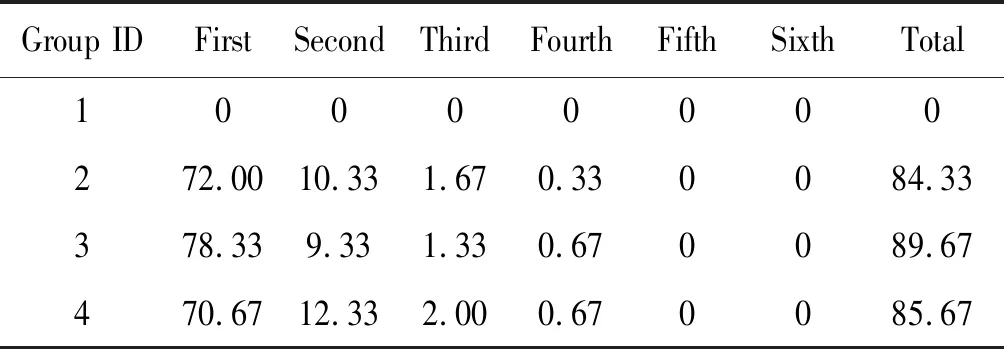
Group IDFirstSecondThirdFourthFifthSixthTotal10000000272.0010.331.670.330084.33378.339.331.330.670089.67470.6712.332.000.670085.67
2.2不同振荡方式的比较 所检测的8份生菜样本洗脱液中,种植了去离子水的5号和9号样本使用显微镜未检测到隐孢子虫卵囊。种植了隐孢子虫卵囊的洗脱液样本中,往返振荡和回旋振荡的回收卵囊的平均值分别为91.33与62.78;其总回收率分别为51.89%和35.67%(表2)。由此可见,采用往返振荡较回旋振荡的隐孢子虫卵囊回收率高(χ2=5.20,P<0.05)。
表2 不同振荡方式条件下隐孢子虫卵囊的回收情况
Tab.2 Recovery ofCryptosporidiumoocysts by different oscillation patterns

Group IDOscillation patternsFirstSecondTotalAverage5Roundtrip oscillations00006Roundtrip oscillations81.0012.3393.3391.337Roundtrip oscillations94.339.33103.678Roundtrip oscillations61.0016.0077.009Cyclotron oscillations000010Cyclotron oscillations70.005.3375.3362.7811Cyclotron oscillations53.335.0058.3312Cyclotron oscillations49.675.0054.67
2.3不同振荡频率的比较 所检测的16份生菜样本洗脱液中,种植了去离子水的13号、17号、21号、25号样本使用显微镜均未检测到隐孢子虫卵囊。种植了隐孢子虫卵囊的洗脱液样本中,振荡频率为0次/min、100次/min、200次/min、300次/min,其卵囊回收的平均值分别为64.11、87.78、57.44、54.22;总回收率分别为36.42%、49.89%、32.64%、30.81%(表3)。由此可见,采用振荡频率为100次/min时隐孢子虫卵囊回收率较高(χ2=9.43,P<0.05)。
表3 不同振荡频率条件下隐孢子虫卵囊的洗脱回收情况
Tab.3 Recovery ofCryptosporidiumoocysts by different oscillation frequency
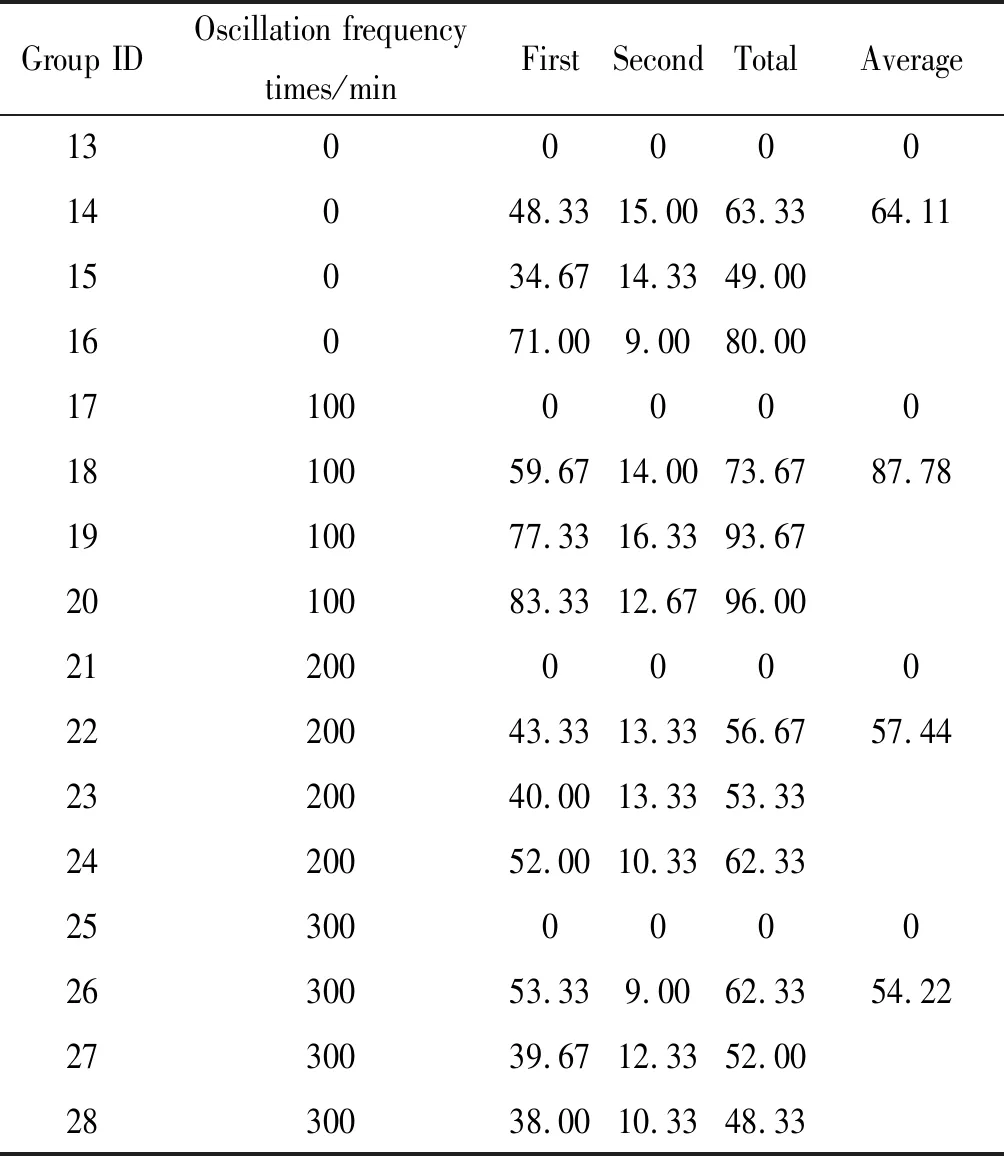
Group IDOscillation frequencytimes/minFirstSecondTotalAverage130000014048.3315.0063.3364.1115034.6714.3349.0016071.009.0080.001710000001810059.6714.0073.6787.781910077.3316.3393.672010083.3312.6796.002120000002220043.3313.3356.6757.442320040.0013.3353.332420052.0010.3362.332530000002630053.339.0062.3354.222730039.6712.3352.002830038.0010.3348.33
2.4不同振荡时间的比较 所检测的16份生菜样本洗脱液中,种植了去离子水的29号、33号、37号、41号样本使用显微镜均未检测隐孢子虫卵囊。种植了隐孢子虫卵囊的洗脱液样本中,震荡时间为0 h、0.5 h、1 h、3 h的卵囊回收平均值分别为57.78、81.44、95.00、45.67;其总回收率分别为32.84%、46.27%、53.98%、25.95%(表4)。由此可见,采用振荡时间为1 h时隐孢子虫卵囊回收率较高(χ2=19.91,P<0.01)。
2.5不同洗涤液的比较 所检测的28份生菜样本中,种植了去离子水的45号、49号、53号、57号、61号、65号和69号样本使用显微镜均未检测隐孢子虫卵囊。种植了隐孢子虫卵囊的洗脱液样本中,洗涤液为去离子水、0.1 mol/L PBS、1% NaCl、1 mol/L甘氨酸、1% SDS、1% Tween-20、1% Alconox的卵囊平均回收数分别为76.11、83.89、87.45、34.11、97.11、84.78、125.67;其总回收率分别为43.24%、47.66%、49.69%、19.38%、55.18%、48.17%、71.40%(表5)。由此可见,采用的洗涤液为1% Alconox时隐孢子虫卵囊回收率较高(χ2=58.02,P<0.01),而甘氨酸的回收率最低。
表4 不同振荡时间条件下隐孢子虫卵囊的洗脱回收情况
Tab.4 Recovery ofCryptosporidiumoocysts by different oscillation time
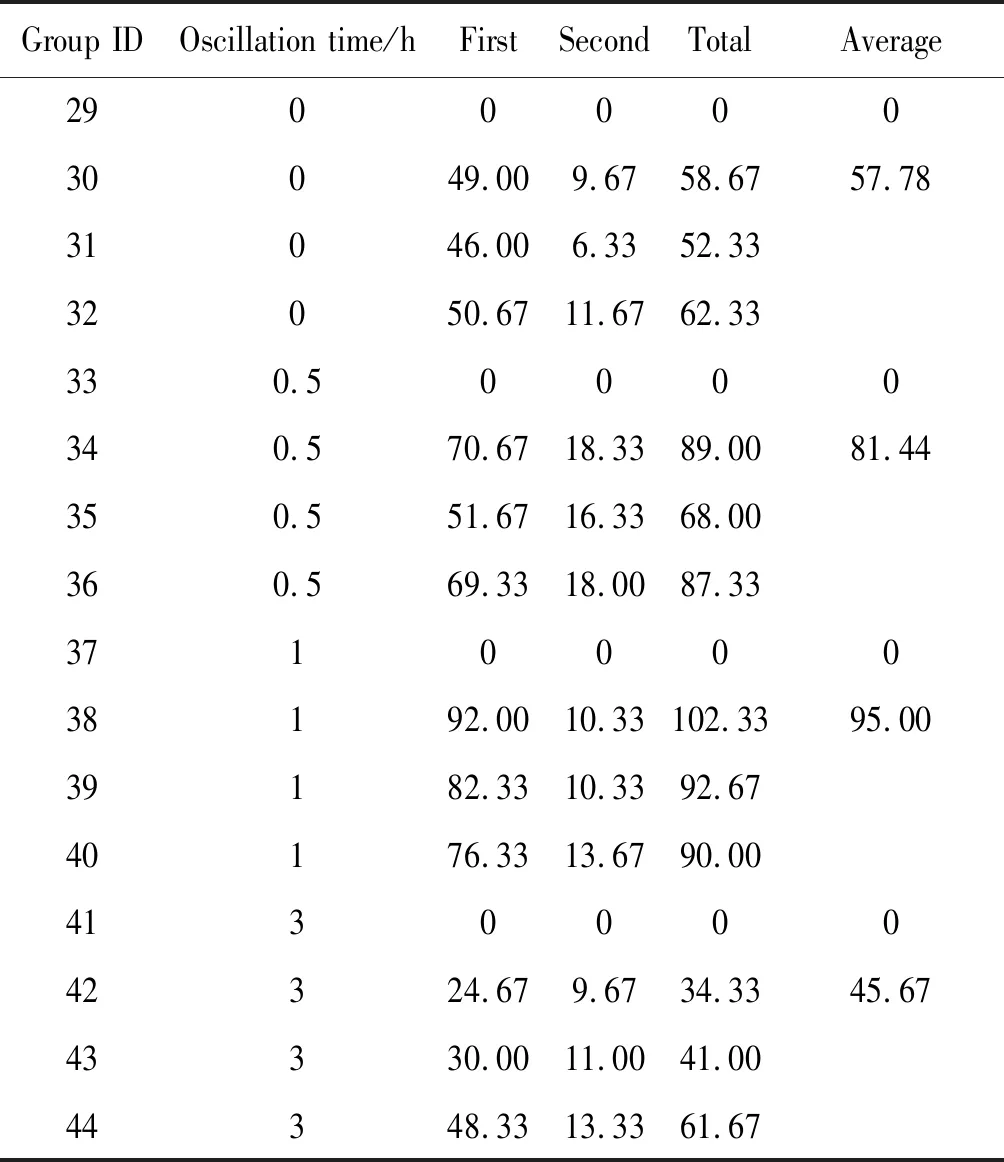
Group IDOscillation time/hFirstSecondTotalAverage290000030049.009.6758.6757.7831046.006.3352.3332050.6711.6762.33330.50000340.570.6718.3389.0081.44350.551.6716.3368.00360.569.3318.0087.33371000038192.0010.33102.3395.0039182.3310.3392.6740176.3313.6790.00413000042324.679.6734.3345.6743330.0011.0041.0044348.3313.3361.67
2.6生菜表面污染隐孢子虫卵囊总体回收率 采取往返振荡的振荡方式,振荡频率为100次/min,振荡时间为1 h(每15 min翻转1次),洗脱液采用1% Alconox溶液时,其隐孢子虫卵囊洗脱回收率达到最高。血球计数板显微镜计数分别采用第1次和第2次洗脱回收得到隐孢子虫卵囊个数之和计数,其卵囊总体平均回收个数为31.42×104,则其总体回收率最高达到71.40%(χ2=58.02,P<0.01)(表6)。
2.7 洗脱液中卵囊DNA提取方式的优化
2.7.1提取DNA的浓度、纯度和提取率比较 3种商业化试剂盒提取隐孢子虫卵囊DNA浓度方面,组织DNA试剂盒所提取的DNA平均浓度最高为(23.37±0.91) ng/μL;粪便DNA提取试剂盒提取的DNA浓度次之为(8.28±1.97) ng/μL;土壤DNA提取试剂盒提取的DNA浓度最低为(6.89±2.97) ng/μL。其次,3种试剂盒提取DNA纯度方面,组织DNA试剂盒所提取DNA的OD260/OD280平均值最低为1.09±0.70,显示其蛋白含量较高;粪便DNA提取试剂盒所提取DNA的OD260/OD280平均值适中为1.92±1.28,显示纯度适中;土壤DNA提取试剂盒所提取的DNA的OD260/OD280平均值最高为2.17±3.18,显示其RNA含量较高。再次,三种试剂盒获得DNA提取率方面,组织DNA提取试剂盒的DNA平均提取率最高,但其DNA的蛋白含量显著高;土壤DNA提取试剂盒次之,其提取的DNA中RNA的含量较高;而粪便DNA提取试剂盒提取的DNA提取率最低,但其纯度较高(表7)。
表5 不同洗涤液条件下隐孢子虫卵囊的洗脱回收情况
Tab.5 Recovery ofCryptosporidiumoocysts by different elution solutions
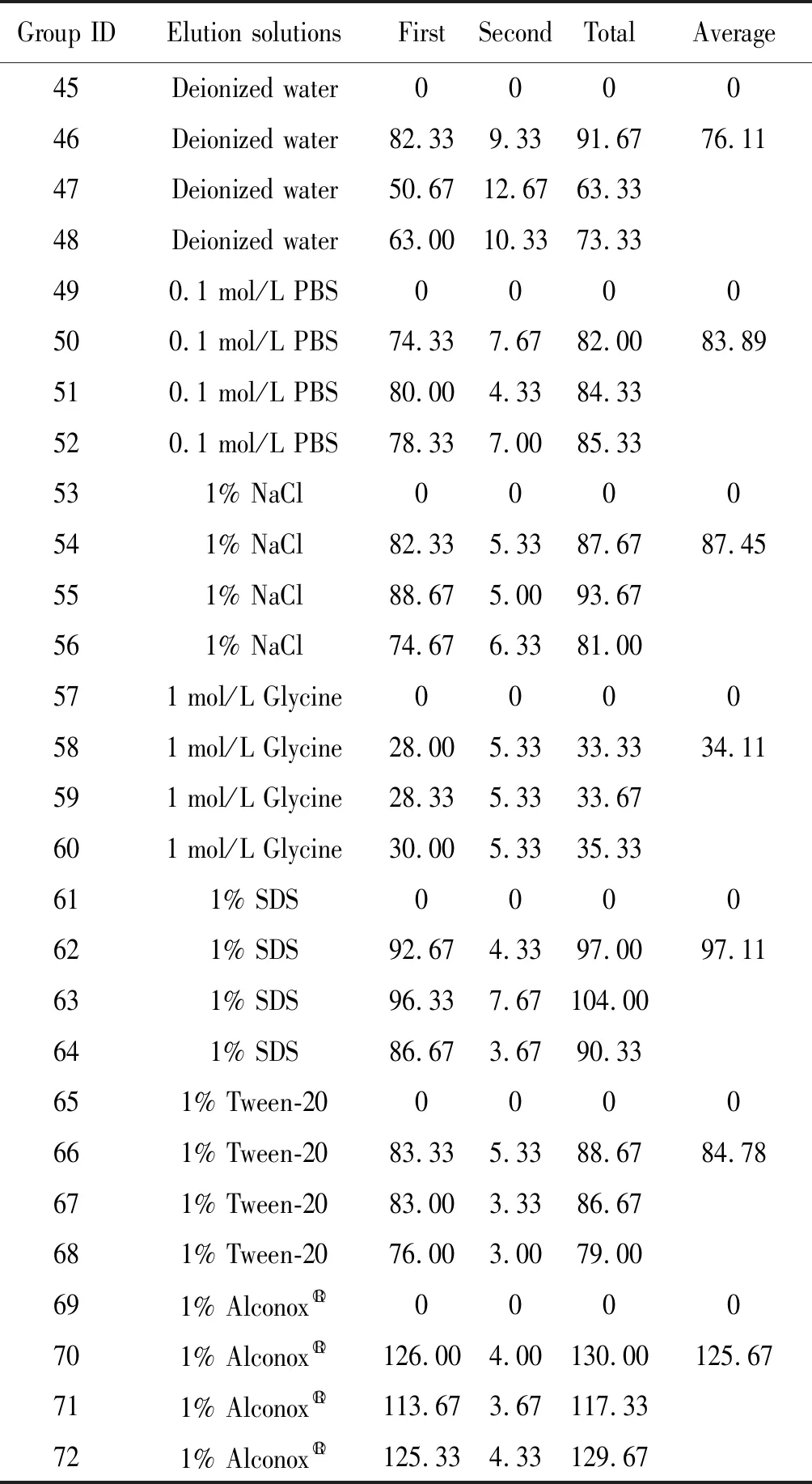
Group IDElution solutionsFirstSecondTotalAverage45Deionized water000046Deionized water82.339.3391.6776.1147Deionized water50.6712.6763.3348Deionized water63.0010.3373.33490.1 mol/L PBS0000500.1 mol/L PBS74.337.6782.0083.89510.1 mol/L PBS80.004.3384.33520.1 mol/L PBS78.337.0085.33531% NaCl0000541% NaCl82.335.3387.6787.45551% NaCl88.675.0093.67561% NaCl74.676.3381.00571 mol/L Glycine0000581 mol/L Glycine28.005.3333.3334.11591 mol/L Glycine28.335.3333.67601 mol/L Glycine30.005.3335.33611% SDS0000621% SDS92.674.3397.0097.11631% SDS96.337.67104.00641% SDS86.673.6790.33651% Tween-200000661% Tween-2083.335.3388.6784.78671% Tween-2083.003.3386.67681% Tween-2076.003.0079.00691% Alconox○R0000701% Alconox○R126.004.00130.00125.67711% Alconox○R113.673.67117.33721% Alconox○R125.334.33129.67
2.7.2提取DNA的稳定性 3种试剂盒提取隐孢子虫卵囊DNA浓度和纯度稳定性比较分析显示:DNA浓度方面,组织DNA提取试剂盒获得DNA浓度最高,粪便DNA提取试剂盒次之,土壤DNA提取试剂盒最低;其中,土壤DNA提取试剂盒提取DNA浓度的稳定性最高。DNA纯度方面,土壤DNA提取试剂盒最高,粪便DNA提取试剂盒次之,组织DNA提取试剂盒获得DNA纯度最低;其中,粪便DNA提取试剂盒提取DNA纯度稳定性最高。
2.7.3提取DNA的特异性 3种试剂盒提取的卵囊DNA为模板的巢式PCR扩增结果显示,土壤DNA提取试剂盒和粪便DNA提取试剂盒提取的DNA均全部成功扩增12份样品,而组织DNA提取试剂盒提取的DNA仅成功扩增4份。由此可见提取水溶液中隐孢子虫卵囊DNA时,粪便DNA提取试剂盒和土壤DNA提取试剂盒提取隐孢子虫卵囊DNA的特异性显著性高于组织DNA提取试剂盒(χ2=71.80,P<0.01)。
2.7.4提取DNA的敏感性 3种试剂盒提取的卵囊DNA样品敏感性检测,只进行了两种试剂盒(粪便DNA提取试剂盒和土壤DNA提取试剂盒)对于不同梯度的隐孢子虫卵囊DNA的巢式PCR扩增。结果显示这两种试剂盒提取的隐孢子虫卵囊DNA的巢式PCR扩增的敏感性均为10~100个卵囊之间。
表6 不同洗涤液条件下隐孢子虫卵囊的回收数量与回收率
Tab.6 Recovery and rate ofCryptosporidiumoocysts by different elution solutions

Elution solutionsRecovery number and recovery rate of the oocystsFirst recovery number(×104)First recovery rate(%)Second recovery number(×104)Second recovery rate(%)Total recovery number(×104)Total recovery rate(%)Deionized water16.3337.122.696.1219.0343.240.1 mol/L PBS19.3944.061.583.6020.9747.661% NaCl20.4746.531.393.1621.8649.691 mol/L Glycine7.1916.351.333.038.5319.381% SDS22.9752.211.312.9724.2855.181% Tween-2020.1945.890.9742.2121.2048.171% Alconox○R30.4269.131.002.2731.4271.40
表7 不同试剂盒提取DNA的浓度、纯度和提取率(n=12)
Tab.7 Concentration, purity and extraction rate of extracted DNA from different kits
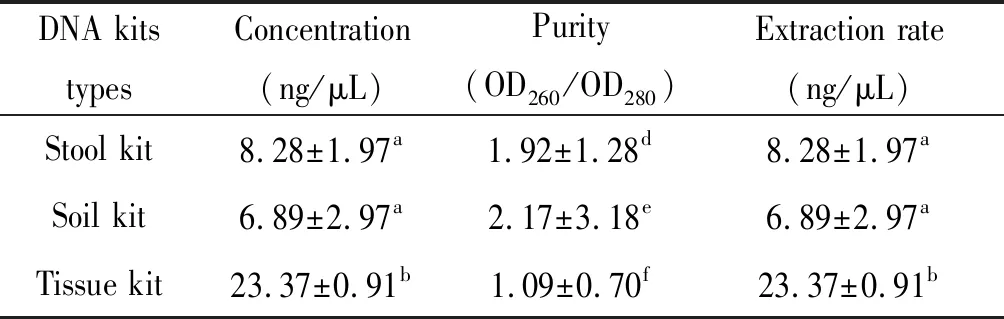
DNA kits typesConcentration(ng/μL)Purity(OD260/OD280)Extraction rate(ng/μL)Stool kit8.28±1.97a1.92±1.28d8.28±1.97aSoil kit6.89±2.97a2.17±3.18e6.89±2.97aTissue kit23.37±0.91b1.09±0.70f23.37±0.91b
注:结果以平均数±标准差表示,同一数据列中不同小写字母显示差异有统计学意义(P<0.05)。
3 讨 论
隐孢子虫在世界范围内导致多起食源性和水源性隐孢子虫病的暴发[1-2],并且隐孢子虫的感染与食入生的或未经煮熟的蔬菜有显著的相关性[6-9]。蔬菜表面携带微小隐孢子虫(C.parvum)卵囊的报道最早可以追溯到1997年[18],到目前仍然有蔬菜表面污染隐孢子虫卵囊的报道[19-24]。然而要检测蔬菜表面携带的病原体,首先要建立有效的洗脱和检测方法[25]。
本研究对蔬菜表面污染的隐孢子虫卵囊采取往返振荡方式,振荡频率为100次/min,振荡时间为1 h,洗脱液采用1% Alconox的方法进行洗脱,其总体回收率最高达到71.40%。基于流式细胞仪检测木莓表面携带的微小隐孢子虫卵囊的报道与本研究得到了相似的结果,洗脱液为去离子水时回收率为(43.2±4.5)%;洗脱液为1 mol/L甘氨酸时木莓表面卵囊回收率为(39.0±7.6)%;洗脱液为去离子水时菠菜表面卵囊回收率为(47.5±3.1)%;洗脱液为1 mol/L甘氨酸时菠菜表面卵囊回收率为(50.3±2.0)%;同样地,洗脱液为1% Alconox时卵囊回收率最高达到97.2%[13]。Alconox主要有两种成分:具有表面活性功能的十二烷基苯磺酸钠(C12H25C6H4SO3Na)和乳化分散性能的焦磷酸钠(Na4P2O7)[13]。本研究中,1% Alconox洗脱蔬菜表面的隐孢子虫回收率最高(71.40%),1% SDS洗脱液次之(55.18%),并且显著高于其它洗涤液的回收率。
水溶液中病原体DNA的提取方法有多种,传统的异丙醇沉淀提取DNA的方法简单、成本低、能提取到大量的DNA,但获得的DNA浓度低、且耗时长、纯度低、不利于快速的分子生物学研究,然而试剂盒提取DNA具有快速高效而且纯度高的优点。目前用于提取粪便、土壤、血液、组织中病原DNA的试剂盒较多[14-15]。本研究选择3种常见商业化DNA提取试剂盒对水溶液中隐孢子虫卵囊DNA进行提取,根据所提取DNA的浓度、纯度和提取率,以及扩增微小隐孢子虫gp60基因的特异性和敏感性进行比较,评价其提取水体中隐孢子虫卵囊DNA的效果。在3种商业化试剂盒中,虽然组织DNA提取试剂盒获得的DNA浓度最高,但其扩增隐孢子虫gp60基因的特异性显著低于土壤DNA试剂盒和粪便DNA试剂盒获得的DNA。推测可能是由于组织DNA提取试剂盒提取获得了溶液中其它生物体的基因组DNA,未能将隐孢子虫卵囊壁充分破裂,从而导致未获得有效隐孢子虫卵囊DNA。土壤DNA提取试剂盒与粪便DNA提取试剂盒提取的隐孢子虫卵囊DNA在质与量差异无统计学意义。如果考虑到时间成本,土壤DNA试剂盒耗时较短;如果考虑到经济成本,粪便DNA试剂盒提取的单份DNA成本较低。有学者通过PCR方法比较了3种试剂盒(FastDNA SPIN Kit for soil,UltraCleanTMSoil DNA Isolation Kit,QIAamp DNA Mini Stool Kit)及一种新建的DNA提取方法提取蔬菜表面洗脱的微小隐孢子虫卵囊DNA的质量,结果显示FastDNA试剂盒与土壤DNA试剂盒提取DNA的质与量差异也没有统计学意义[14]。
综上所述,本研究以生菜为研究对象,对其表面污染的隐孢子虫卵囊的洗脱方法进行了优化及水溶液中隐孢子虫卵囊DNA的提取进行了比较,建立了巢式PCR检测蔬菜表面污染隐孢子虫卵囊的方法,为蔬菜的食品安全提供新的技术方法。
利益冲突:无

