黄沙鳖致病性蜡样芽孢杆菌的分离鉴定及药敏试验
黎姗梅,吴柳青,许飘尹,盛雪晴,贺晓晨,肖双燕,邱梓晟,梁静真,韩书煜*,黄 钧*
(1.广西水生动物病害诊断实验室/广西大学动物科学技术学院,广西 南宁 530004;2. 广西水产技术推广总站,广西 南宁 530022;3.武宣县水产技术推广站,广西 武宣 545900)
【研究意义】中华鳖(Pelodiscussinensis)的地理种群黄沙鳖广泛分布于广西的左江、右江、郁江及西江流域[1],具有较强的繁殖力和抗病性,易于饲养,其体色鲜黄、裙边宽厚、肉嫩味美,是广西名特优水产养殖品种之一。近年来,随着黄沙鳖养殖规模的不断扩大,其各种病害频繁暴发[2-4],严重影响广西黄沙鳖养殖业的健康发展。2016年7月,广西武宣县某养殖场黄沙鳖出现表皮充血发炎、疥疮和腐皮等多种病症,并陆续发病死亡,疑似由蜡样芽孢杆菌(Bacilluscereus)引起,但目前有关黄沙鳖蜡样芽孢杆菌病的研究尚未见报道。因此,对黄沙鳖进行病原菌分离鉴定和药物敏感性试验,对防治黄沙鳖蜡样芽孢杆菌病具有重要意义。【前人研究进展】蜡样芽孢杆菌是一种需氧或兼性厌氧、具有芽孢的革兰氏阳性杆菌,广泛分布于自然界的空气、水体和土壤中[5-6],该菌抗逆性较强,能分泌抗菌素和超氧化物歧化酶等有益生物活性物质,作为微生态制剂和饲料添加剂在水产养殖领域已得到广泛应用[7-9]。蜡样芽孢杆菌属于条件性致病菌,能引起人类食物中毒、伤口感染,甚至引起肺炎、脑膜炎及败血病等严重疾病[10],也能引起牛乳房炎[11]和子宫内膜炎[12]、马表皮溃烂[13]、猪腹泻[14]等家畜疾病,还能引起半滑舌鳎(Cynoglossussemilaevis)[15]、罗非鱼(Oreochromis)[16]、棘胸蛙(Quasipaaspinosa)[17]和中华鳖[18]等水产养殖动物发病死亡。目前已知的鳖细菌性疾病有红底板病、红脖子病、白底板病、腐皮病、疖疮病、白点病和爱德华氏菌病等,病原菌有迟缓爱德华氏菌(Edwardsiellatarda)[19]、嗜水气单胞菌(Aeromonashydrophila[2,20]、温和气单胞菌(A.sobria)[21]和类志贺邻单胞菌(Plesimonasshigelloides)[4]等。【本研究切入点】目前,蜡样芽孢杆菌作为病原菌引起爬行类动物致病仅见谭爱萍等[17]对中华鳖的报道,而关于黄沙鳖感染该菌的研究尚无报道。【拟解决的关键问题】对广西武宣县某养殖场患病黄沙鳖进行病原菌分离鉴定及药敏试验,为确定引起黄沙鳖患病的病原及在生产中进行有效防治提供参考依据。
1 材料与方法
1.1 试验材料
病样为广西武宣县某养殖场患病黄沙鳖,平均体重1410.7 g/只,病症为表皮充血发炎、疥疮及腐皮等。用于人工感染试验的健康黄沙鳖购自广西武宣县另一个养殖场,平均体重约116.4 g/只,试验前在广西大学水产教学科研基地暂养30 d,期间黄沙鳖的摄食及活动正常,生长良好,无任何肉眼可见病症,人工感染前3 d随机抽样检测均未从心脏和肝脏中分离到细菌。
普通营养琼脂培养基、脑心浸液培养基和兔血琼脂培养基均购自北京陆桥技术有限责任公司;药敏纸片购自杭州天和微生物试剂有限公司;新霉素、多西环素和恩诺沙星原料药购自浙江国邦药业有限公司;API 20E和API 50CH生化鉴定试剂条及所需配套试剂均购自法国梅里埃公司;PCR扩增试剂盒购自宝日医生物技术(北京)有限公司。
1.2 细菌分离
先对患病黄沙鳖外观症状进行检查并记录,然后采用常规方法对病样进行解剖,肉眼观察并记录其肠道、胃、心脏、肝脏和咽喉等各内脏器官的病变情况。用75 %酒精棉球对肝脏、肾脏和脾脏等器官的取样部位进行擦拭,并取样划线接种于普通营养琼脂培养基上,37 ℃恒温培养18~24 h,挑取优势菌落进行纯化培养后置于4 ℃冰箱保存备用。
1.3 人工感染试验
1.3.1 无菌滤液人工感染试验 按韩书煜等[21]的方法,取患病黄沙鳖的心脏、肝脏、肾脏和脾脏等内脏组织匀浆,10 ℃下10 000 r/min离心30 min后取上清液,采用0.22 μm细菌滤器过滤得到无菌滤液,涂布于普通营养琼脂培养基上观察是否有菌落生长。取健康黄沙鳖分成对照组和试验组,每组20只。对照组和试验组分别腹腔注射灭菌PBS和无菌滤液,每只注射量均为0.5 mL,各组均设3个平行,然后进行15 d的饲养观察。若发生死亡现象即取刚死或濒死个体内脏组织再制成无菌滤液并进行人工感染试验。
1.3.2 分离菌株的人工感染试验 用灭菌PBS配制分离菌株的菌悬液,以细菌比浊仪将细菌浓度调为5.07×107CFU/mL。取健康黄沙鳖分成对照组和试验组,每组20只。试验组腹腔注射菌悬液0.5 mL/只,对照组注射等量的灭菌PBS,各组均设3个平行。注射后分别饲养于相同条件的不同水族箱中,连续观察15 d。按照1.2的方法对具有与自然患病症状相似的濒死个体进行生化分离。第2次人工感染试验步骤与第1次相同,所注射的菌悬液(4.95×107CFU/mL)为第1次人工感染试验分离纯化得到的细菌制备而成。
1.4 细菌鉴定
1.4.1 生化鉴定 将活化后的菌株分别划线接种于普通营养琼脂培养基和兔血琼脂培养基,培养24 h后观察菌落的颜色、形态和溶血性,经革兰氏染色后观察细菌的形态特征。根据染色结果和细菌形态选择API 50CH试剂条、API 50CHB培养基和API 20E试剂条(前12个项目)进行生化鉴定。利用APIWEB服务器(https://apiweb.biomerieux.com/login)的API 50CHB V4.0对鉴定结果进行判断。
1.4.2 分子生物学鉴定 对GXWXAA菌株的16S rRNA序列进行PCR扩增。按黄钧等[3]的方法提取细菌基因组DNA,-20 ℃保存备用。PCR扩增使用的上游引物为8F(5′-AGAGTTTGATCCTGGCTCAG-3′)、下游引物为1492R(5′-ACGGCTACCTTGTTACGACTT-3′)。 反应体系25.0 μl:TaqMix 12.5 μl,ddH2O 8.5 μl,10 μmol/L上下游引物各1.0 μl,DNA模板2.0 μl。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,58 ℃ 45 s,72 ℃ 2 min,进行30个循环;72 ℃延伸10 min。PCR扩增产物送至深圳华大基因科技有限公司测序。
1.5 药敏试验
参照黄艳华等[2]的方法进行K-B纸片扩散法操作,按生产厂家提供的标准进行判断;最小抑菌浓度(MIC)采用二倍稀释法进行测定。根据K-B纸片扩散法的试验结果选用恩诺沙星、新霉素和多西环素进行MIC测定;参照黄新财等[22]的方法,用灭菌PBS将药物配制成1000 μg/mL母液;在无菌条件下,向96孔微量板每孔分别加入120 μl脑心浸液培养基,向第1孔加入母液120 μl,用移液枪混匀后取120 μl移至第2孔中,混匀后再取120 μl移至第3孔中,依次类推,直至第14孔吸取120 μl混合液并弃去,最后向每孔中加入1.2×108CFU/mL菌悬液120 μl。至此,第1~14孔中抗生素终浓度分别为250.00、125.00、62.50、31.30、15.60、7.81、3.91、1.95、0.98、0.49、0.24、0.12、0.061和0.031 μg/mL。设一个不加菌液的药物为空白对照组和一个加菌液不加药液的阳性对照。30 ℃下培养48 h后,以用肉眼观察无细菌生长第1个孔的药物浓度为该药物对受试菌株的MIC。MIC按美国临床和实验室标准协会(CLSI)2017版微生物药物敏感性试验的执行标准判断。
2 结果与分析
2.1 患病黄沙鳖的临床症状
观察发现,病鳖行动缓慢、四肢无力;底板充血发炎,有疥疮和腐皮等症状,裙边溃烂发炎,颈部充血肿大。解剖可见腹部有大量淡红色腹水,肠道充血发炎,肝脏发黑变硬(图1)。
2.2 病原菌分离结果
从病鳖的肝脏中分离获得1株优势菌株,编号为GXWXAA。该菌株为革兰氏阳性杆菌,两端钝圆,平均约1.0 μm×4.0 μm,呈单个或链状排列;具有芽孢,芽孢呈卵圆形,位于菌体中央或近端,芽孢小于菌体横径,不突出于菌体外。在普通营养琼脂培养基30 ℃培养24 h后,菌落直径约1.64 mm,呈乳白色,表面不透明,粗糙似蜡状,边缘不平整;在兔血琼脂培养基上培养24 h后呈明显的β-溶血(图2)。
2.3 人工感染试验结果
2.3.1 无菌滤液的人工感染试验结果 涂布在普通营养琼脂培养基上的无菌滤液在37 ℃经24 h培养未观察到菌落生长。注射无菌滤液和灭菌PBS缓冲液的黄沙鳖经15 d连续观察,活动和摄食正常,均未出现病症或死亡。据此认为广西武宣县某养殖场黄沙鳖患病由病毒引起的可能性较小。
2.3.2 分离菌株人工感染试验结果 以菌株GXWXAA制备菌悬液进行第1次人工感染试验,分离纯化得到的菌株命名为GXWXAA1;以GXWXAA1制备菌悬液再进行第2次人工感染试验,分离纯化得到的菌株命名为GXWXAA2。从图3可看出,2次人工感染试验(GXWXAA和GXWXAA1的菌悬液浓度分别为5.07×107和4.95×107CFU/mL)的第2天(注射后第2天)黄沙鳖开始死亡,第2~3天为死亡高峰期,至第5~6天全部死亡,死亡率均为100.0 %,而注射灭菌PBS组观察15 d均无黄沙鳖死亡现象,活动及进食均正常,无任何病症。说明GXWXAA和GXWXAA1菌株对黄沙鳖均具有较强的致病力。
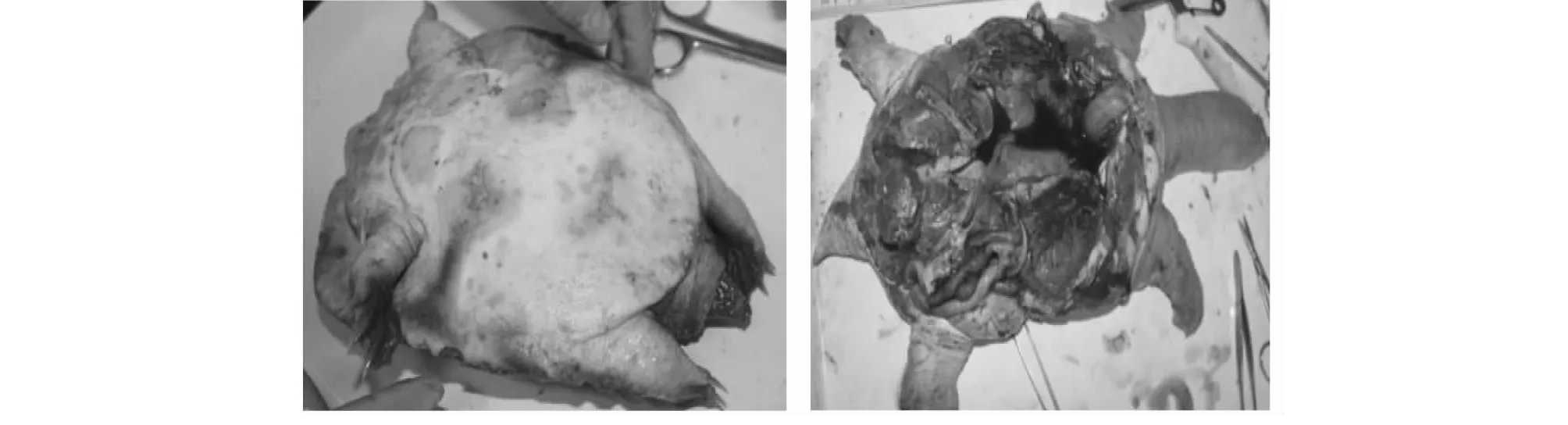
图1 患病黄沙鳖的主要临床症状Fig.1 Main symptoms of diseased Huangsha turtle

图2 黄沙鳖病原菌株GXWXAA的革兰氏染色结果、菌落形态和溶血性Fig.2 Gram staining morphology,colony morphology and hemolysis of strain GXWXAA of Huangsha turtle
在第1次人工感染试验中,大部分黄沙鳖出现反应迟缓和不摄食等现象,解剖后可见部分黄沙鳖的喉部有溃疡,腹腔有不同程度的腹水和肠道发炎,底板轻微发红,外观与自然患病黄沙鳖的症状基本吻合;第2次人工感染试验受试黄沙鳖的症状与第1次人工感染试验基本一致(图4),且2次人工感染试验分离到的菌株GXWXAA1和GXWXAA2的菌落和菌体形态与自然患病鳖分离的菌株GXWXAA一致,说明GXWXAA是引起广西武宣县某养殖场黄沙鳖发病死亡的病原菌。
2.4 细菌生化鉴定结果
使用API 50CH试剂条、API 50CHB培养基和API 20E试剂条(前12个项目)进行细菌生化鉴定,结果(表1~2)表明,菌株GXWXAA、GXWXAA1和GXWXAA2的生理生化特征一致。经APIWEB服务器的API 50CHB V4.0分析,菌株GXWXAA、GXWXAA1和GXWXAA2均鉴定为蜡样芽孢杆菌,置信度为99.0 %。
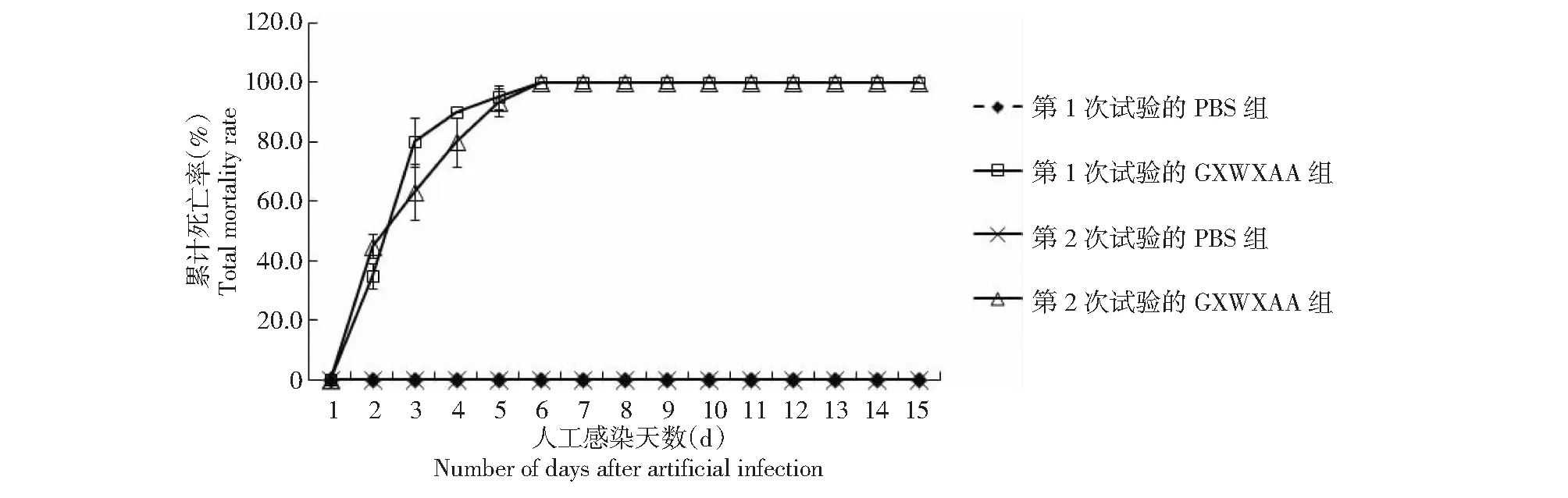
图3 2次人工感染试验黄沙鳖的累计死亡率Fig.3 Total mortality rate of double batches of artificial infection of Huangsha turtle

左:底板轻微发红;中:第1次人工感染试验黄沙鳖解剖图;右:第2次人工感染试验黄沙鳖解剖图Left:slight rubedo of plastron;Centre:anatomical figures of Huangsha turtle in the first artificial infection test;Right:anatomical figures of Huangsha turtle in the second artificial infection test图4 人工感染试验黄沙鳖的解剖症状Fig.4 Anatomical symptoms of Huangsha turtle in the artificial infection test
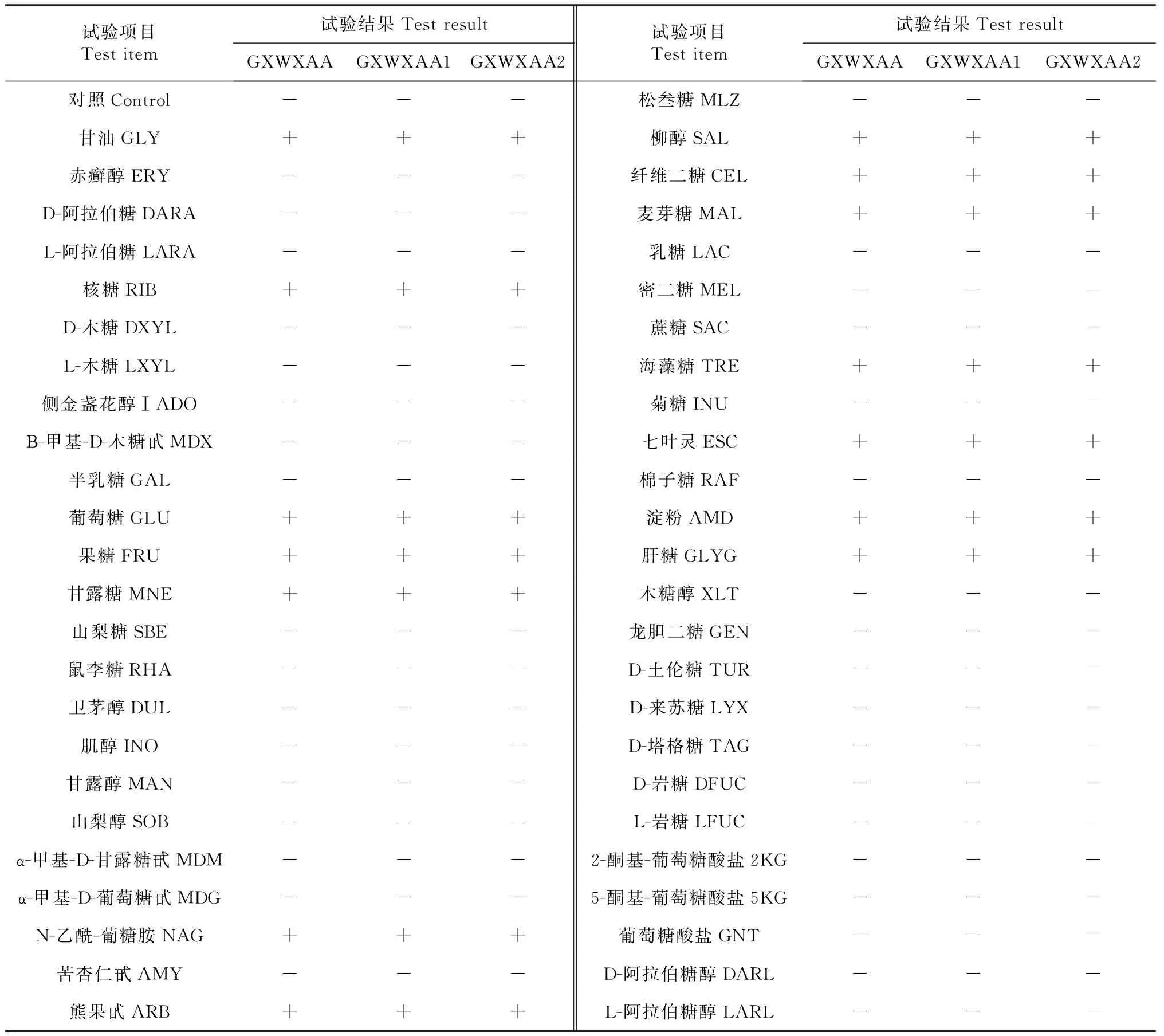
表1 菌株GXWXAA、GXWXAA1和GXWXAA2的API 50CH鉴定结果Table 1 Results of API 50CH identification of GXWUAA,GXWXAA1 and GXWXAA2 strains
注:“-”和“+”分别表示反应为阴性和阳性,下同。
Note:‘-’ and ‘+’ represented negative and positive reaction,respectively,the same as below.
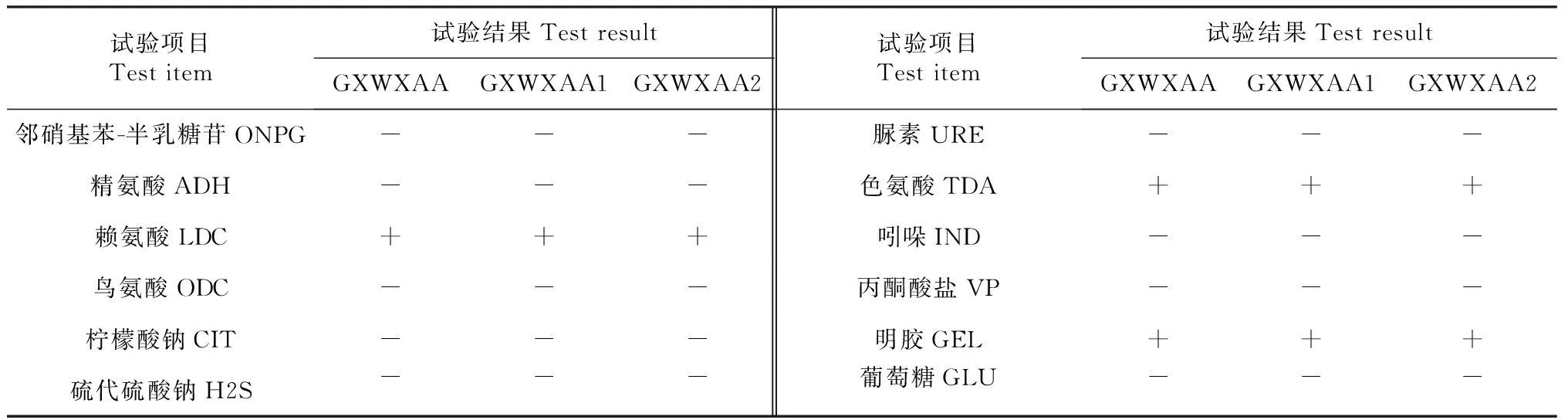
表2 菌株GXWXAA、GXWXAA1和GXWXAA2的API 20E鉴定结果Table 2 Results of API 20E identification of GXWUAA,GXWXAA1 and GXWXAA2 strains
2.5 分子生物学鉴定结果
对菌株GXWXAA、GXWXAA1和GXWXAA2的16S rRNA序列进行PCR扩增,均获得约1500 bp条带(图5)。测序结果表明,GXWXAA、GXWXAA1和GXWXAA2间的序列相似性均为100.0 %。基于16S rRNA序列相似性构建系统发育进化树(图6),结果发现菌株GXWXAA、GXWXAA1和GXWXAA2与蜡样芽孢杆菌JY5 (HQ833024)、JY7 (HQ833025)、JY9 (HQ833026)和VBE16(MG027671)聚为一支,亲缘关系最近,相似性均为99.9 %;与大肠杆菌U5/41 (NR_024570)的亲缘关系较远,相似性均为76.6 %。综合生化鉴定结果(表1和表2)和分子生物学鉴定结果,确定菌株GXWXAA、GXWXAA1和GXWXAA2为蜡样芽孢杆菌。
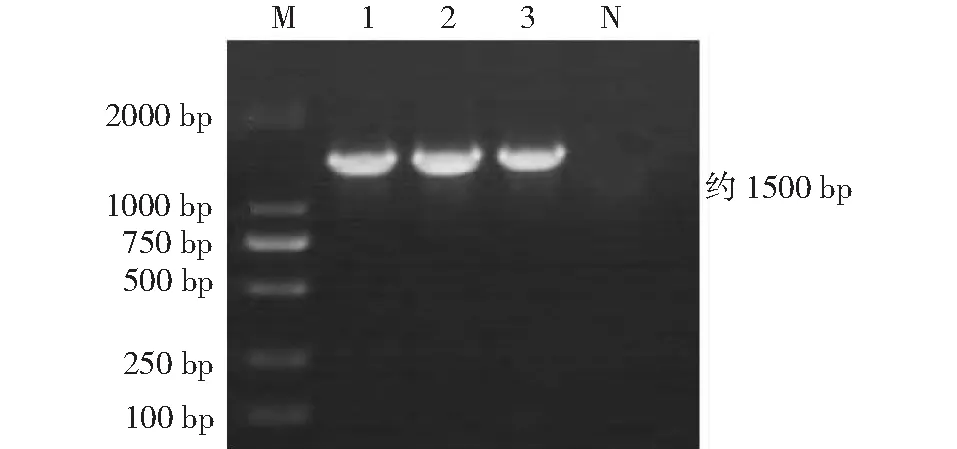
1:菌株GXWXAA;2:菌株GXWXAA1;3:菌株GXWXAA2;M:DL2000 DNA Marker;N:阴性对照1:Strain GXWXAA;2:Strain GXWXAA1;3:Strain GXWXAA2;M:DL2000 DNA Marker;N:Negative control图5 16S rRNA序列的PCR扩增结果Fig.5 PCR amplification result of 16S rRNA sequence
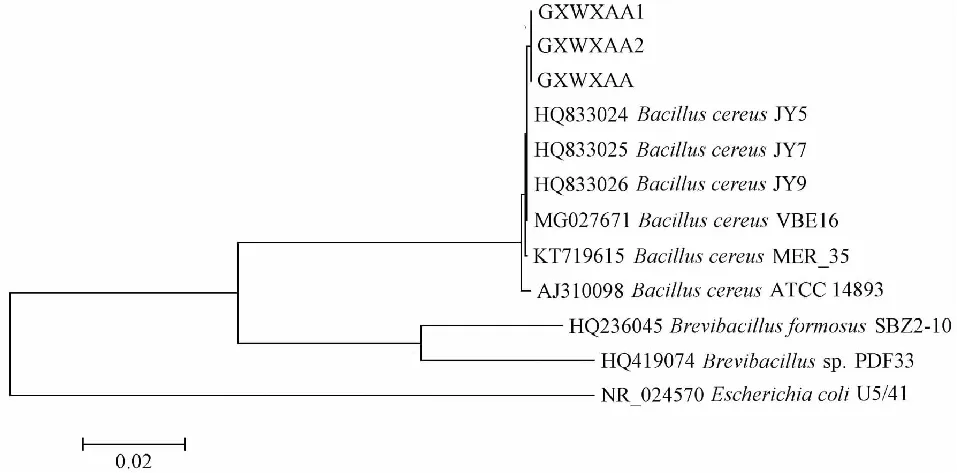
图6 基于16S rRNA序列相似性构建的系统发育进化树Fig.6 Phylogenetic tree based on the 16S rRNA gene sequences similarity
2.6 药敏试验结果
由表3可知,菌株GXWXAA对各种抗生素的敏感性各不相同,其中对新霉素、恩诺沙星和多西环素等15种抗生素敏感,对头孢曲松、环丙沙星和依诺沙星中介,对青霉素G、氨苄青霉素、复达欣、复方新诺明和多粘菌素B耐药。MIC试验结果(表4)表明,菌株GXWXAA对多西环素、新霉素和恩诺沙星均敏感,其MIC排序为新霉素>多西环素>恩诺沙星,与K-B纸片扩散法的判断结果(表3)一致。
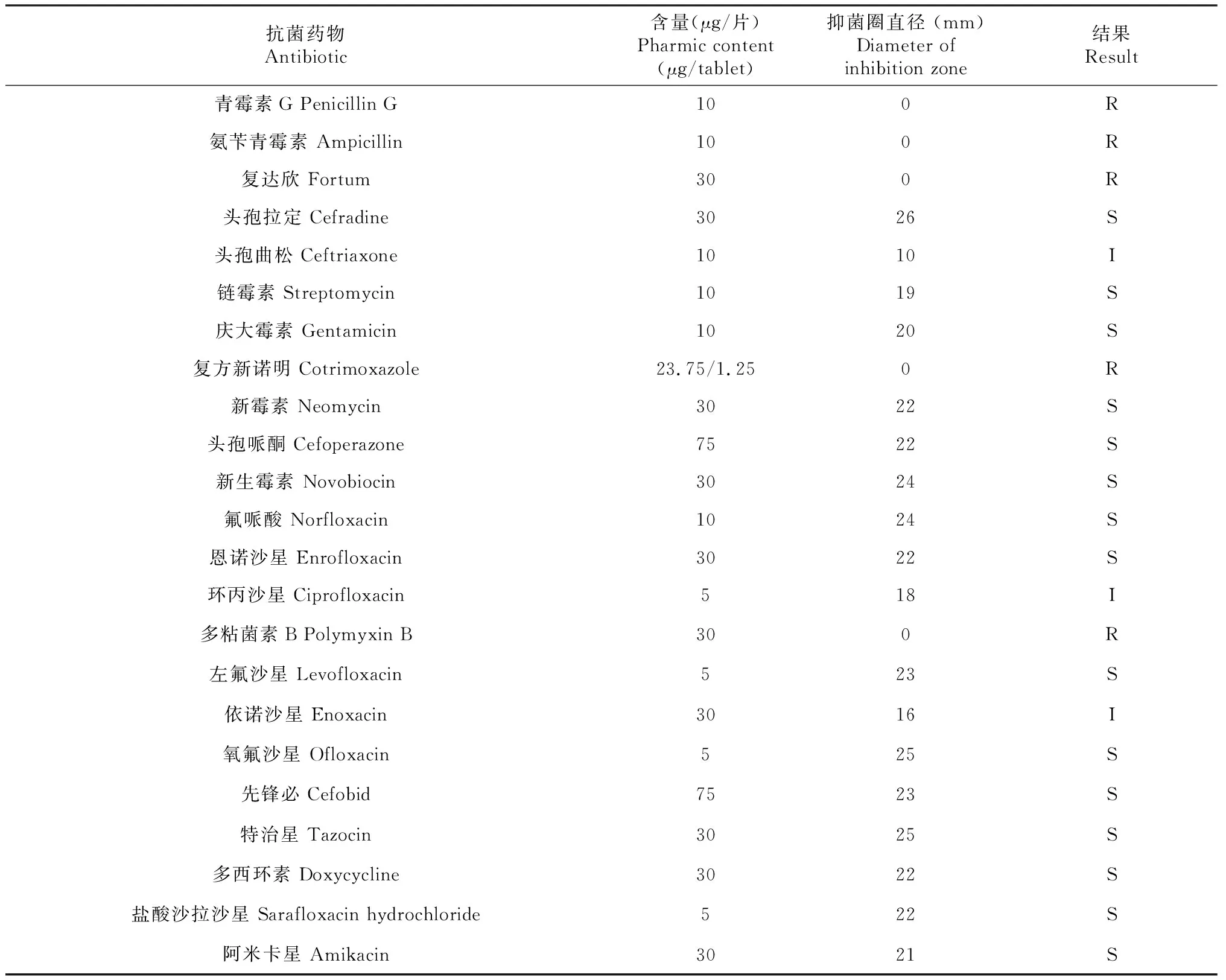
表3 菌株GXWXAA的药物敏感性试验结果(K-B纸片扩散法)Table 3 Results of antibiotic sensitivity test of strain GXWXAA(K-B disc diffusion test)
注:S表示敏感;I表示中介;R表示不敏感,下同。
Note:S indicates sensitive;I indicates moderately sensitive;R indicates resistant,the same as below.

表4 3种药物对菌株GXWXAA的最小抑菌浓度(μg/mL)Table 4 Minimum inhibitory concentration of three kinds of antibiotics against strain GXWXAA
3 讨 论
广义的蜡样芽孢杆菌被称为蜡样芽孢杆菌群,包括蜡样芽孢杆菌、苏云金芽孢杆菌(B.thuringiensis)、炭疽芽孢杆菌(B.anthraci)和蕈状芽孢杆菌(B.mycoides)等,这几种细菌DNA的同源性较高,形态和生化特征较相近[23]。目前,国内外对蜡样芽孢杆菌的鉴定方法包括生化鉴定和分子生物学鉴定等[24]。本研究从患病黄沙鳖肝脏中分离到1株菌株GXWXAA,经人工感染试验供试健康黄沙鳖感染死亡率达100.0 %;可观察到与自然病症相似的症状,且从感染发病黄沙鳖内脏分离到与菌株GXWXAA形态、分子和生理生化特征一致的菌株,表明菌株GXWXAA是导致武宣县某养殖场黄沙鳖患病死亡的致病菌;通过革兰氏染色和形态特征分析发现,菌株GXWXAA为具有芽孢的革兰氏阳性菌;基于16S rRNA序列的系统发育进化树和相似性分析结果可知,菌株GXWXAA与蜡样芽孢杆菌JY5、JY7、JY9和VBE16聚为一支,相似性均为99.9 %。综合细菌形态特征、生理生化特征及16S rRNA序列分析结果,GXWXAA菌株鉴定为蜡样芽孢杆菌。
蜡样芽孢杆菌在自然界分布广泛,已广泛应用于对养殖水质控制[8-9]。但近年来的研究表明,蜡样芽孢杆菌对养殖动物和人类产生了广泛的危害,除可导致奶牛[11]、马[13]、猪[14]、半滑舌鳎[15]、罗非鱼[16]、棘胸蛙[17]、中华鳖[18]和家蚕(Bombyxmori)[25]等多种养殖动物发病死亡外,还可引起人类的眼疾、败血症和心脑膜炎等疾病[10],因此,需高度关注其致病机理研究。动物感染蜡样芽孢杆菌后表现出的症状因种类不同而存在明显差异。仔猪感染主要表现生长不良、消瘦和腹泻[14];家蚕感染主要表现上吐下泻和中肠破裂,死亡率达100.0 %[25];罗非鱼人工感染后主要表现离群独游、肛门红肿、体表充血和肾充血发黑等,死亡率达60.0 %[16];马感染后表现皮肤发生脓肿溃疡[13];棘胸蛙感染后表现头部真皮层腐烂、肝充血淤血,反应变慢、食欲减退[17];半滑舌鳎感染主要表现皮肤充血溃烂、腹部红肿[15];中华鳖感染后表现症状包括腹甲有出血斑、颈部充血肿大、四肢无力、反应迟钝等[18]。本研究中,蜡样芽孢杆菌感染引起黄沙鳖发病的临床症状主要为底板充血发炎、疥疮和腐皮,裙边溃烂发炎,颈部充血肿大,腹腔中有大量腹水,肠道充血发炎,肝脏发黑变硬等,与上述文献报道其他动物的部分发病症状相似,其中包括行动缓慢、腐皮、肠道发炎和腹水等。细菌通常是通过伤口进入机体,经血液循环或淋巴循环引起各脏器等全身性感染[13],推测本研究中蜡样芽孢杆菌对黄沙鳖的感染可能也与表皮受损有关。致病性蜡样芽孢杆菌通常携带腹泻型肠毒素,如溶血素BL、非溶血性肠毒素Nhe、细胞毒素CytK、肠毒素T、肠毒素HlyⅡ及呕吐型毒素等,而这些毒素能引起人类或动物腹泻或呕吐型肠道疾病[14,25]。根据本研究中黄沙鳖的发病症状和分离菌株GXWXAA的溶血性推测,菌株GXWXAA可能携带有溶血素BL等肠毒素,从而引起黄沙鳖大量死亡。已知的蜡样芽孢杆菌包括有益菌和致病菌,建议生产上加强对含蜡样芽孢杆菌的微生态制剂或饲料添加剂进行相关致病基因携带情况检测和监控,避免因使用存在致病性菌株而对养殖造成人为的疾病传播、流行和损失,同时建议养殖户控制黄沙鳖的养殖密度,防止黄沙鳖相互撕咬造成表皮受损而感染病原。
目前,抗生素仍是防控龟鳖细菌性疾病的主要手段。本研究对菌株GXWXAA进行药敏检测,结果表明该菌株对新霉素等15种抗生素敏感,对头孢曲松等3种抗生素中介,对青霉素G等5种抗生素耐药,与黄俊云等[26]对44株医院临床标本的蜡样芽孢杆菌的药敏试验结果(对头孢唑林、氨苄西林、青霉素和复方新诺明的耐药率较高,对氧氟沙星和庆大霉素敏感率较高等)相似,但与其他来源蜡样芽孢杆菌的药敏试验结果存在差异,如菌株GXWUAA对多西环素、链霉素和头孢拉定敏感,对头孢曲松中介,而中华鳖源蜡样芽孢杆菌JY2、JY5、JY7和JY9对头孢拉定和头孢曲松均为耐药[18],罗非鱼源蜡样芽孢杆菌FJLF对链霉素中介、对多西环素耐药[16]等。可见,不同地区不同动物来源的蜡样芽孢杆菌其药物敏感性不完全相同,可能与各地区养殖户的用药习惯不同有关。本研究还检测了菌株GXWXAA对多西环素、新霉素和恩诺沙星的MIC,结果显示菌株GXWXAA对这3种国标渔药均为敏感,与K-B纸片扩散法检测结果相符,可为给药剂量的确定提供参考依据。已有学者对鲤科鱼类给药剂量和病原菌MIC的关系进行研究,发现鲤科鱼类理想的给药剂量为分离菌MIC的8.1倍[27],但本研究未针对黄沙鳖源蜡样芽孢杆菌的MIC确定给药剂量,有待进一步研究确定。建议在黄沙鳖养殖生产过程中不使用抗生素预防疾病,发生病情时应基于药敏试验结果选择内服敏感抗生素治疗,避免使用低浓度抗生素或长期使用同种抗生素[3,22,28],以免诱导细菌产生耐药性。
4 结 论
引起广西武宣县某养殖场黄沙鳖发病的病原菌属于蜡样芽孢杆菌,建议选择新霉素、恩诺沙星和多西环素等抗生素对患病黄沙鳖拌饲料内服进行治疗。

