HPV-16 E7负载的DC-CIK对宫颈癌细胞的杀伤效应研究*
张春利,蔡徐山,齐结华,宦 宇,吴守乐,乐江漫
(上海市嘉定区妇幼保健院检验科,上海 201821)
宫颈癌是严重威胁女性健康的恶性疾病之一,在生殖系统中发病率仅次于乳腺癌,且近年来发病率和致死率均逐年上升[1]。流行病学调查分析发现,髙危型人乳头瘤病毒(HR-HPV)持续感染是导致宫颈癌发生、发展的主要原因,不同型别的HPV致癌作用差别很大,其中HPV-16是目前所发现的最重要的致癌性HPV,感染人数占宫颈癌病例总数的1/2。HPV-16 E6、E7是诱导细胞恶变的主要蛋白,也是治疗宫颈癌的理想靶蛋白,如果能破坏体内表达HPV E6、E7蛋白的细胞,就能阻止肿瘤的发生、发展,其中E7蛋白抗原性更强[2-5]。近年来细胞免疫治疗已成为继手术、放疗、化疗之后治疗肿瘤的又一重要方法,尤其是特异性细胞免疫治疗已成为国际研究热点,目前树突状细胞(DC)联合细胞因子诱导的杀伤(CIK)细胞在多种肿瘤的治疗中取得了较好的疗效[6-9]。因此,本研究拟通过用HPV-16 E7蛋白抗原肽负载DC,再与CIK细胞共培养,观察其对siha细胞的杀伤作用,为治疗宫颈癌提供新的治疗方案。
1 材料与方法
1.1 材料 人外周血淋巴细胞分离液购自北京索莱宝,RPMI1640培养基购自sigma,胎牛血清购自Gibco公司,重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)、重组人白细胞介素-4(rhIL-4)、重组人肿瘤坏死因子-α(rhTNF-α)、干扰素-γ(IFN-γ)、重组人白细胞介素-1α(rhIL-1α)、重组人白细胞介素-2(rhIL-2)、白细胞介素-12(IL-12)ELISA试剂盒、IFN-γ ELISA试剂盒购自美国Pepro Tech 公司,流式抗体CD83、CD86、CD3、CD8、CD56购自美国BD公司,FITC-dextran购自santacruz,CCK8试剂购自Thermo,LDH释放检测试剂盒购自Promega,宫颈癌siha细胞购自中科院上海细胞库。
1.2 方法
1.2.1 HPV-16 E7抗原肽的设计与合成 以HPV-16 E7为标准,在UniProtKB蛋白库中,利用ExPASy-ProtScale、Antibody epitope prediction抗原表位预测网站及Cn3D软件,分析推测出可能成为抗原表位的氨基酸序列,最终根据亲水性、抗原性及表面可能性选取两条抗原肽,分别为Ag1(HPV-16 E738-54):CDGPAGQAEPDRAHYNN;Ag2(HPV-16 E714-27):SLQPETTDLNCYEQ,由吉尔生化(上海)合成。
1.2.2 DC培养 分离健康人单个核细胞(PBMC),磷酸盐缓冲液(PBS)洗涤3次,用含10%胎牛血清(FBS)的RPMI1640完全培养基混匀,接种至12孔板,37 ℃ 5% CO2培养3 h。将悬浮细胞转至T25培养瓶,进行CIK细胞诱导培养,剩余的贴壁细胞加入细胞因子进行DC诱导培养,其中rhGM-CSF 100 ng/mL、rhIL-4 30 ng/mL,隔天半量换液,第5天在相应孔中分别加入HPV-16 E7抗原肽,终浓度为50 μg/mL,分别标记为Ag1-DC、Ag2-DC、AgM-DC(两条抗原肽1∶1混合)进行抗原负载,第6天加入1 000 U/mL rhTNF-α促进DC分化成熟,第8天得到成熟DC。
1.2.3 CIK细胞培养 将悬浮细胞转移至T25培养瓶后,加入1 000 U/mL IFN-γ,37 ℃ 5% CO2培养箱中培养,24 h后加入50 ng/mL CD3单抗、1 000 U/mL IL-2、1 000 U/mL IL-1α,每3天换液1次,并添加相应浓度的IL-2,第8天收获CIK细胞。
1.2.4 DC-CIK共培养 分别将未加抗原负载的成熟DC、Ag1-DC、Ag2-DC、AgM-DC与CIK细胞以1∶10比例共培养,每两天补充含10%血浆、100 ng/mL rhGM-CSF、1 000 U/mL IL-2的RPMI1640培养基,7 d后收获DC-CIK、Ag1-DC-CIK、Ag2-DC-CIK、AgM-DC-CIK。
1.2.5 流式细胞术检测细胞表型 将需检测的细胞用PBS洗涤重悬,分别加入相应抗体,混匀后室温避光孵育20 min,流式细胞仪检测DC摄取能力及表型(CD83、CD86)、CIK细胞表型(CD3、CD8、CD56)。
1.2.6 ELISA法检测细胞因子 取未成熟DC(iDC)、成熟DC(mDC)细胞上清液,ELISA法检测IL-12水平;取CIK细胞、DC-CIK、Ag1-DC-CIK、Ag2-DC-CIK、AgM-DC-CIK细胞上清液,检测IFN-γ水平。
1.2.7 CCK8法检测效应细胞对siha细胞活性的影响 实验分为5组,取对数生长期的siha细胞,接种于96孔板,1×104个/孔,贴壁后,将效应细胞CIK、DC-CIK、Ag1-DC-CIK、Ag2-DC-CIK、AgM-DC-CIK分别加入靶细胞siha培养体系中(效靶比5∶1、10∶1、20∶1),培养72 h,加入CCK8 10 μL/孔,于培养箱中孵育2 h,在450 nm处检测吸光度值(A值),取3个平行复孔的平均值。
1.2.8 LDH释放法检测效应细胞对siha细胞的杀伤率 将对数生长期的siha细胞接种于96孔板,1×104个/孔,同时将效应细胞CIK、DC-CIK、Ag1-DC-CIK、Ag2-DC-CIK、AgM-DC-CIK分别加入siha细胞培养体系中(效靶比5∶1、10∶1、20∶1),并设置自然释放孔、最大释放孔,在490 nm处检测A值,计算各组细胞杀伤率,杀伤率(%)=(实验组A值-自然释放组A值)/(最大释放组A值-自然释放组A值)×100%。

2 结 果
2.1 DC、CIK细胞形态学观察 外周血PBMC贴壁细胞经细胞因子诱导后,体积增大,呈悬浮或半悬浮状态,形态不规则,成熟后细胞表面有毛刺样突起,为典型的DC(图1A);CIK细胞与DC共培养后,增殖较快,呈集落生长(图1B)。
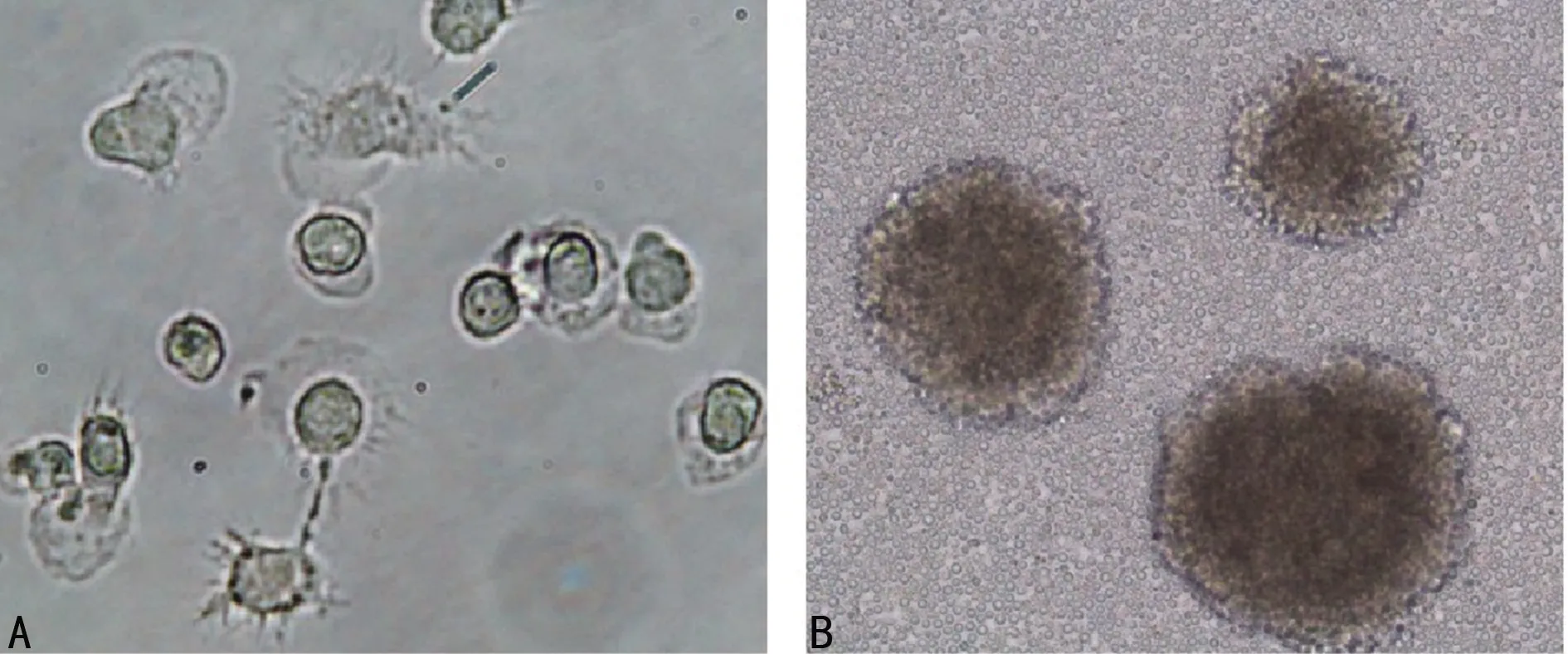
注:A表示 mDC(×400); B表示 DC-CIK(×100)。
图1 成熟DC、DC-CIK共培养形态
2.2 DC、CIK细胞表型鉴定 流式细胞仪检测未成熟DC(iDC)、成熟DC(mDC)细胞摄取能力及CD83+、CD86+的表达水平,结果表明,DC成熟后,摄取能力降低,CD83+、CD86+表达率升高,差异有统计学意义(P<0.05),见表1;DC-CIK细胞表面CD3+CD8+、CD3+CD56+表达水平高于CIK细胞,差异有统计学意义(P<0.05),见表2。
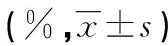
表1 DC成熟前后摄取率及表型的变化
注:与iDC比较,*P<0.05。
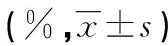
表2 与DC共培养后CIK细胞表型的变化
注:与CIK比较,#P<0.05。
2.3 DC、CIK细胞分泌细胞因子能力比较 ELISA结果显示,与iDC[(141.30±2.12)pg/mL]相比,mDC上清液中IL-12[(235.20±3.58)pg/mL]增多,差异有统计学意义(P<0.05)。与CIK细胞[(328.60±5.41)pg/mL]相比,DC-CIK[(472.90±4.17)pg/mL]、Ag1-DC-CIK[(502.30±5.64)pg/mL]、Ag2-DC-CIK[(527.60±5.44)pg/mL]、AgM-DC-CIK[(538.20±4.93)pg/mL]细胞上清液中IFN-γ增多,差异有统计学意义(P<0.05)。
2.4 效应细胞对siha细胞活性的影响 5组效应细胞对siha细胞均有抑制作用,但与CIK组相比,其余4组抑制作用更强,且经HR-HPV-16 E7蛋白抗原肽负载的3组效应细胞,在效靶比为10∶1、20∶1时,抑制作用均高于DC-CIK组,差异有统计学意义(P<0.05),见图2。
2.5 效应细胞对siha细胞的杀伤效应 与CCK8结果相似,5组效应细胞对siha细胞均有杀伤作用,但效靶比为10∶1和20∶1时,共培养的4组效果明显强于CIK组,且经抗原肽负载的3组效应细胞Ag1-DC-CIK、Ag2-DC-CIK、AgM-DC-CIK杀伤能力强于DC-CIK组,在5∶1、10∶1、20∶1范围内,随效靶比升高,杀伤作用也越强,差异有统计学意义(P<0.05),见图3。
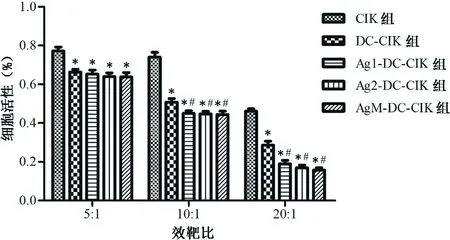
注:与CIK组比较,*P<0.05;与DC-CIK组比较,#P<0.05。
图2 各组效应细胞对siha细胞活性的影响
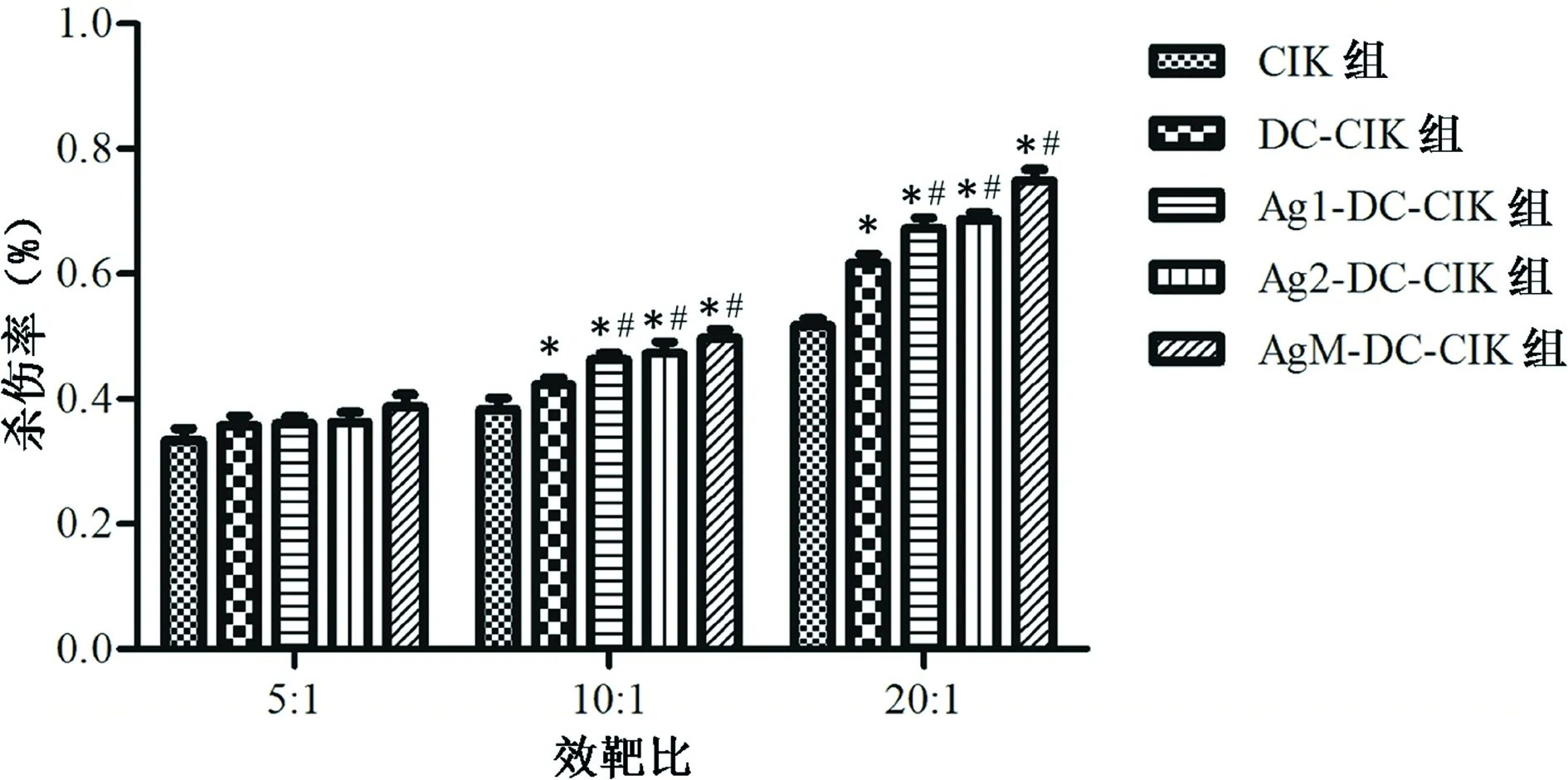
注:与CIK组比较,*P<0.05;与DC-CIK组比较,#P<0.05。
图3 各组效应细胞对siha细胞的杀伤率
3 讨 论
宫颈癌在全球女性恶性肿瘤发病率中居第2位,严重威胁着女性的健康和生命[2-4]。据世界卫生组织统计,每年新发病例中,发展中国家所占比例高达80%,而我国宫颈癌发病率和病死率约占全世界的1/3,并且有年轻化趋势[5]。因此防治宫颈癌及改善患者预后的工作极为重要。目前对于宫颈癌的治疗主要以手术与放疗为主,化疗为辅,但由于常见的胃肠道反应、肾毒性、骨髓抑制等缺点,限制了化疗在临床的长期应用[10-11]。病因学和流行病学研究表明,HR-HPV持续感染是宫颈癌及其癌前病变的主要病因[12],其中,HPV-16是目前发现的最重要的致癌性HPV,感染人数占宫颈癌病例总数的1/2。HPV基因组中一般含8个可读框(ORF),其中E6、E7是主要致瘤蛋白。E7主要与pRb特异性结合,改变细胞周期,从而引起细胞的恶性转化和无限增殖,导致细胞永生化[13-15]。
DC是目前发现的体内最经典的抗原提呈细胞,能够将抗原加工处理后呈递给 CD8+T 细胞,促使T细胞增殖分化为细胞毒性 T 淋巴细胞,从而对抗恶性肿瘤。CIK细胞主要来源于T细胞,是一组细胞群,不仅具有T细胞强大的抗肿瘤活性,还具有NK细胞非MHC限制性杀死肿瘤细胞的优势。而DC和CIK细胞共培养,CIK细胞促使DC进一步成熟,成熟DC又会加快CIK细胞释放IFN-γ等有效因子,DC、CIK细胞的这种相互作用使培养的细胞获得了对肿瘤细胞更强的杀伤能力[6-8]。已有研究表明,DC处理肿瘤抗原,然后与CIK细胞共培养,可以提高对特定靶细胞的杀伤能力。DC-CIK对乳腺癌[6]、肺癌[9,16]、卵巢癌[17]等均能有效控制,不良反应作用小,不损伤正常组织,能有效改善患者的免疫功能。
大部分肿瘤没有特异性抗原,只能反复冻融肿瘤细胞来负载DC,但其特异性和有效性受到了限制,且可能对正常细胞也会进行攻击。宫颈癌发病机制明确,因此,根据HPV-16特性,设计并合成了E7蛋白抗原肽作为特异性抗原负载DC。实验结果表明,DC-CIK共培养可以提高抗肿瘤T淋巴细胞百分比,分泌更多的IFN-γ,在效靶比为10∶1、20∶1时,对靶细胞siha的杀伤效应高于CIK细胞,而经HPV-16 E7抗原肽负载的DC与CIK细胞共培养,表现出对靶细胞更加强大的杀伤作用,并随效靶比升高而增强。将两条抗原肽等比例混合负载DC与CIK细胞共培养,与单条抗原负载的DC-CIK相比,杀伤效果比较差异无统计学意义(P>0.05),但明显强于单纯CIK细胞和DC-CIK,这对于指导治疗宫颈癌有重要意义。
4 结 论
本研究设计的两条HPV-16 E7抗原肽,负载DC后,能进一步激活CIK细胞,增强对宫颈癌siha细胞的杀伤效应,为临床宫颈癌的治疗提供了理论依据,但尚需进一步的体内实验加以证实,其具体机制也有待进一步研究。

