先天性巨结肠症患儿基于加速康复外科的围手术期营养干预
史雯嘉,黄燕,龚莹莹,蔡莉,方觅晶,李素云
加速康复外科是以精准微创为核心,采用一系列围手术期优化措施,包括营养管理、减少机械性灌肠、疼痛管理、管道管理、早期进食、延伸服务等环节管理,减少患者生理和心理的创伤应激,有助于患者快速康复[1-2]。先天性巨结肠症(Hirschsprung′s Diseas,HD)患儿由于肠管的黏膜下神经丛和肌间神经丛神经节细胞缺如,肠管丧失蠕动功能,导致肠梗阻[3],手术治疗是最有效的治疗措施。营养不良会影响儿童的生长发育,降低机体功能[4]。而HD患儿由于长期便秘,手术肠管的切除,营养吸收较差,存在一定的营养风险及营养不良,若营养不良得不到及时纠正,会增加感染以及相关并发症的发生风险。因此对HD住院患儿进行营养筛查,对存在营养风险患儿进行及时干预和营养管理显得尤为重要。围术期加速康复外科理念下的营养支持在国内多聚焦于成人手术患者,而对于小儿外科手术特别是HD加速康复及围术期营养支持的研究相对较少。我科将加速康复外科理念用于HD患儿围术期营养干预,取得较好效果,报告如下。
1 资料与方法
1.1一般资料 将2016年10月至2017年9月在我科行先天性巨结肠根治手术的45例患儿作为对照组,将2017年10月至2018年12月行先天性巨结肠根治手术的68例患儿作为观察组。纳入标准:①经钡剂灌肠、直肠肛管抑制反射检查、直肠黏膜活检等检查确诊;②拟行腹腔镜或机器人辅助腹腔镜巨结肠根治术;③家属同意参加本研究,接受加速康复外科管理。排除标准:①合并肺部感染、复杂先心病;②全结肠型巨结肠或巨结肠同源病;③合并中、重度小肠结肠炎。两组一般资料比较,见表1。本研究经我院伦理委员会批准,患儿家属同意并签署知情同意书。
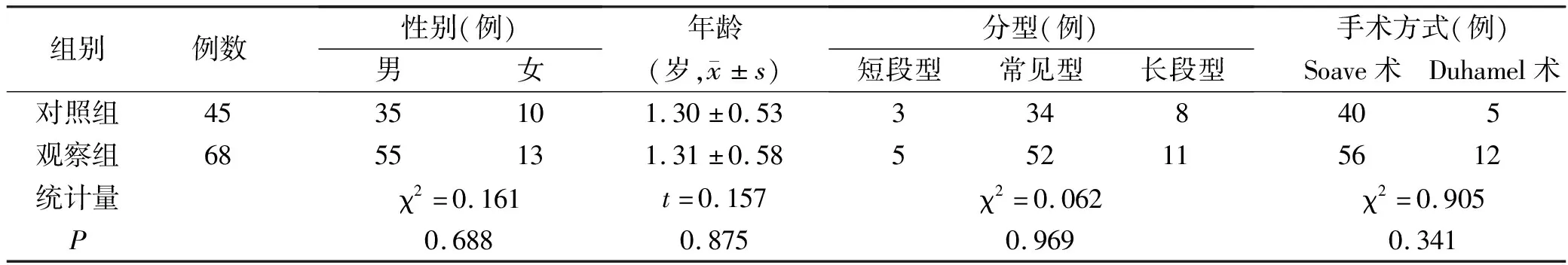
表1 两 组 一 般 资 料 比 较
1.2方法
1.2.1实施方法
对照组由责任护士按照HD围手术期护理常规给予指导,术前行巨结肠灌洗7~14 d,嘱进食高营养、高蛋白、少渣饮食,术前3 d开始流质饮食;术前禁饮食6~8 h,术后行胃肠减压,持续禁饮食3~5 d,给予肠外静脉高营养支持治疗。观察组成立HD加速康复外科多学科团队,由营养支持专科小组具体承担患儿围术期的营养支持管理工作,具体如下。
1.2.1.1成立营养支持专科小组 营养支持专科小组由护士长、营养科医生、临床医生各1名,临床责任护士2名组成。护士长担任组长,做好组员间的协调工作,实施监督营养治疗过程;营养科医生参与临床营养会诊,制定营养治疗方案,定期访视患儿;临床医生参与患儿营养风险评估,协助营养师制定个体化的营养治疗方案,开具营养医嘱,对营养支持效果进行监测及原发病治疗;临床责任护士(小儿外科专业护理工作5年以上,并通过护理部营养专科护士理论知识考试)负责住院患儿的营养风险评估,并定期复评,联系营养科医生会诊,根据营养治疗医嘱配制肠内和/或肠外营养制剂,根据医嘱,遵照规范对患儿实施营养治疗,观察患儿实施营养治疗的效果与并发症,并对实施营养治疗的患儿实施健康教育。小组职责:①组织营养护理查房,分析讨论HD营养高风险及营养不良患儿的典型个案,每2周1次,要求全科护理人员参与;②落实肠内、肠外营养一级质控,具体内容包含营养风险护理评估、肠外/肠内营养护理评估、肠外/肠内营养液配制、肠外/肠内营养输注护理,由临床营养责任护士每月至少抽查5例HD患儿,针对存在的问题进行原因分析,进行持续质量改进;③开展营养读书报告活动,每月1次,通过查阅文献、撰写读书报告、制作PPT进行分享,并将营养专题学术报告和讲座内容传达到科室人员,给予营养护理培训与指导。
1.2.1.2营养风险筛查 采用Hulst等[5]提出的STRONGkids筛查工具进行测评,包括主观临床评价、高风险疾病、营养摄取与丢失、体质量减轻/体质量增长过缓4个方面。入院后由临床责任护士完成。总分0分为低营养风险;1~3分为中等营养风险;4~5分为高营养风险。低营养风险每周评估1次,中、高风险每周评估2次,根据风险等级进行相应处理。有营养风险者请营养科医生48 h内到病区会诊,结合临床医生意见及加速康复外科理念为患儿制定个体化营养支持方案。
1.2.1.3术前营养支持 ①由营养支持专科小组针对患儿特点制定营养食谱。对于低营养风险HD患儿术前3 d进流质饮食,如牛奶、米汤、蛋羹等;中等营养风险的患儿术前3 d给予小儿肠内营养制剂,每日总量80~120 mL/kg,术前1 d增加肠外营养支持,为全营养混合液,剂量为生理需要量的一半;高风险患儿入院后给予口服小儿肠内营养制剂,每日总量至少达80~120 mL/kg,术前3 d增加肠外营养支持,为全营养混合液,剂量为生理需要量的一半。术前进食肠内营养制剂时必须达到最低标准,根据患儿需求进食,不必控制总进食量,只需遵循配比方法即可。②实时监测营养指标,术前进行一段时间的营养支持治疗,使患儿的血红蛋白>110 g/L,白蛋白>35 g/L,以助患儿耐受手术和具备术后康复所需的能量储备。
1.2.1.4术前禁饮食 术前禁食固体食物6~8 h,禁食母乳4 h,禁食清饮料2 h。术前2 h可口服碳水化合物(12.6%的麦芽糊精果糖饮品)10 mL/kg,以改变患儿空腹状态下的能量储存和保持碳水化合物的代谢,减少患儿体质量丢失。禁食期间注意观察患儿主观感受,出现口渴、饥饿、哭闹等不适时给予静脉补充葡萄糖液体,避免脱水及低血糖的发生[6]。
1.2.1.5术后早期进食 术后2 h开始少量喂水5 mL/h,1岁以上患儿可舔吮棒棒糖,每4 小时1次,每次20~30 min,以缓解婴幼儿术后疼痛;并通过酸味、甜味刺激味觉,增加唾液分泌,促进肠蠕动。禁食期间给予静脉高营养治疗。术后早期经口进行肠内营养支持,1岁以内选用蔼儿舒奶粉,1岁以上选用小百肽奶粉,术后24 h试服营养素10~20 mL,每1~2小时1次,逐渐增至20~30 mL,每3~4小时1次,采用间歇性喂养,可产生自然饥饿-饱胀效果。喂养后注意监测胃肠道耐受性,观察有无恶心、呕吐、上腹胀痛、腹泻等不耐受的表现。患儿如排气、排便正常、腹部平软,则可每日由少至多,少量多餐,循序渐进,逐次加量至正常营养量。当肠内营养摄入总量>50 mL/(kg·d)时,可停用肠外营养。肠内外营养交替过程至少需要1周时间,1周后年龄较大患儿可少量添加牛奶、米汤等流质饮食,须密切监测营养状态及患儿胃肠道耐受性,术后2周根据小儿耐受情况,从肠内营养素逐渐过渡至奶(小婴儿)或易消化饮食(婴幼儿和儿童),无异常在术后第4周逐渐过渡至正常饮食。
1.2.2评价方法 比较入院第1天、术后第3天及术后1周两组血清学指标(包括前白蛋白、血红蛋白、超敏C反应蛋白)、术后营养相关并发症(包括静脉炎、低血糖、电解质紊乱)以及术后恢复情况(包括术后进食时间、肠道通气时间、住院时间)。
1.2.3统计学方法 采用SPSS21.0软件进行t检验和χ2检验,检验水准α=0.05。
2 结果
2.1两组不同时间血清学指标比较 见表2。
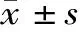

组别时间例数前白蛋白(mg/dL)血红蛋白(g/L)超敏C反应蛋白(mg/L)对照组入院第1天4515.32±1.14114.36±13.321.25±0.13术后第3天459.34±2.6798.65±21.7865.97±4.93术后1周 4510.43±2.44109.30±16.887.87±1.65观察组入院第1天6815.14±1.87112.32±15.431.30±0.13术后第3天6811.21±1.32109.48±12.3355.36±3.13术后1周 6813.55±1.07116.31±11.915.06±0.58t10.5780.762-1.920t24.942∗∗3.369∗∗14.004∗∗t39.295∗∗2.589∗12.818∗∗
注:*P<0.05,**P<0.01;t1为两组入院第1天比较;t2为两组术后第3天比较;t3为两组术后1周比较。
2.2两组术后营养相关并发症发生情况比较 见表3。

表3 两组术后营养相关并发症发生情况比较 例
2.3两组术后恢复情况比较 见表4。
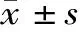
表4 两组术后恢复情况比较 d,
2.4观察组患儿初次与出院时营养风险筛查等级比较 观察组初次评定存在高风险15例,中等风险53例;出院时高风险6例,中等风险62例。出院时风险等级显著下降(χ2=4.528,P=0.033)。
3 讨论
3.1营养支持专科小组的建立促进了围术期HD患儿营养治疗 HD患儿由于长期便秘、营养摄入不足,常表现为消瘦、身高体质量不达标、脂肪含量偏少、低蛋白血症、免疫力下降,而手术可导致肠道细胞缺损,肠功能紊乱,营养吸收障碍[7],因此术前术后的营养支持对加快机体恢复和降低并发症发生率有重要意义[8]。传统方法中HD营养支持缺乏个体化指导,且术前、术后禁食时间长,未做到有效的营养管理。2002年欧洲的1份调查报告指出,住院患者营养不良发生率居高不下与缺乏有效的营养风险筛查、临床营养管理不到位密切相关[9],因此欧洲儿科胃肠肝病营养学会呼吁建立“营养支持小组”,旨在对住院患儿进行科学有效的营养管理,降低营养不良的患病率[10]。鉴此,我科成立HD加速康复多学科团队,建立营养支持专科小组,在患儿入院时由临床责任护士结合临床医生意见进行营养风险筛查,并将筛查结果及时通知营养科医生,营养科医生结合临床医生意见及加速康复外科理念为患儿制定科学个体化的营养支持方案,临床责任护士根据医嘱,执行患儿的营养治疗,在实施营养治疗期间观察应用效果及相关并发症,并定期复查,根据结果营养支持专科小组动态调整营养支持方案。与此同时,小组每月落实肠内、肠外营养一级质控,对营养管理起到了监督作用。营养护理查房与读书报告活动,使得HD患儿的营养管理更为规范化、合理化。
3.2加速康复外科理念下的围术期营养治疗有效改善了患儿营养状况 围术期营养支持是加速康复外科手术中的重要环节。HD患儿由于营养摄入不足,加上疾病所致代谢增加,还需要维持其生长发育的能量补给,而患儿体内储备能量少,各组织器官发育尚不成熟,对营养缺乏的耐受性差,存在较高的营养风险,若未及时处理,可发生营养不良,致使机体抵抗力、修复力下降,导致相关并发症及病死率上升。因此,对住院患儿进行营养筛查极为重要[11]。STRONkids工具可快速筛选出会发生营养问题的患儿,尽早实施干预措施,避免其真正发生营养不良[12]。本研究结果显示,观察组出院时营养高风险患儿比初次评定显著减少(P<0.05),说明营养支持专科小组的管理起到了有效的作用。同时通过检测生化指标也可间接反映营养代谢状况,通过表2可以看出两组患儿入院时血清学指标差异无统计学意义,针对不同营养风险患儿实施个体化干预,术前制定特定营养食谱,指导选择合理的肠内营养制剂,并正确服用剂量,根据营养风险等级必要时增加肠外营养支持,使患儿能耐受手术应激和具备术后康复所需的能量储备;同时结合快速康复外科理念,缩短禁食时间。经研究证实术前2 h饮清饮料10 mL/kg是合适的饮用量,并未增加手术期间呕吐/误吸的风险[13]。术后早期进食,在禁饮食期间或摄入不足时通过完全或部分肠外营养供给热量、液体、营养素,能够迅速提高血清白蛋白和血浆渗透压,减轻组织水肿,改善机体状态,促进恢复,而在加速康复外科理念中,肠内营养仍然是临床营养支持的首选方式,围手术期选择肠内营养制剂口服,提供了足够的营养,术后第3天和1周,观察组前白蛋白、血红蛋白显著高于对照组,超敏C反应蛋白显著低于对照组(P<0.05,P<0.01)。提倡早期进食,肠内营养不够时给予肠外营养补充,有效减少了术后营养相关并发症的发生,从表3可以看出,与对照组相比,观察组静脉炎、低血糖、电解质紊乱发生率显著减低(P<0.05,P<0.01),术后营养并发症得到了有效的改善。在术后2 h,指导观察组患儿少量试喂水或吸吮棒棒糖,增加了唾液分泌,促进了肠蠕动,加快了肠功能恢复;在增加营养素过程中循序渐进,及时监测胃肠道耐受性,提高了安全性,缩短了术后住院时间,表4显示,与对照组相比,观察组术后进食时间、术后通气时间、术后平均住院日显著缩短(P<0.05,P<0.01)。
综上所述,在加速康复外科理念下实施围术期营养支持,观察组出院时营养高风险患儿比初次评定明显降低;与对照组相比,观察组患儿营养状况得到有效改善,营养相关并发症发生率降低,加快了术后恢复。加速康复外科理念下的营养支持应贯穿于患儿围手术期的每一个阶段。临床营养治疗是危重患者治疗的重要环节,营养治疗理论及技术不断进步发展,但临床实践仍存在一定安全隐患。规范营养安全实施流程,降低营养相关风险,提高营养治疗护理质量是临床一线护理人员需要关注的要点。

