运用手持技术测定“蓝瓶子”实验中溶解氧浓度的变化
任峰 祖保
【摘要】运用手持技术测定“蓝瓶子”实验中溶解氧浓度的变化,以探究其大小对该变色反应进行方向的影响。从而阐明了振荡程度的大小和持续时间的长短与振荡周期的关系,以期对“蓝瓶子”实验有借鉴和指导作用。
【关键字】蓝瓶子实验 溶解氧 传感器
【中图分类号】G633.8 【文献标识码】A 【文章编号】1992-7711(2020)10-136-02
“蓝瓶子”实验是中学化学中非常重要并受到师生广泛喜爱的一个实验,该实验能够引导学生了解振荡反应,探究影响化学反应的条件并认识控制反应条件的方法。但是对于反应过程中溶液中的溶解氧(dissolved oxygen 简称DO)的浓度变化却鲜有人研究。我们运用手持技术测定蓝瓶子实验中溶解氧浓度的变化,以探究其大小对该变色反应进行方向的影响。
一、 实验原理
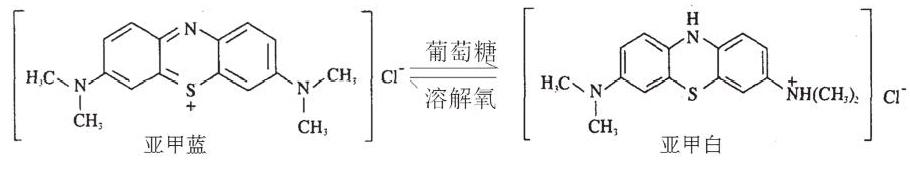
亚甲蓝是一种常用的氧化还原指示剂。在碱性条件下,使用葡萄糖作为还原剂或溶解氧作为氧化剂,可以使该指示剂在蓝色和无色之间发生变化。其转化关系如下所示:
蓝色的亚甲蓝溶液在碱性条件下被葡萄糖还原成无色的亚甲白溶液。实验时振荡盛有上述无色溶液的锥形瓶,使空气中的氧气溶入混合液,亚甲白被溶解氧氧化成亚甲蓝,溶液又重新变回蓝色。静置一段时间,亚甲蓝再次被葡萄糖还原,变成亚甲白,溶液又一次褪为无色。通过反复振荡、静置,可以使锥形瓶内的混合液在蓝色与无色之间来回变化。
发生在“蓝瓶子”中的这种生动有趣的实验现象被称为亚甲蓝的化学振荡。从出现蓝色到褪为无色所消耗的时间为一个振荡周期。振荡周期的长短受溶解氧的含量、葡萄糖的浓度、反应温度、氢氧化钠的用量等因素影响。本实验重点研究溶解氧的含量对振荡周期和反应方向的影响。
二、实验过程
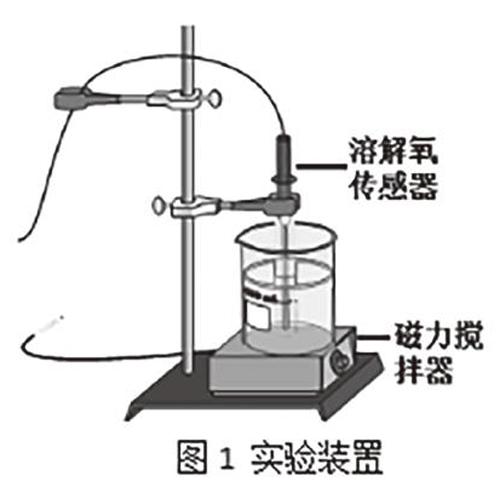
1.按图1装置连接好仪器。向250mL烧杯中依次加入3.0 g葡萄糖、2.0 g 氢氧化钠、100 mL水。待溶解完全后,向其中滴加5滴0.2%的亚甲蓝溶液,轻轻搅拌后静置。混合液由蓝色褪为无色。
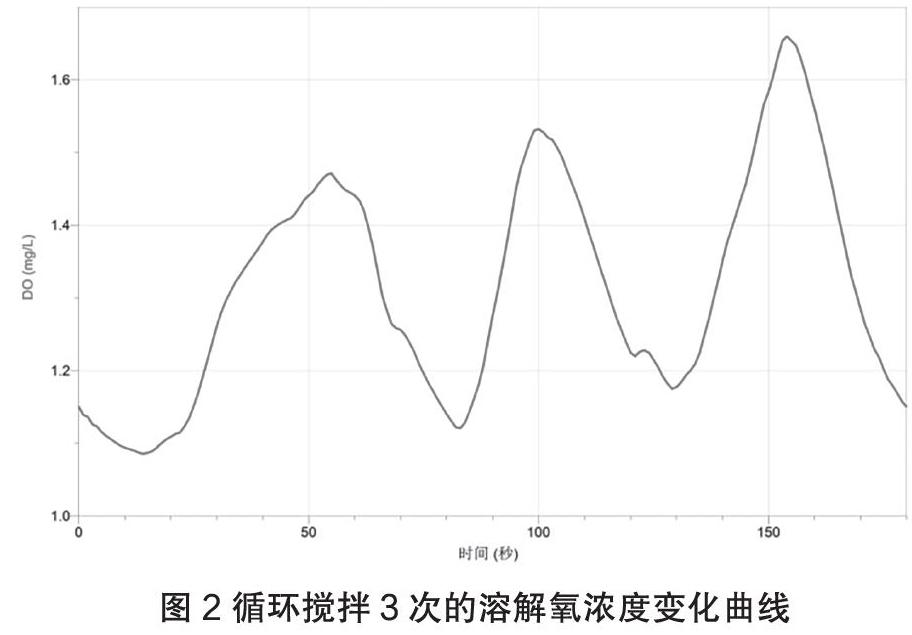
2.把烧杯放在磁力搅拌器上,放入磁子,插入溶解氧传感器,缓慢搅拌并开始采集。然后逐渐加快搅拌速度,直到溶液变为蓝色,再缓缓降低搅拌速度,等到溶液褪为无色时,再次加快搅拌速度。如此循环2~3次。所得曲线如图2.
3.待混合液由蓝色褪为无色后,再次重新开始采集数据。一边使用磁力搅拌器持续快速搅拌,一边观察曲线变化。直到混合液中的溶解氧含量升到最高时,缓缓降低搅拌速度,等到溶液褪为无色时,重复第2步操作。所得曲线如图3所示。
三、 图像分析
溶解氧的含量跟大气压、空气中氧气的分压、水温等关系密切。在20℃、100kPa下,纯水饱和时大约溶解氧9 mg/L.用溶解氧传感器测出本实验所用蒸馏水的溶解氧含量为 8.2 mg/L.
从图2可以看出,在起始时溶液中的溶解氧浓度就已经降到1.1 mg/L左右,此时溶液为无色。这个数据说明葡萄糖已经消耗了溶液中的大部分溶解氧,此时空气中的氧气溶解的速率等于葡萄糖消耗溶解氧的速率,溶液处于平衡状态,溶解氧的浓度保持不变,指示剂已经被还原为亚甲基白。然后加快搅拌速度,溶解氧的浓度随之增大,曲线开始上升。原平衡开始被打破,开始向生成亚甲基蓝的方向移动。当溶解氧的浓度增大到1.2 mg/L左右时,已经可以看到溶液变为淡蓝色。继续搅拌,溶解氧浓度持续增大,溶液颜色也逐渐加深。当溶解氧的浓度增大到1.5 mg/L左右时,溶液变为深蓝色。减慢搅拌速度,溶解氧浓度开始降低,溶液的颜色开始变浅。当溶解氧浓度等于1.2 mg/L左右时,蓝色褪为无色。溶解氧浓度继续降低到1.1 mg/L左右保持不变。至此,一个循环结束,一个振荡周期大约经历50 s.
而持续快速搅拌混合液(见图3),溶解氧浓度会不断上升,直到增大至接近6.0 mg/L后停止上升。此时距离本实验所用蒸馏水的溶解氧含量8.2 mg/L还差2.2 mg/L.相應地,一个振荡周期也延长到200 s左右。如果恢复到先前实验的振荡程度时,振荡周期也就又回到了50 s左右。
四、结论
由此可见,在其他条件相同和有空气存在时,“蓝瓶子”实验以溶解氧浓度为1.2 mg/L为界限。当溶解氧浓度大于1.2 mg/L时,混合液显蓝色,小于此浓度时,褪为无色。振荡程度越剧烈,持续时间越长,那么溶解氧的浓度就越大,溶液蓝色就越深,振荡周期也就越长。所以在做“蓝瓶子”实验时,可以通过调整振荡混合液的剧烈程度和时间的长短来控制振荡周期和蓝色的深浅,以使实验达到最佳效果。
[参 考 文 献]
[1]熊言林,王闯.蓝瓶子实验最佳反应条件的探究.化学教学[J]2010,(10):16—18.

