农药多菌灵降解菌的分离及其降解效能研究
冀玉良,刘明勤,齐家乐
(商洛学院生物医药与食品工程学院,陕西商洛 726000)
目前化学农药在农业生产中的过度施用以及连作导致的土壤自净化能力的降低,致使农产品及土壤农药残留问题日益突出[1],残留农药对生态环境及人类身体健康构成巨大的威胁。多菌灵是一种氨基甲酸甲酯类杀菌剂,其化学性质稳定,半衰期较长[2-4],能够持久地残留在土壤中,过量使用不仅会改变土壤中的微生物群落结构,使土壤肥力下降,还会对土壤中的无脊椎动物造成严重危害,已有研究表明,多菌灵对人的神经细胞、生殖细胞都有毒害作用[5-6]。微生物具有强大的物质分解和转化能力,将降解特定农药的微生物引入到污染土壤中不仅能有效降低残留农药浓度,使土壤恢复健康状态,而且此方法绿色环保、不会产生二次污染。目前已有很多文献报道筛选到了一些在摇瓶发酵中对多菌灵降解能力较强的菌株,然而这些菌株在盆栽尤其是在田间试验中的降解效果并不理想[1],其原因可能与菌株不能耐受土壤复杂的生境有关。本研究采用唯一碳源富集培养和平板划线纯化法,从商州区刘湾长期使用多菌灵的蔬菜种植基地土壤中筛选对多菌灵具有高效降解能力的降解菌株,并研究其生理生化特性、生长特性和耐盐性以及不同条件对菌株降解多菌灵效果的影响,为解决土壤中农药多菌灵的残留问题提供有效功能菌和科学依据。
1 材料与方法
1.1 材料
1.1.1 样品和药剂
供试土壤样品:采自商州区刘湾长期使用多菌灵的连作蔬菜基地。
多菌灵标准品(纯度98%)和测多菌灵残留量标准试剂:购自陕西杨凌赛齐曼生物科技有限公司。
1.1.2 培养基
富集培养基:NaCl 1.000 g,K2HPO41.500 g,KH2PO40.500 g,MgSO4·7H2O 0.200 g,蒸馏水1000 mL,pH7.0~7.2,121.3 ℃灭菌 25 min。(按需要量加入多菌灵)
分离纯化培养基:NaCl 1.000 g,K2HPO41.500 g,KH2PO40.500 g,MgSO4·7H2O 0.200 g,(NH4)2SO42.000 g,琼脂 16~20 g,蒸馏水 1000 mL。(按需要量加入多菌灵)
降解试验用培养基:配方同分离纯化培养基(不含琼脂),多菌灵加入所需要的量。
牛肉膏蛋白胨培养基:NaCl 5 g,牛肉膏3 g,蛋白胨 10 g,琼脂 16~20 g,蒸馏水 1000 mL。
1.2 方法
1.2.1 多菌灵降解菌株的分离
在250 mL 装有100 mL 富集培养基(含多菌灵浓度为50 mg·L-1)的三角瓶中,加入5 g 新鲜土样,于 30 ℃ ,150 r·min-1条件下摇床培养 5 d,吸取5 mL 上清液接入100 mL 多菌灵浓度提高到100 mg·L-1的富集培养基中,于相同条件下培养5 d,如此按每次增加100 mg·L-1的多菌灵浓度进行富集培养,直至多菌灵浓度增加到600 mg·L-1。取最后一次的富集培养液进行梯度稀释,取10-8~10-10稀释度的稀释液涂布于分离纯化培养基平板上(含多菌灵浓度为 200 mg·L-1),于 30 ℃培养4 d 后,用接种针挑取形态和颜色各异、菌落比较大的菌株,在分离纯化培养基平板上进行划线分离,30 ℃培养,如此连续分离5 次得到纯种菌株,转入牛肉膏蛋白胨培养基斜面,保存于 4 ℃冰箱[7]。
1.2.2 多菌灵降解菌株的降解能力测定和筛选
多菌灵降解率的测定采用紫外分光光度法[8]。因为用单一的最大吸收波长测定多菌灵含量结果偏高,本研究引进 278、281、290 nm 三波长测定吸光度,按照多菌灵标准曲线的制作步骤,测定不同含量多菌灵的三波长校正吸光度ΔA=[A281-(A279+A290)/2],以校正吸光度ΔA 为纵坐标,多菌灵的含量为横坐标,绘制标准曲线;测定降解液校正吸光度,根据曲线的回归方程求出降解液多菌灵浓度,计算降解率。
多菌灵降解菌株的筛选,配制牛肉膏蛋白胨培养基50 mL 于250 mL 三角瓶中,接种分离菌株,在 30℃、150 r·min-1摇床培养 24 h 制好种子液。按5%的接种量分别接种种子液到装有250mL、分别含多菌灵 100 mg·L-1和 200 mg·L-1的降解培养基中,以不接菌处理作为对照,30 ℃,150 r·min-1培养5 d,取降解培养液测定校正吸光度ΔA,计算多菌灵残留浓度和降解率,筛选出多菌灵降解菌。
多菌灵降解率计算公式为Z=[(A-B)/A]×100%。式中,Z 为降解率(%);A 为未接菌降解试验用培养基中多菌灵浓度(mg·L-1);B 为接菌培养后降解试验用培养基(降解液) 中多菌灵浓度(mg·L-1)。
1.2.3 多菌灵降解菌株的形态及生化鉴定
将分离筛选到的多菌灵高效降解菌株划线接种在牛肉膏蛋白胨培养基平板,30 ℃培养48 h,观察其菌落形态,做菌体涂片进行革兰氏染色鉴定。生理生化鉴定部分参照文献[1,9]进行。
1.2.4 多菌灵降解菌的生长特性与耐盐性
1)菌株生长曲线
取保藏菌株转接斜面,30℃培养18h 复壮后,接入牛肉膏蛋白胨液体培养基摇菌管中,30℃,150 r·min-1培养16 h,至对数生长期,取出放入冰箱作为接种母液。制备100mL牛肉膏蛋白胨液体培养基,按照2%接种量接种,30 ℃,150 r·min-1摇瓶培养,定时从摇瓶中取样,测定600 nm 波长处的吸光值,以时间为横坐标,OD600为纵坐标绘制生长曲线图。
2)菌株耐盐浓度范围
取5 瓶100 mL 牛肉膏蛋白胨液体培养基,以5%的接种量接入对数期种子液,分别调节培养基含 NaCl 含量为 1%,2%,3%,4% 和 5%,30 ℃,150 r·min-1培养 28 h,从每瓶中取样,测定培养基600 nm 波长处的吸光值。以盐浓度为横坐标,OD600为纵坐标绘制生长的耐盐浓度范围图。
1.2.5 多菌灵降解菌对多菌灵的降解特性
1)温度对多菌灵降解的影响
取5 瓶100 mL 降解试验培养基,多菌灵浓度 200 mg·L-1,调节 pH 为 6.0,以 5%的接种量接入处于对数期种子液,分别在20 ℃、25 ℃、30 ℃、35 ℃、40 ℃下,150 r·min-1摇床培养,72 h 后取样检测多菌灵的降解率。
2)pH 对多菌灵降解的影响
取5 瓶100 mL 降解试验培养基,多菌灵浓度200 mg·L-1,调节初始 pH 分别为 4.0、5.0、6.0、7.0、8.0,以5%的接种量接入对数期种子液,30 ℃、150 r·min-1条件下培养,72 h 后取样检测多菌灵的降解情况。
3)接种量对多菌灵降解的影响
取5 瓶100 mL 降解试验培养基,多菌灵浓度 200 mg·L-1,调节 pH 为 6.0,分别以 1%、3%、5%、7%、9%的接种量接入对数期种子液,30 ℃、150 r·min-1条件下培养,72 h 后取样检测分析培养液中的多菌灵浓度。
4)初始浓度对多菌灵降解的影响
取5 瓶100 mL 降解试验培养基,添加不同量的多菌灵,使其浓度分别为 100、150、200、250、300 mg·L-1,调节 pH 为 6.0,按 5%的接种量接入对数期种子液,30 ℃、150 r·min-1摇床培养,每隔24 h 取样检测筛选的菌株对多菌灵的降解量。
5)外加碳源和氮源对多菌灵降解的影响
测氮源对多菌灵降解的影响时,在含多菌灵为 200 mg·L-1的 250 mL 降解试验培养基中添加1%的酵母浸粉; 测碳源影响时,在含多菌灵为200 mg·L-1的 250 mL 降解试验培养基中添加 1%的葡萄糖;同时测碳氮源的共同影响,另外以同样量不添加酵母浸粉和葡萄糖的降解试验培养基做对照(此即多菌灵为唯一碳氮源)[10-12]。按5%接种量接入对数期种子液,调节pH 为6.0,30 ℃、150 r·min-1摇床培养,每间隔 12 h 取样 1 次,检测筛选菌株对多菌灵的降解量。
1.2.6 多菌灵降解菌株耐受其他农药检测
土壤环境是复杂的,往往不只有一种农药,活的菌株能否在土壤中定殖决定于其是否能够耐受土壤复杂环境中的多重不利因素,因此进一步检测多菌灵降解菌株对氯氰菊酯(中保杀虫),百菌清(青岛奥的斯),吡虫啉(淄博新农基比巧),啶虫脒(深圳诺普信),腐霉利(江西禾益化工) 及氧化乐果 6 种农药[13]的耐受能力。配制牛肉膏蛋白胨固体培养基,待冷却至 60 ℃后按农药终浓度 0.2%分别加入各农药,混合均匀后倾制平板。在各个农药平板上划线接种多菌灵降解菌株,30 ℃培养72 h,观察菌株在平板上的生长情况。
2 结果与分析
2.1 多菌灵降解菌株的分离
经逐级富集培养、观察菌株在固体分离培养基上出现的菌落和透明圈,分离到14 株菌能够在以多菌灵为唯一碳源的培养基上生长,菌株编号分别为 D-1,D-2,D-3,…,D-14。
2.2 多菌灵降解菌株的筛选
按照制作多菌灵标准曲线的步骤,测定不同含量多菌灵的三波长校正吸光度△A,△A=[A281-(A278+A290)/2],以校正吸光度△A 为纵坐标,多菌灵的含量为横坐标,绘制标准曲线[8]。在 0~50 μg 浓度范围内,曲线的回归方程为Y=-0.00024+0.00427X(μg),Y 为校正吸光度△A,相关系数 R2=0.9991,说明本研究线性关系良好,灵敏度较高。使用此公式需对降解液进行约2000 倍稀释才能在检测有效范围内,虽然增加了稀释可能带来的误差,但可快速简便的筛选出多菌灵的高效降解菌株。
将分离到的14 株菌接入多菌灵初始浓度为100 mg·L-1的降解培养基中进行初筛,30 ℃,摇150 r·min-1下培养 5 d,测定降解液的三波长校正吸光度,代入标准曲线回归方程,计算多菌灵浓度和降解率,结果如表1 所示。从表1 中可以看出,14株菌的降解效果存在显著差异,D-1、D-4、D-6、D-7、D-9 菌株降解多菌灵的能力较强,降解率分别为69.63%、81.37%、28.35%、45.74%、53.91%。
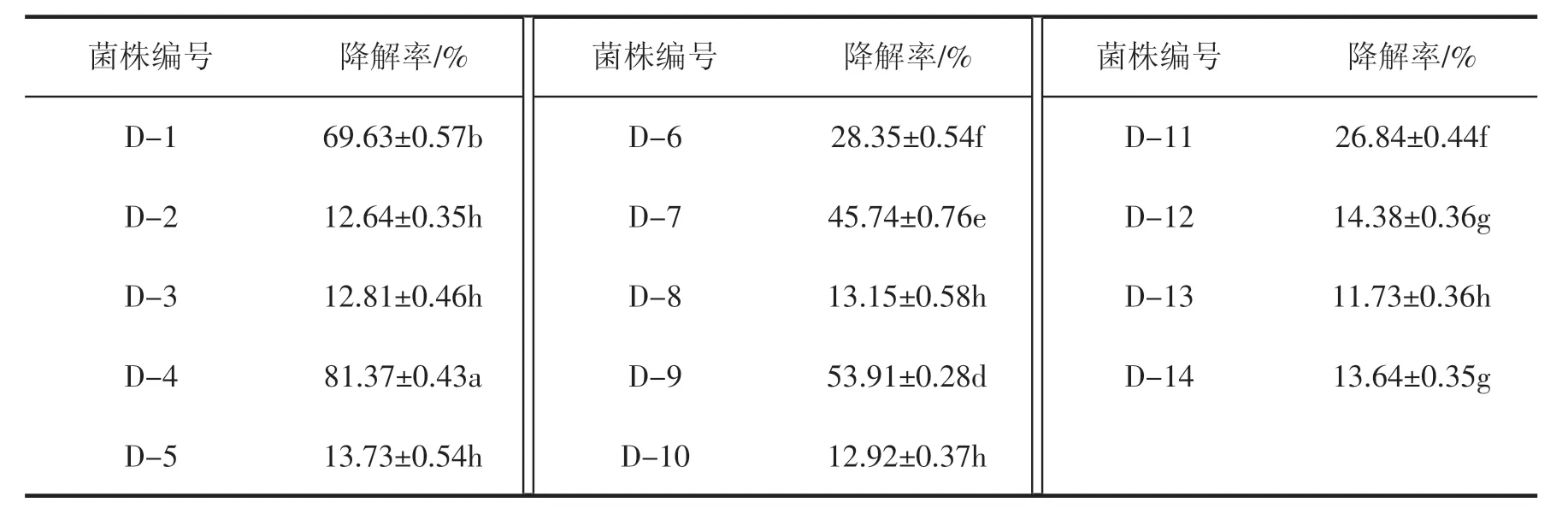
表1 初筛14 株菌对多菌灵的降解效果
再将降解多菌灵能力较强的5 株菌D-1、D-4、D-6、D-7、D-9 接种到多菌灵初始浓度为 200 mg·L-1降解培养基进行复筛,30 ℃,150 r·min-1下培养 5 d,测降解液的三波长校正吸光度计算多菌灵的降解情况,如表2 所示。从表2 可以看出,5 株菌在多菌灵浓度升高后仍具有较强的降解能力,但降解率差异显著。D-4 菌株降解率达(71.93±0.56a)%,明显强于 D-1、D-6、D-7、D-9 菌株的降解效果,D-6菌株对多菌灵的降解率最低,为(12.08±0.39e)%。对照表1 初筛测定结果还可以看出,5株菌在多菌灵为 200 mg·L-1和 100 mg·L-1的初始浓度下,对多菌灵降解率高低顺序一致。
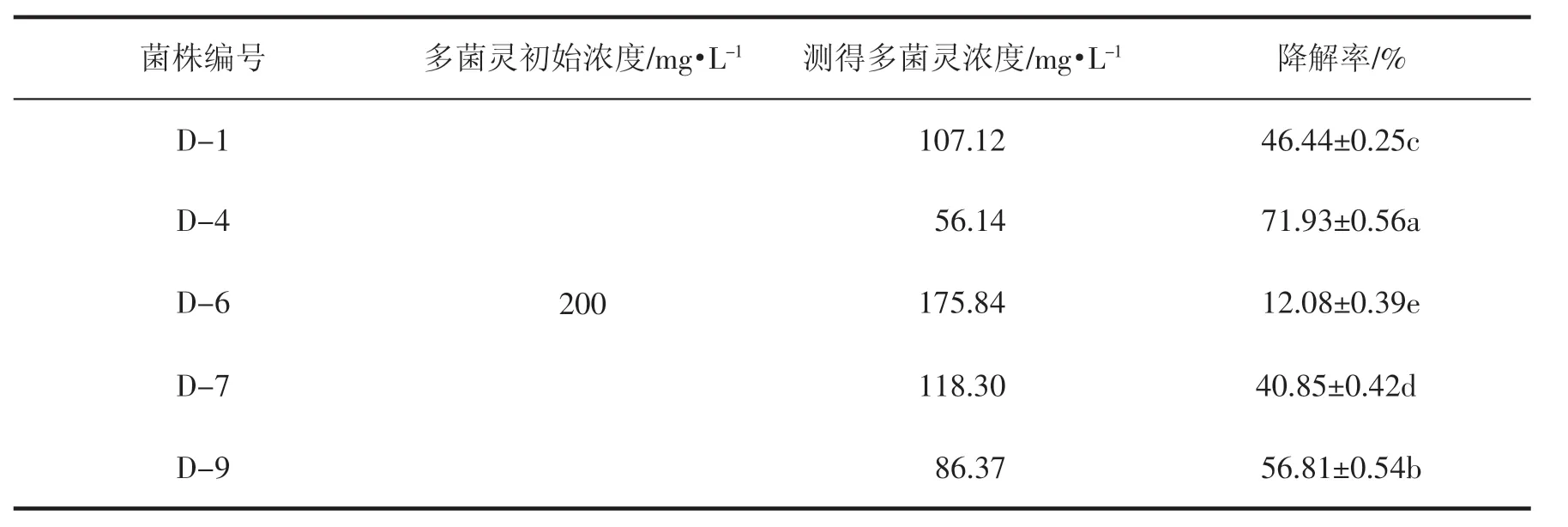
表2 复筛5 株菌对多菌灵的降解效果
2.3 多菌灵降解菌株D-4的形态及生理生化特征
将分离纯化得到的多菌灵高效降解菌株D-4接种在牛肉膏蛋白胨培养基平板上培养,其在平板培养基上生长缓慢,培养18~24 h 观察,菌落呈白色、不透明、圆形、隆起、表面光滑,湿润,边缘完整。革兰氏染色结果呈阳性。其生理生化特征见表3。从菌株的生理生化特性看,该菌呈阴性的指标较多,尤其是对有机碳源利用范围较窄,基本不利用氨基酸,这有利于它对多菌灵为唯一碳氮源的利用。另外能利用无机盐和无机氮,且能分解产生H2S 等,可能与该菌分解能力强有关。
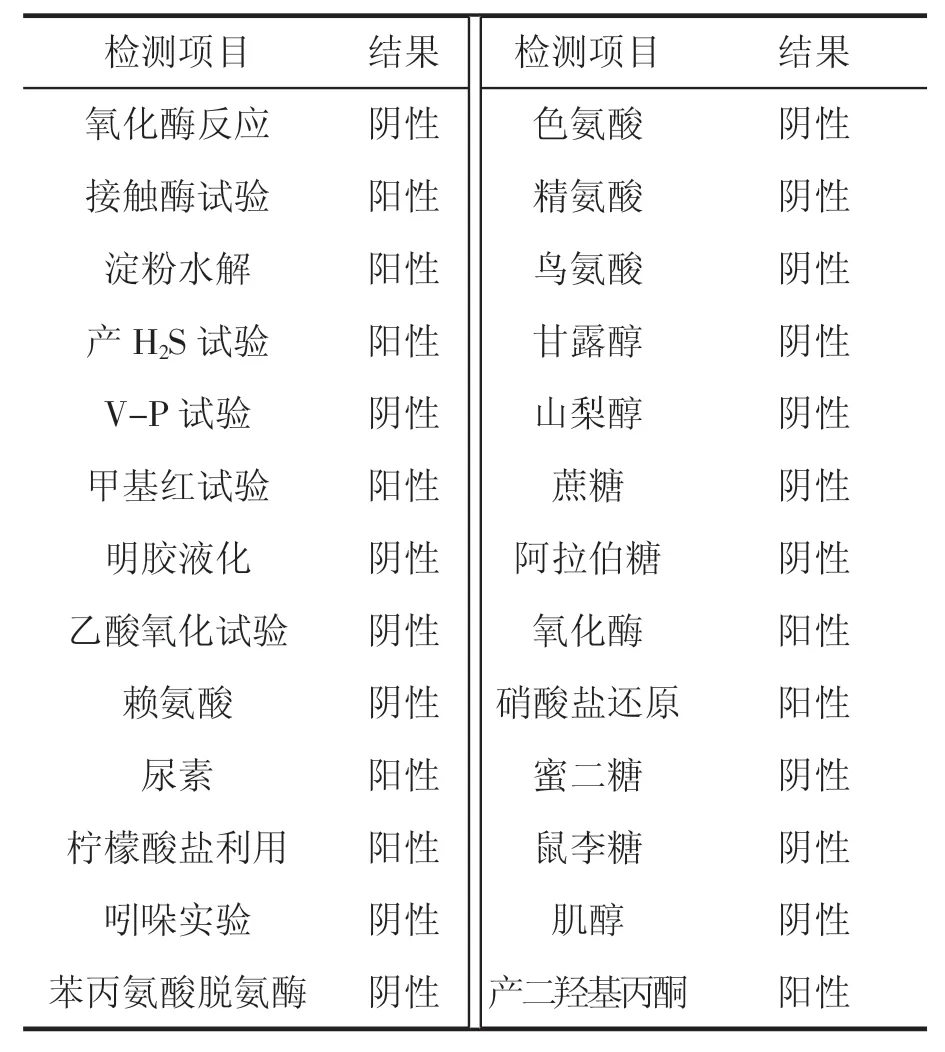
表3 菌株D-4 的生理生化特性
2.4 多菌灵降解菌D-4的生长特性和耐盐性
如图 1 和图 2 所示,D-4 菌株以 2% 接种量接种,30 ℃,150 r·min-1培养,于 16 h进入对数生长期,大约在 28 h 进入平稳期,平稳期可一直维持至 48 h。耐盐性测试表明,D-4 菌株在NaCl 浓度 1%~3%均可正常生长。
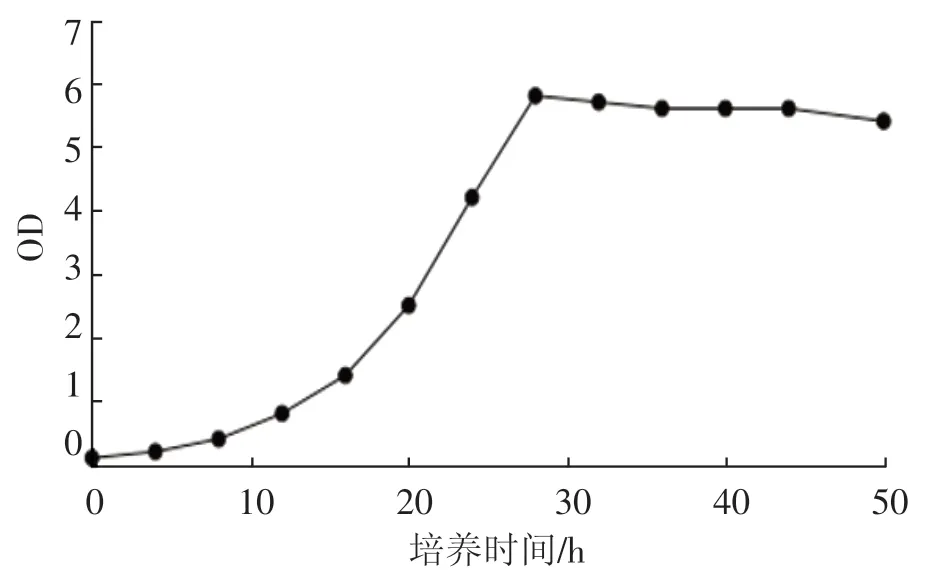
图1 D-4 菌株的生长曲线
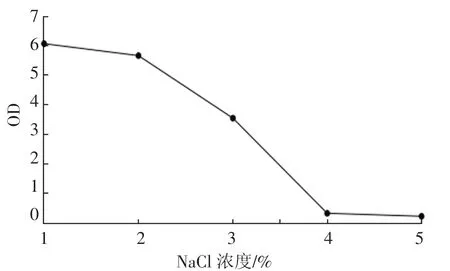
图2 D-4 菌株生长盐浓度
2.5 多菌灵降解菌D-4对多菌灵的降解特性
2.5.1 温度、 初始pH 对D-4 菌株降解多菌灵的影响
从图3 温度对D-4 菌株降解多菌灵的影响可以看出,菌株的温度适应范围较宽,在较低温度范围内,随着温度升高菌株对多菌灵的降解率一直增加,当温度增加到30 ℃时降解率达到最大值68.65%,此后随着温度的增加降解率逐渐下降,到 40 ℃时降低到 29.84%; 图 4 初始 pH 对D-4 降解多菌灵的影响结果表明,在pH 较低时,D-4 对多菌灵的降解率不高,pH 为4.0 时,降解率仅为23.71%,随着pH 增大,降解率增加明显,pH 为6.0 时降解效果最好,降解率达66.38%。但当pH 大于6 以后,D-4 对多菌灵的降解率就急剧下降,这是因为多菌灵在接近碱性的条件下溶解度减小容易析出,从而减少了降解菌株与多菌灵接触的机会。
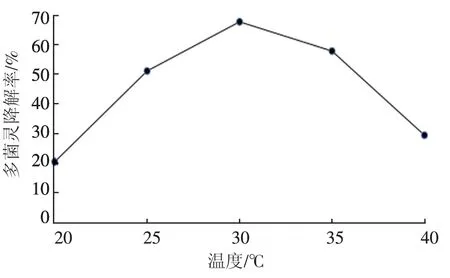
图3 温度对D-4 菌株降解多菌灵的影响
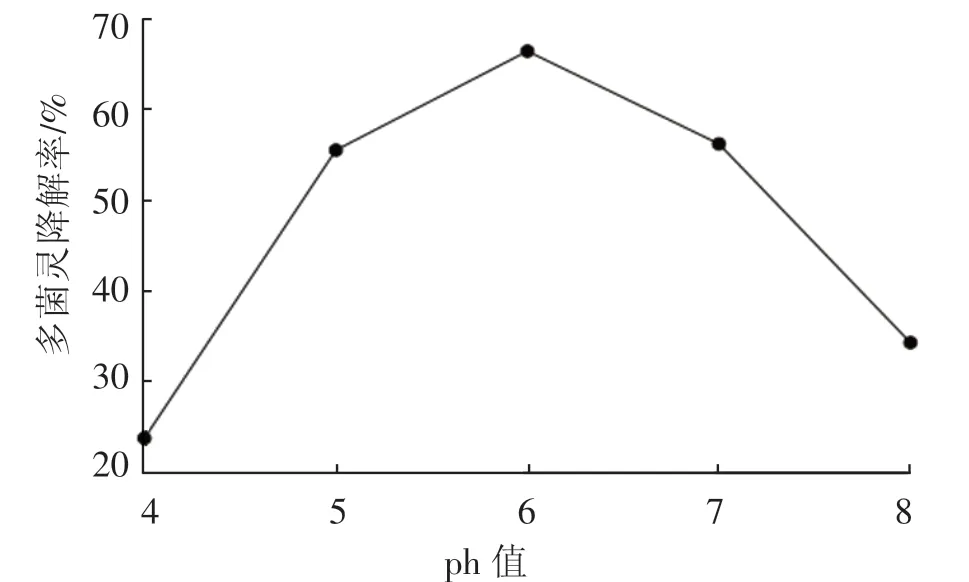
图4 pH 对D-4 菌株降解多菌灵的影响
2.5.2 接种量对D-4 菌株降解多菌灵的影响
如图5,在1%~5%的接种量范围内,D-4菌株对多菌灵的降解率随接种量的增加而增大,当接种量为5%时,其降解率达到65.82%。当接种量超过5%以后,菌株D-4 对多菌灵的降解率趋于稳定,随后渐渐降低。考虑到实际应用和经济效益,选5%的接种量降解效果最佳。
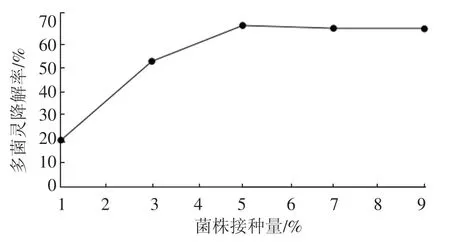
图5 D-4 菌株接种量对多菌灵降解的影响
2.5.3 初始浓度对D-4 菌株降解多菌灵的影响
图6 表明,菌株D-4 对不同浓度多菌灵都具有一定的降解效果,且浓度不同,降解效果差异较大。在多菌灵起始浓度较低时,D-4 菌株对多菌灵的降解迅速。当多菌灵浓度为100 mg·L-1和 150 mg·L-1时,测得多菌灵浓度几乎接近直线下降,120 h 后多菌灵浓度分别降至 10.63 mg·L-1和 20.57 mg·L-1,降解率分别为 89.37%和86.29%。当起始多菌灵浓度较高时,开始一段时间内,多菌灵降解较慢,特别是多菌灵浓度为300 mg·L-1时,开始70 h 内多菌灵降解很少,随后降解开始明显增加。可见随着多菌灵浓度的增大,菌株D-4对多菌灵的降解受到抑制或者需要较长一段的适应期。120 h 后,200、250、300 mg·L-1的多菌灵分别降至 35.64、94.31、140.57 mg·L-1,降解率分别为82.18%、62.28%和53.14%。
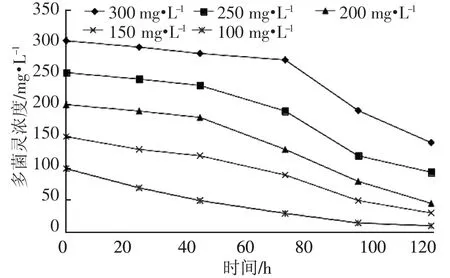
图6 初始多菌灵浓度对菌株降解多菌灵的影响
2.5.4 外加碳源、氮源对D-4 菌降解多菌灵的影响
如图7,在以多菌灵为唯一碳氮源的对照培养中,84 h 后多菌灵浓度从 200 mg·L-1降至55.83 mg·L-1,降解率为 72.09%。而以多菌灵为唯一氮源,补加葡萄糖作碳源、以多菌灵为唯一碳源,补加酵母浸粉为氮源和在同时添加葡萄糖和酵母浸粉的情况下,多菌灵浓度由200 mg·L-1分别降至 32.65、26.34、19.17 mg·L-1,降解率分别为83.68%、86.83%和90.42%,较对照分别提高了11.59%、15.26%和18.33%。由此可见,葡萄糖和酵母浸粉对多菌灵的降解有显著的促进作用。
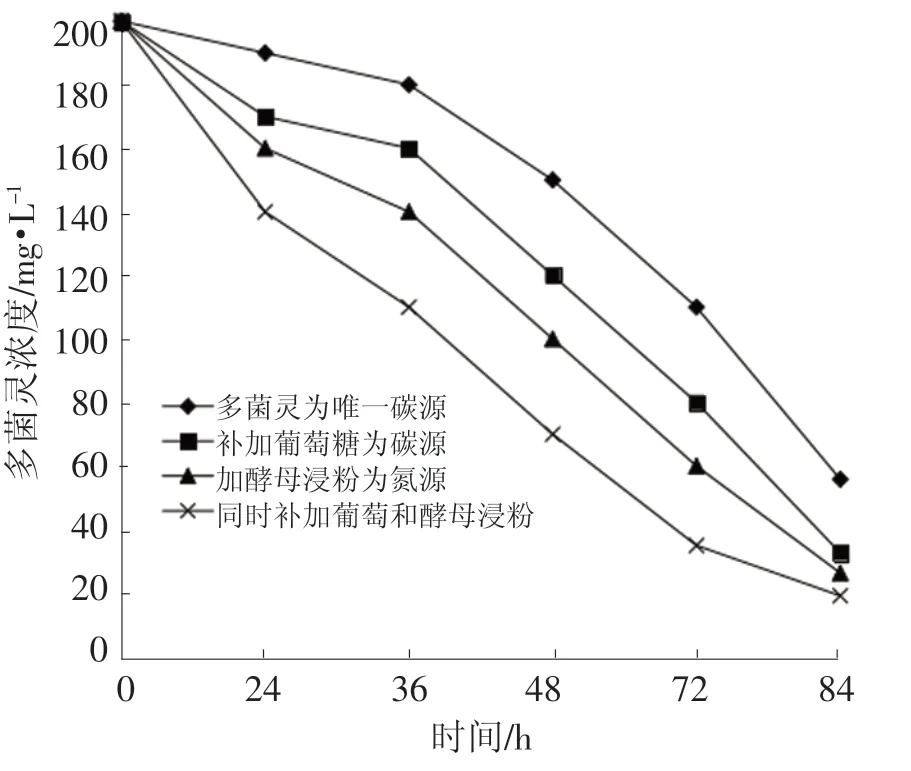
图7 碳源和氮源对菌株降解多菌灵的影响
2.6 多菌灵降解菌株D-4对其他农药的耐受性
考虑到土壤环境的复杂性,它往往不只有一种农药,活的菌株能否在土壤中定殖决定于其是能够耐受土壤复杂环境中的多重不利因素,因此本研究进一步检测了多菌灵降解菌株对氯氰菊酯(中保杀虫),百菌清(青岛奥的斯),吡虫啉(淄博新农基比巧),啶虫脒(深圳诺普信),腐霉利(江西禾益化工)及氧化乐果 6 种农药的耐受能力。结果表明,多菌灵降解菌株D-4 还可以分别在浓度为 0.2%的百菌清、氯氰菊酯、啶虫脒、腐霉利、吡虫啉及氧化乐果 6 种农药平板上生长,对这些农药具有一定耐受性。土壤环境是复杂的,可能有多重不利因素,尤其是长期连作棚室土壤,往往不只使用一种农药。所以该菌株的多重适应性是其实际应用的重要基础。
3 结论和讨论
本研究从商州区刘湾长期使用多菌灵的连作蔬菜基地土壤中分离到14 株能以多菌灵作为唯一碳氮源生长的多菌灵降解菌株,筛选出的菌株D-4 对多菌灵具有高效降解能力,在含多菌灵100mg·L-1和200mg·L-1的基础盐培养基中培养 5 d,对多菌灵降解率分别可达到81.37%和71.9 3%。该菌株生长和降解多菌灵的盐浓度、pH 和温度范围比较宽泛,最适条件为 pH 值 6.0,温度 30 ℃,接种量5%。初始多菌灵浓度越高,开始时菌株D-4对多菌灵降解率越低,但随着时间延长,降解率逐步升高。添加少量葡萄糖、酵母浸提液作额外碳氮源时可促进菌株 D-4 对多菌灵的降解,与不添加额外碳氮源相比降解率提高了18.33%。研究还发现该菌株对农业上常用的其他6 种农药氯氰菊酯,百菌清,吡虫啉,啶虫脒,腐霉利及氧化乐果也具有耐受性。研究结果表明菌株D-4 在农药污染土壤修复方面具有广阔的应用前景。
根据同类研究报道,采用的农药初始浓度和培养时间不同,筛选出的降解菌对多菌灵的降解效率差异较大,大部分降解菌对低浓度多菌灵都具有较好的降解效果,但在高浓度条件下,降解率则显著降低[13-15]。本研究也发现相同的现象,初始多菌灵浓度越高,开始时菌株D-4 对多菌灵降解率越低,但不同的是,随着时间延长,菌株D-4对多菌灵的降解率就会逐步升高。这一现象说明,在高浓度的多菌灵条件下,菌株有一段相对较长时间的适应期,经过这一段时期后,细胞内诱导出了更多的降解酶,因此降解率也能达到较高水平,这说明降解菌D-4 降解多菌灵的能力是可以驯化提高的,这也是本研究中采取逐级富集驯化培养来分离筛选多菌灵降解菌的根据。该现象对实际污染土壤的修复也有重要启示:即应在土壤中多菌灵残留不多的情况下就接种降解菌进行修复,因为多菌灵残留浓度越高,就需要更长时间才能降解。
与初始多菌灵浓度相联系,菌株的接种量也要达到一定量的要求,才能提高多菌灵的降解率[16-17]。本研究中,当多菌灵含量为200 mg·L-1时,菌种接种量为 5%,pH 值为 6.0,30 ℃,150 r·min-1条件下培养72 h,降解率比其他接种量都高,达到65.82%。
农业生产环境是一个复杂的生态系统,存在着水肥营养因素、其他微生物的相互影响和其他各种类型的农药残留,其土壤 pH、 温度及土壤盐分也发生着周期性变化。因此在多菌灵降解菌的筛选和研究开发中,需要进一步研究功能菌对其他各种微生物和其他类型农药的耐受性[18]。从报道看,部分研究筛选的菌株对发挥生物学作用的条件要求也较为苛刻,所以需要筛选能满足大田粗放条件下的高效降解菌株。
目前已发现具有降解多菌灵能力的微生物涵盖了细菌、真菌及放线菌,其中以变形菌纲微生物居多[19-20]。本研究对筛选到的降解菌将进一步用16S rDNA 序列分析鉴定,以确定其种属和发育地位,进一步进行理论研究,同时开展应用研究,将筛选到的高效降解菌株应用到污染土壤的修复中。

