瑞德西韦与α-干扰素联用治疗新型冠状病毒肺炎的可行性分析*
田成,向明
(华中科技大学同济医学院药学院生物药学系,武汉 430030)
2020年1月27日,美国遵循同情用药(compassionate use)的原则,用瑞德西韦(remdesivir)治疗美国首例新型冠状病毒肺炎(WHO命名为COVID-19)重症患者。次日,患者的临床症状得到明显改善[1]。体外实验表明瑞德西韦可有效抑制新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)的感染[2]。尽管氯喹、达芦那韦、阿比多尔和洛匹那韦/利托那韦等药物在体外实验中也显示对SARS-CoV-2具有抑制作用[2],但均无任何临床数据证明氯喹和达芦那韦具有改善COVID-19的作用。此外,最近一篇报道回顾性分析2020年1月20日—2月6日上海市公共卫生临床中心收治134例COVID-19患者的临床资料,发现洛匹那韦/利托那韦和阿比多尔并未改善患者临床症状和加快病毒清除,反而增加不良反应[3]。因此,瑞德西韦可能是目前最具潜力的治疗COVID-19的抗病毒药。
由于多数COVID-19患者免疫功能降低,推测提高机体抗病毒免疫力或可有效增强抗病毒药对SARS-CoV-2的抑制作用。广东1例COVID-19女性患者在联合干扰素吸入治疗后,胸部CT显示患者的症状明显好转[4]。2003年严重急性呼吸综合征(severe acute respiratory syndrome,SARS)治疗方案和最新版《新型冠状病毒肺炎诊疗方案(试行第七版)》均提及免疫增强剂α-干扰素(interferon α,IFN-α)与抗病毒药的联合使用[5-6]。因此,推测瑞德西韦和IFN-α联合使用或可有效治疗COVID-19。笔者在本文从流行病学、病毒学以及药理学方面详细分析两药联合治疗COVID-19的理论基础。
1 COVID-19现状与病毒特征
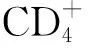
1.2SARS-CoV-2病毒的特征 SARS-CoV-2属于嵌套病毒目、冠状病毒科、β冠状病毒属[1,11]。冠状病毒(coronavirus,CoV)是最大的一种正链RNA病毒,直径约为125 nm,基因组长度为26~32 kb,至少包括刺突、包膜、膜、核衣壳蛋白4种主要结构蛋白[12]。冠状病毒包括4个属:α、β、γ和δ冠状病毒。目前已确认7种可引起人类疾病的冠状病毒:HCoV-NL63、HCoV-229E、HCoV-OC43、HCoV-HKU1、SARS-CoV、MERS-CoV和SARS-CoV-2,前2种属于α冠状病毒属,后5种属于β冠状病毒属。研究对SARS-CoV-2的基因组序列进行了生物信息学分析,发现其与SARS-CoV和MERS- CoV分别具有约80%和50%的核苷酸同一性[13-14]。比较SARS-CoV-2与SARS-CoV的核衣壳蛋白和刺突蛋白的氨基酸序列,结果显示分别具有约90%和75%的氨基酸同一性。
2 瑞德西韦
2.1瑞德西韦的发现和药理作用 瑞德西韦是1'-氰基取代的腺苷核苷酸类似物前体药物,是吉利德(Gilead)公司针对埃博拉(Ebola)病毒筛选设计的一种抗病毒药,结构见图1。为抑制埃博拉病毒,吉利德公司筛选约1000个核苷类似物,并通过一系列结构优化,最终设计合成瑞德西韦[15-16]。瑞德西韦中氨基酸酯结构有助于其渗透到细胞中,促进其吸收[16]。瑞德西韦在感染细胞内经分解、磷酸化为三磷酸类似物后发挥抗病毒作用[17]。
除抗埃博拉病毒外,瑞德西韦还被发现具有抗SARS-CoV、MERS-CoV、小鼠肝炎病毒、尼帕(Nipah)病毒等多种病毒的作用[18-21]。Sheahan团队发现瑞德西韦在体外可明显抑制SARS-CoV和MERS-CoV在人肺气道上皮细胞HAE内复制[21];在SARS-CoV感染小鼠以及MERS-CoV感染小鼠和恒河猴中,瑞德西韦预防性和治疗性给药均明显改善肺功能、减少肺病毒载量和减轻肺部损伤[20-22]。体外实验表明,瑞德西韦抗MERS-CoV活性优于洛匹那韦和利托那韦[20]。
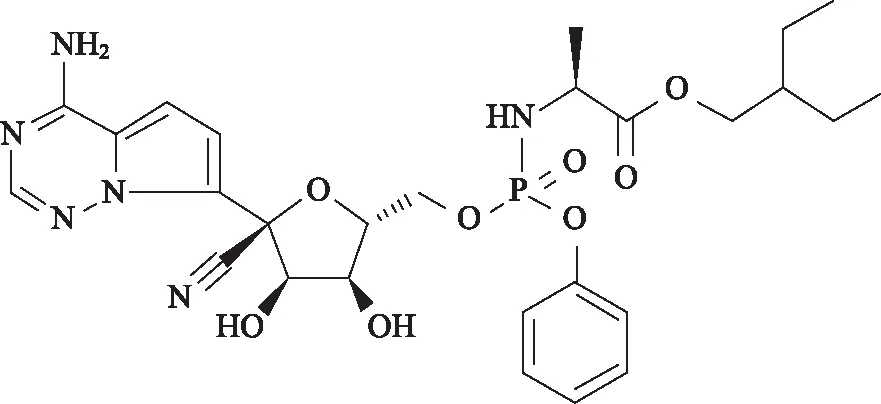
图1 瑞德西韦结构式
2.2瑞德西韦用于COVID-19的可行性分析 COVID-19与SARS和MERS的症状和病理特征十分相似[9],对三者病原体的基因组序列进行比对,发现三者具有一定同源性,尤其是SARS-CoV-2与SARS-CoV[13-14]。由于瑞德西韦具有抑制包括SARS-CoV和MERS-CoV在内的多种冠状病毒的作用,并改善SARS-CoV和MERS-CoV感染动物的肺部症状和减少肺部病毒载量[18-22]。因此推测瑞德西韦或可用于COVID-19的治疗。
2020年1月,美国出现首例COVID-19患者。该患者在出现症状(咳嗽、发烧)4 d后住院,在住院第2~5天给予对乙酰氨基酚、布洛芬和愈创甘油醚治疗。住院第5天晚上患者症状加重,第6天给予万古霉素和头孢吡肟治疗,但并无好转。住院第7天晚上医生遵循同情用药的原则,静脉注射尚处于研究阶段的抗埃博拉病毒药瑞德西韦,并停用万古霉素,第8天停用头孢吡肟。住院第8天,患者各项临床症状均得到明显改善[1]。随后,武汉病毒学研究所进行体外实验,发现瑞德西韦在体外可显著抑制SARS-COV-2。在此实验中,瑞德西韦对感染SARS-COV-2的Vero E6细胞的半数效应浓度(EC50)为0.77 μmol·L-1,半数细胞毒性浓度(CC50)大于100 μmol·L-1,选择性系数(SI)大于129.87[2]。
瑞德西韦作为一种核苷类似物,可通过延迟的链终止机制抑制多种病毒[17,23-24]。瑞德西韦可被RNA依赖的RNA聚合酶(RdRp)识别,渗入病毒基因组的合成,阻止磷酸二酯键形成,进而终止RNA链的合成,抑制病毒复制。除了与三磷酸腺苷(ATP)竞争RdRp,瑞德西韦还可抑制发挥校正作用的核糖核酸外切酶,阻断病毒的复制,进而发挥抑制病毒的作用[18,25]。瑞德西韦结构上1'-氰基可使其选择性地作用于病毒RdRp,因此可抑制病毒复制,但对人RNA合成无明显影响[17,26]。尽管缺乏针对COVID-19的动物实验和临床试验数据,但上述研究仍表明瑞德西韦具有治疗COVID-19的强大潜力。瑞德西韦用于埃博拉病毒感染治疗的Ⅰ期和Ⅱ期临床试验已完成,未发现其有明显不良反应[26]。瑞德西韦目前已进入COVID-19治疗的Ⅲ期临床试验,但尚无文献报道。
3 α-干扰素
3.1干扰素 干扰素(interferon,IFN)是哺乳动物宿主抵抗病原体过程中分泌的一种细胞因子,具有抗病毒、免疫调节、抗菌、抗肿瘤等多方面作用[27-30]。目前已知人体产生的干扰素共有13种,可分为Ⅰ型、Ⅱ型、Ⅲ型3类[31]。Ⅰ型干扰素[主要包括IFN-α、β干扰素(IFN-β)]也被称为“病毒干扰素”,主要由先天性免疫细胞分泌,具有广谱抗病毒作用。Ⅱ型干扰素(IFN-γ),也被称为“免疫干扰素”,主要由活化的T细胞和自然杀伤(NK)细胞分泌,具有免疫调节作用。Ⅲ型干扰素(IFN-λ),主要由上皮细胞分泌,具有免疫调节和抗病毒作用[32]。
3.2IFN-α的作用及机制 IFN-α对RNA病毒和DNA病毒都有抑制作用,但并不直接杀伤或抑制病毒[27]。其抗病毒的作用机制主要包括:(1)IFN-α通过与细胞表面的干扰素受体结合,激活细胞内多条信号通路,促进细胞合成分泌的黏病毒抗性蛋白MxA、2',5'-腺苷酸激酶等多种抗病毒蛋白(antivirual protein,AVP),AVP通过抑制病毒基因和蛋白合成、阻止病毒组装和释放等多条途径发挥抗病毒作用[33-36]。(2)IFN-α可激活多种先天性免疫细胞,增强机体的免疫功能,进而发挥抗病毒作用。例如:①促进树突状细胞表面和功能激活,进而促进T细胞的激活,增强细胞免疫,抑制病毒[37-38];②募集单核细胞,并促进其向巨噬细胞分化[39];③募集NK细胞,并促进后者分泌Ⅰ型干扰素,形成正反馈,进而增强NK细胞的抗感染作用[40];④促进B细胞增殖,增强体液免疫,产生抗体中和病毒[41]。
除了具有抗病毒功能,IFN-α还可抑制导致组织病理损伤的炎性免疫应答[28]。DUERR等[42]证实IFN-α可抑制固有淋巴细胞分泌2型细胞因子,进而改善2型细胞因子增多导致的组织损伤。多项研究表明IFN-α可通过抑制病毒感染时上皮细胞分泌的CXCL1和CXCL2,抑制中性粒细胞募集至感染部位[39,43-44],进而抑制炎性组织损伤。因此,IFN-α既可抑制病毒复制,也可改善病毒感染所致的炎性症状。
除上述功能外,IFN-α还被发现具有抗肿瘤作用,且重组IFN-α2已被美国食品药品管理局(FDA)批准用于癌症的免疫治疗[45-47]。
3.3IFN-α用于COVID-19的可行性分析 IFN-α已被证明对MERS和SARS均有改善作用。动物实验和临床数据都表明IFN-α与利巴韦林联用可有效抑制MERS-CoV的复制、改善MERS症状和临床结局[48-49]。IFN-α也被证明可抑制SARS-CoV,改善患者症状[50-52]。在糖皮质激素的基础上,加用IFN-α1可以恢复SARS患者氧饱和度水平和血清中肌酸激酶与乳酸脱氢酶水平(血清中乳酸脱氢酶和肌酸激酶水平升高提示肺实质损伤,并与预后不良有关),改善肺部损伤[52]。由于SARS-COV-2与MERS-CoV和SARS-CoV均属于β属冠状病毒,而IFN-α具有广谱抗病毒作用,此外还可抑制感染部位的炎症反应[34-44],因此,预测IFN-α可有效抑制SARS-COV-2,并改善感染患者的症状。这一预测被最近的循证医学报道所证明[31],该篇报道表明皮下注射IFN-α的早期使用可有效改善COVID-19患者症状。
4 瑞德西韦与IFN-α联用治疗COVID-19分析
病毒攻击引起全身性炎症反应,进而导致“细胞因子风暴”,是COVID-19致死或组织严重损伤的重要原因。减轻COVID-19造成的不良后果主要分为两个阶段:①在发展为重症之前,以抗病毒治疗为主,及时控制患者体内的SARS-COV-2,防止疾病发展为重症;②当患者为重症或危重症时,以控制炎症反应为主,辅以抗病毒治疗,减轻“细胞因子风暴”所致损伤。
瑞德西韦是一种靶向病毒的广谱抗病毒药,而IFN-α是一种提高宿主抗病毒免疫力的广谱抗病毒药,二者通过不同的作用机制发挥抗病毒作用,联合使用可能提高抗病毒疗效。IFN-α抑制病毒感染部位的炎症反应,有效改善病毒性肺炎的症状,减轻肺部损伤。而瑞德西韦只具有抗病毒作用,不具备抗炎作用。因此,二者联合使用,既可抑制病毒复制,也可改善患者的肺部炎症。
对于COVID-19轻型或普通型患者,IFN-α与抗病毒药瑞德西韦联用可发挥更强的抗病毒效应,在短期内迅速控制病毒感染,抑制疾病进一步发展为重症甚至危重症,减轻疾病不良后果。两药联用还可显著缩短病程,减少瑞德西韦的使用,进而减轻可能的药物不良反应。对于COVID-19重症和危重症患者,需要使用糖皮质激素抑制肺部炎症,减轻肺部损伤。但糖皮质激素可抑制机体免疫功能、延缓病毒的清除[53],导致骨坏死等不良反应[54]。IFN-α则可能减轻糖皮质激素造成的抗病毒免疫力降低和激素过度使用所致的不良反应。
根据瑞德西韦的药动学研究,快速静脉滴注可有效提高细胞内瑞德西韦活性代谢产物GS-443902水平。GS-443902在外周血单个核细胞内的半衰期超过35 h,提示每日单次给予瑞德西韦[26]。鉴于暂无报道介绍瑞德西韦治疗冠状病毒感染疾病的临床用药剂量,笔者依据瑞德西韦用于埃博拉病毒感染疾病的Ⅱ期临床试验中的剂量[55]。为迅速提高细胞内GS-443902水平以及瑞德西韦的效应,可选择快速静脉滴注(30 min内),每日单次给药,首剂加倍(成人200 mg),次日开始接受维持剂量(成人每次100 mg)。基于《新型冠状病毒肺炎诊疗方案(试行第七版)》,COVID-19患者每日2次雾化吸入IFN-α(成人每次500万U)[6]。对于普通型COVID-19患者,瑞德西韦与IFN-α可根据患者情况适当减量,但用药频次不变;对于重症型与危重症型COVID-19患者,瑞德西韦与IFN-α均应足量,并在此基础上根据患者情况加用糖皮质激素。
5 讨论
COVID-19发病迅速,传染性强。尽管《新型冠状病毒肺炎诊疗方案(试行第七版)》根据临床经验和前期研究给出推荐治疗药物,并显示一定疗效,但存在较多不良反应[3,6]。例如,洛匹那韦/利托那韦可导致肝功能损伤、腹泻等不良反应;利巴韦林可导致变态反应、消化道和血液系统不良反应,不良反应发生率超过10%[56-57]。因此需要探索疗效更好、副作用更少的药物。由于新药研发通常需要长达数年的研究,耗时耗力,无法解决当下问题。因此,需要对现有药物进行筛选以及根据已有研究和临床数据选择更合适的抗病毒药。
前期研究表明瑞德西韦作为一种靶向病毒的抗病毒药,体外具有抑制SARS-COV-2的作用[2]。IFN-α可显著提高机体的抗病毒免疫,并抑制感染部位的炎症。二者联合用于COVID-19的治疗具有多重优势。第一,可增强抗病毒疗效,早期用药可抑制疾病发展;第二,可缩短疾病病程,减少瑞德西韦的使用,减轻不良反应;第三,IFN-α可抑制感染部位炎症,改善肺部症状;第四,减少重症患者糖皮质激素的使用量,减轻其引起所造成的不良反应。本文从理论上对瑞德西韦与IFN-α联合治疗COVID-19的可行性进行分析,为COVID-19的临床用药提供理论依据。

