纤维素酶辅助提取藕节多糖工艺优化及其动力学、热力学研究
王占一,赵 静,朱天顺,胡锦钢,赵春林,向 兰
(1.枣庄学院食品科学与制药工程学院,山东 枣庄 277160;2.山东大学药学院,山东 济南 250012)
莲Nelumbo nuciferaGaertn.为睡莲科莲属水生植物,其干燥根茎节部入药,称为藕节,2015 年版《中国药典》 也有收载[1],具有收敛止血、清热凉血、通便止泻、健脾益气之功效,用于治疗肺结核咯血、胃出血、鼻出血、吐血、便血等病症。近年来,国内外学者发现藕节中含有大量多酚、生物碱、多糖,其中多糖类成分已引起广泛关注[2-3]。
在天然活性成分的提取过程中,水酶法提取是将生物酶作为一种生物催化剂来破坏植物细胞壁结构,提高细胞膜、细胞壁通透性,降低底物传质阻力,加快细胞中活性物质溶出,该方法操作安全,易于控制,提取效率高,已在生产实践中得到大量应用[4-9]。
天然活性成分从实验材料到提取介质中的溶出过程比较复杂,会受到各种因素的影响,但其本质都是溶质从物料的固相到溶剂的液相转运过程。一般认为,有效成分从物料内部到物料表面扩散的过程是控制该步骤的关键[10],但纤维素酶法提取多糖类成分时溶质转运过程的动力学、热力学研究尚未见报道。本实验采用响应面法优化纤维素酶辅助提取藕节多糖工艺,通过Fick 扩散公式、Van’t Hoff 方程分析该成分从材料固相到溶剂液相传递过程中的动力学、热力学,为工业化生产提供技术参考,也为药材资源开发利用提供理论依据。
1 材料
藕采自微山湖,手工取其根茎节部后洗净、烘干,经枣庄学院闫志佩教授鉴定为正品。TU-1800SPC 型紫外-可见分光光度计(上海普析通用仪器有限公司);ALC-1104 型电子天平(北京赛多利斯仪器系统有限公司);GZX-9240MBE 型电热恒温鼓风干燥箱(上海博讯实业有限公司医疗设备厂);RE-2000A 型旋转蒸发器(上海亚荣生化仪器厂);HH-6 型数显恒温水浴锅(常州国华电器有限公司)。葡萄糖对照品(纯度>98%,批号110833-201805)购自中国食品药品检定研究院;纤维素酶(酶活性≥20 000 U/g)购自郑州宇控生物科技有限公司。3,5-二硝基水杨酸、无水乙醇、碳酸钠、浓硫酸、苯酚、抗坏血酸、磷酸盐等试剂均为分析纯,购自天津市天力化学试剂有限公司。
2 方法与结果
2.1 多糖含有量测定 采用苯酚-硫酸法[11-12]测定总糖含有量。将D-无水葡萄糖干燥至恒重后精密称取50 mg,小烧杯溶解,置于容量瓶中定容至100 mL,作为葡萄糖贮备液,依次稀释成10、20、30、40、50、60、70 μg/mL,以蒸馏水为对照,各量取1 mL 置于10 mL 具塞试管中,加入5%苯酚溶液0.5 mL,充分振摇后再滴加5.5 mL 浓硫酸,混合均匀,室温下静置30 min,于490 nm 波长处测定吸光度。以吸光度为纵坐标(A),溶液质量浓度为横坐标(X)进行回归,得方程为A=0.079 2X-0.005 5(r=0.999 5),在1.43~10 μg/mL范围内线性关系良好。
采用DNS 显色法[13-14]测定还原糖含有量。精密量取0.5 mg/mL 葡萄糖溶液0.1、0.2、0.4、0.6、0.8、1.0 mL 于试管中,蒸馏水补至1.0 mL,加入2.0 mL 3,5-二硝基水杨酸(DNS)显色剂,沸水浴5 min,冷却,蒸馏水补至10 mL 后于540 nm波长处测定吸光度。以吸光度为纵坐标(A),溶液质量浓度为横坐标(X)进行回归,得方程为A=0.017 2X-0.186 2(r=0.999 3),在5~50 μg/mL 范围内线性关系良好。
再计算总糖含有量与还原糖含有量的差值,即为多糖含有量。
2.2 多糖得率测定 精密称取粉碎至40 目的藕节粉末5.0 g,置于三颈圆底烧瓶中,加入纤维素酶至设定加酶量,加入一定pH 值磷酸盐缓冲液使料液比达到设定值,酶解反应到设定时间,其间温度保持恒定。提取结束后,将提取物转移至烧杯中,沸水浴灭酶10 min,抽滤,定容至250 mL,作为供试品溶液,计算多糖得率,公式为多糖得率=(多糖含有量/药材质量)×100%。
2.3 单因素试验 本实验考察了加酶量(0.2%、0.4%、0.6%、0.8%、1.0%、1.2%)、料液比(1∶8、1∶12、1∶16、1∶20、1∶24、1∶28)、介质pH(2、3、4、5、6、7)、酶解温度(20、30、40、50、60、70 ℃)、酶解时间(1.0、1.5、2.0、2.5、3.0、3.5 h)对多糖得率的影响,将其中1 个作为单因素时,其他4 个分别固定为加酶量0.8%、料液比1∶20、介质pH 5、酶解温度50 ℃、酶解时间2.5 h。
2.3.1 加酶量 图1 显示,当加酶量为0.2%~0.8%时,多糖得率随着其增加而升高;超过0.8%后,逐渐趋于平缓,表明已达到饱和状态,考虑到生产成本,确定加酶量在0.8%左右。
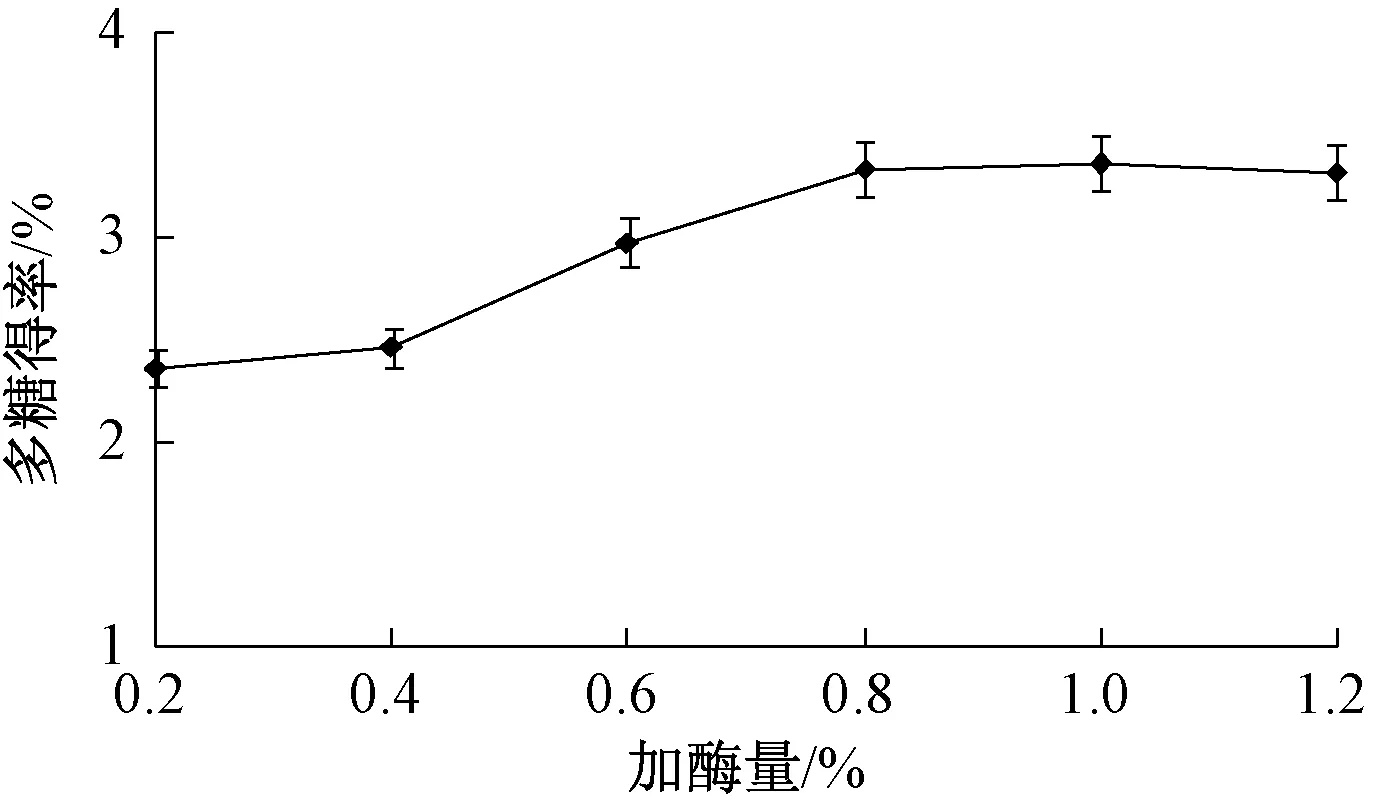
图1 加酶量对多糖得率的影响Fig.1 Effect of enzyme consumption on polysaccharides yield
2.3.2 料液比 图2 显示,随着提取溶剂用量增加,多糖得率呈先升后降的趋势,当料液比为1∶20时达到最大值,其原因是提取溶剂用量较大时有利于溶质从固相向溶剂相转移,加速多糖溶出,得率也随之提高;超过1∶20 后,由于后期处理过程中有损耗,导致多糖得率不升反降,故确定料液比在1∶20 左右。
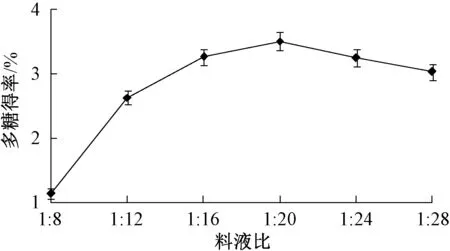
图2 料液比对多糖得率的影响Fig.2 Effect of solid-liquid ratio on polysaccharides yield
2.3.3 介质pH 图3 显示,随着介质pH 升高,多糖得率呈先升后降的趋势,在5 时达到最大值,其原因是磷酸盐缓冲液pH 值对生物酶的影响较大,大于或小于最适pH 值都会降低后者活性,故选择介质pH 在5 左右。

图3 介质pH 对多糖得率的影响Fig.3 Effect of medium pH on polysaccharides yield
2.3.4 酶解温度 图4 显示,当酶解温度为20~50 ℃时,多糖得率随着其增加而逐渐升高,在50 ℃时达到最大值;超过50 ℃后,多糖得率呈降低趋势,其原因是酶解温度过高时生物酶活性受到抑制,不能充分发挥作用,导致其得率降低,故确定酶解温度在50 ℃左右。
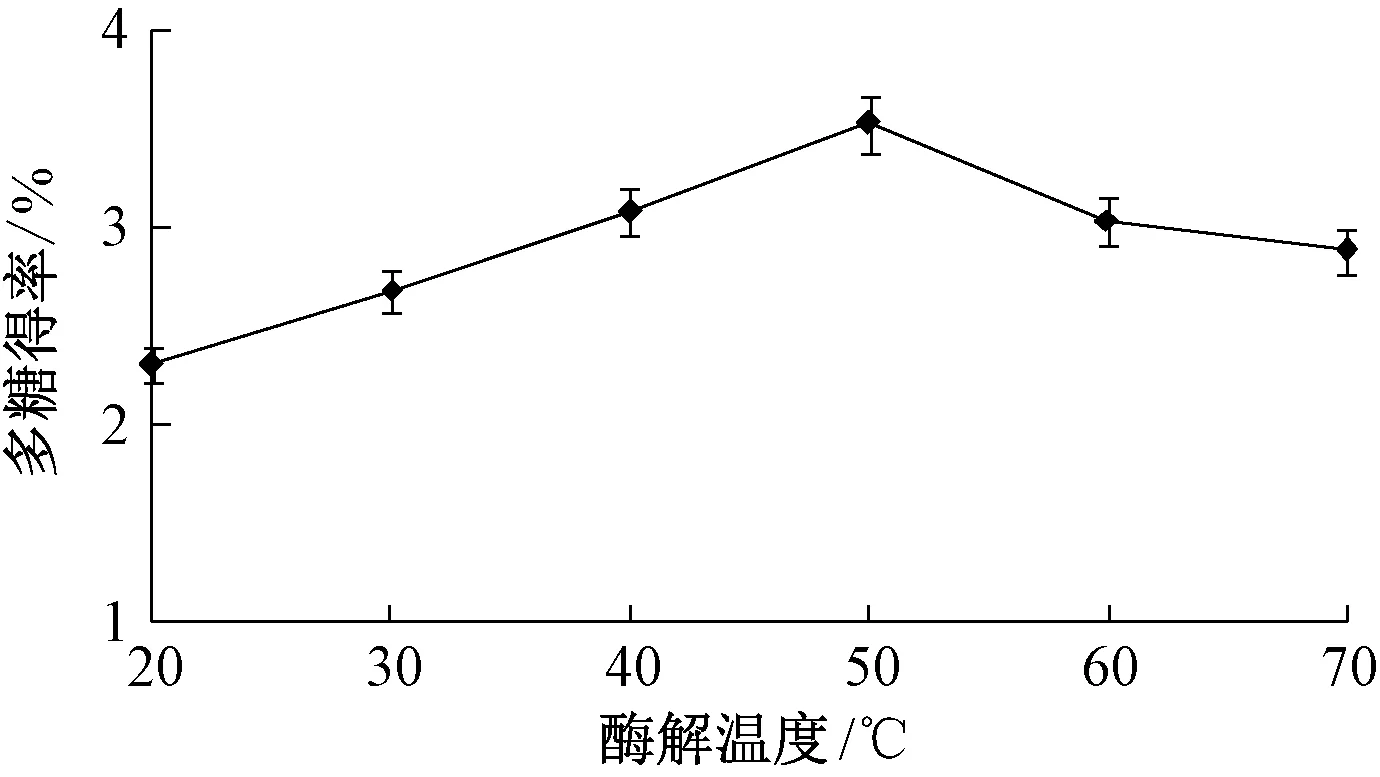
图4 酶解温度对多糖得率的影响Fig.4 Effect of enzymolysis temperature on polysaccharides yield
2.3.5 酶解时间 图5 显示,当酶解时间为1.0~2.5 h 时,多糖得率随着其延长而逐渐升高,在2.5 h 达到最大值;超过2.5 h 后,多糖得率几乎不再提高,考虑到实际生产,确定酶解时间在2.5 h左右。
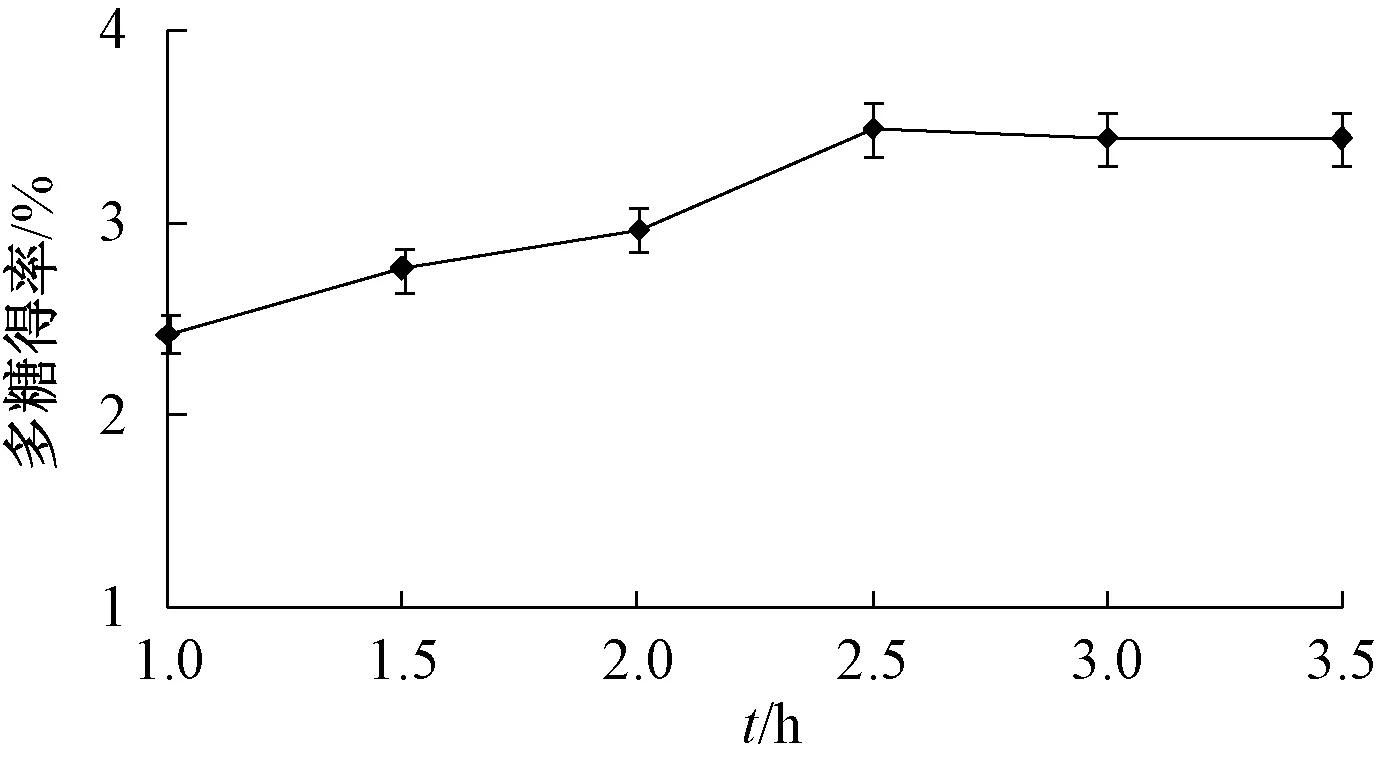
图5 酶解时间对多糖得率的影响Fig.5 Effect of enzymolysis time on polysaccharides yield
2.4 Box-Behnken 响应面法优化 在单因素试验基础上,采用Design Expert 8.0.5 软件进行Box-Behnken 响应面设计,选择加酶量(X1)、介质pH(X2)、酶解温度(X3)、酶解时间(X4)作为影响因素,多糖得率(Y)作为评价指标,共设立29个处理组,因素水平见表1,结果见表2。

表1 因素水平Tab.1 Factors and levels

表2 试验设计与结果Tab.2 Design and results of tests
通过Design-Expert 8.0.5 软件进行拟合,得二次回归方程为Y=5.68+0.61X1-0.062X2-0.13X3+0.27X4+0.24X1X2-0.43X1X3-0.36X1X4-0.07X2X3+0.16X2X4-0.38X3X4--0.64,方差分析见表3。由此可知,模型P<0.000 1,决定系数R2=0.909 5,失拟项P>0.05,表明方程拟合情况良好;X1、对多糖得率有极显著影响(P<0.01),X4、X1X3、X3X4对其有显著影响(P<0.05);各因素影响程度依次为加酶量>酶解时间>酶解温度>介质pH。响应面分析见图6。
由此可知,最优提取工艺为加酶量0.9%,介质pH 5.07,酶解温度47.4 ℃,酶解时间2.58 h,多糖得率为5.87%,考虑到实际操作,将其修正为加酶量0.9%,介质pH 5.0,酶解温度47 ℃,酶解时间2.5 h。进行3 次验证试验,测得多糖平均得率为5.86%,与预测值5.87% 接近,表明工艺稳定可靠。
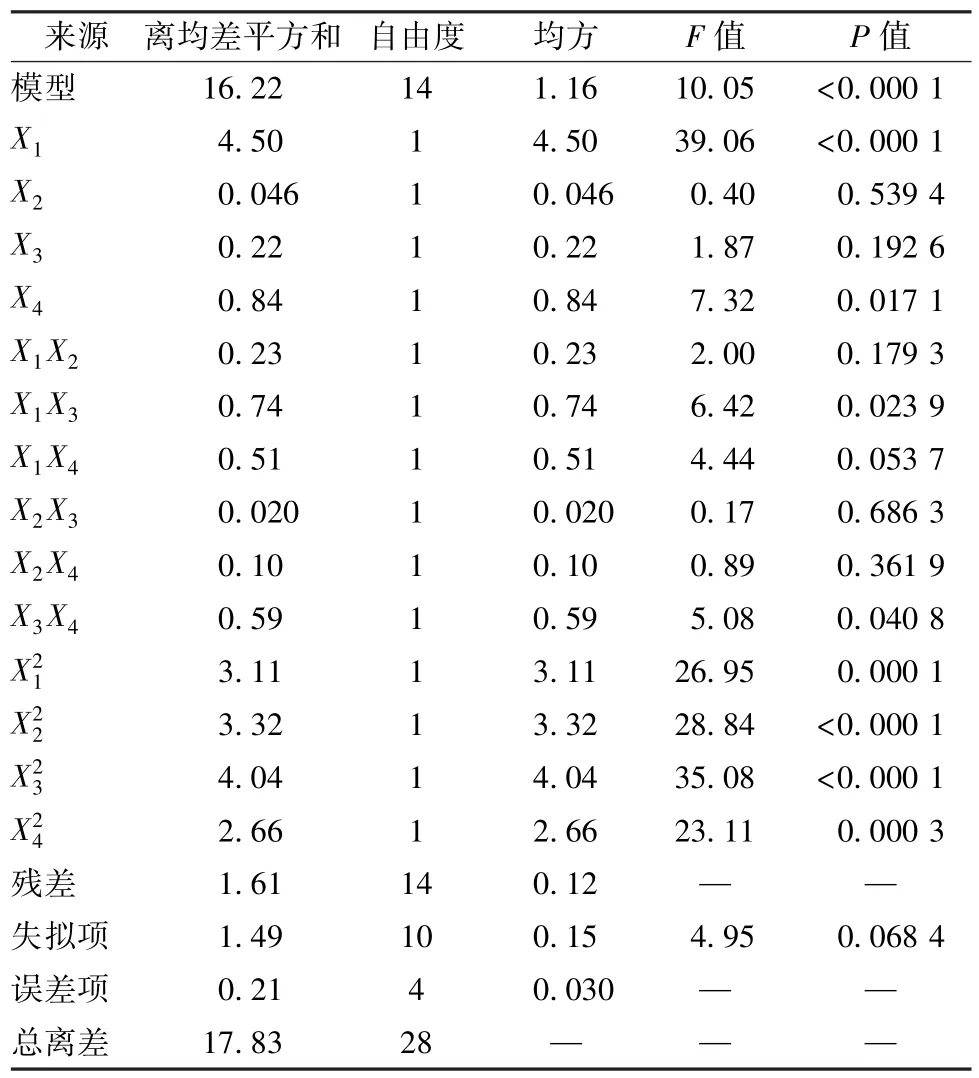
表3 方差分析Tab.3 Analysis of variance
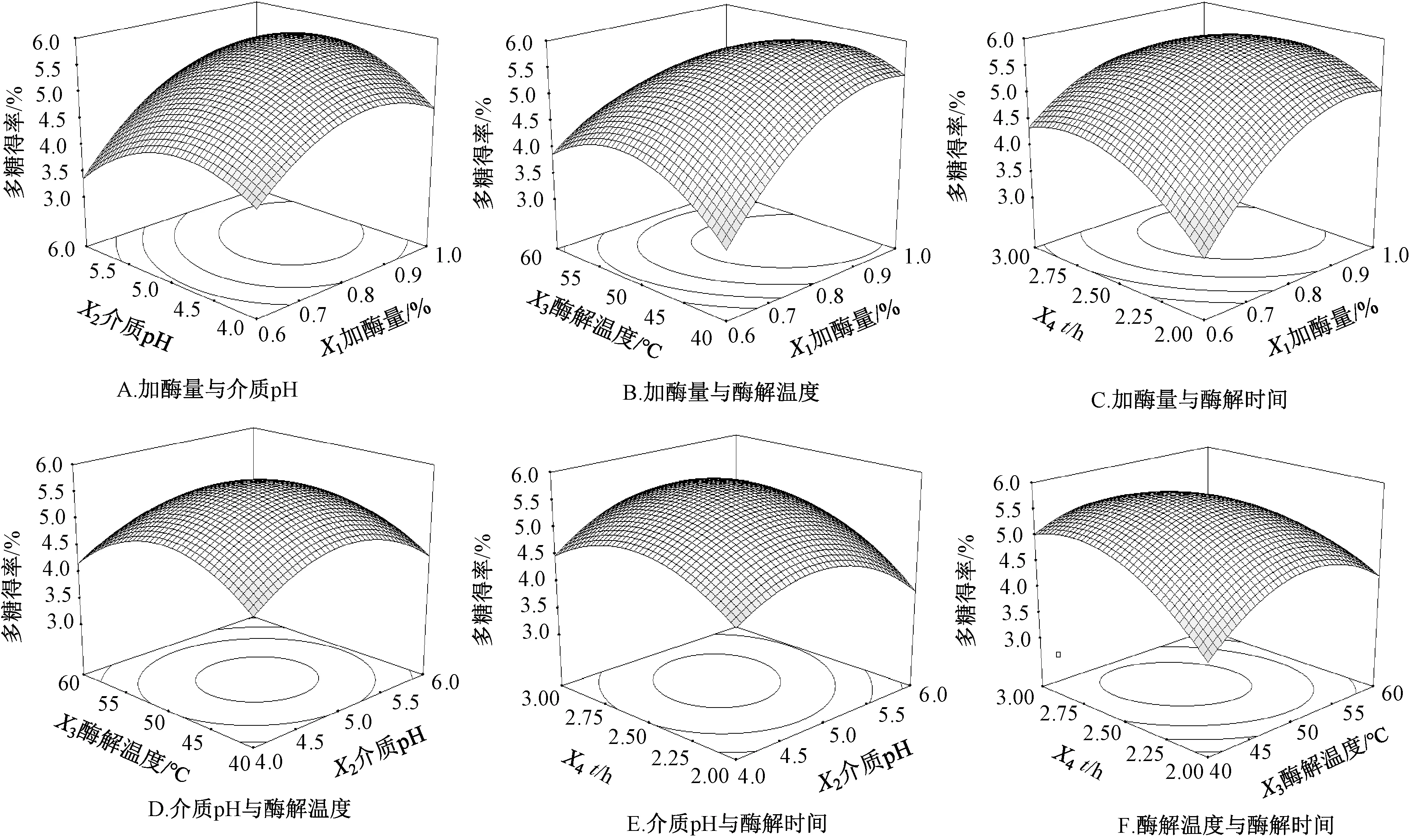
图6 各因素响应面图Fig.6 Response surface plots for various factors
2.5 提取过程动力学分析 本实验假设整个提取体系温度分布一致,搅拌良好,忽略传质过程中的外部阻力,将原料粉末近似看作球形构造,表面光滑。多糖从固相向溶剂相的溶出只与径向相关,扩散速率通常用Fick 扩散公式描述[15],为了方便表达,假设Y=ln [C∞/(C∞-C)],完整表达为Y=kt+ln[π2C∞/6(C∞-C0)]且k=π2DS/r2(C∞为传质达到平衡时介质中多糖含有量,单位mg/mL;C为t时刻介质中多糖含有量,单位mg/mL;C0为介质中多糖初始含有量,单位mg/mL;k为提取速率常数,单位min-1;DS为表面扩散系数,单位cm2/min;r为近似球形的材料半径,单位cm)。
精密称取40 g 藕节粉末(r约为0.05 cm),设定纤维素酶加入量0.9%,介质pH 5,料液比1∶20,在7 种温度(305、310、315、320、325、330、335 K)下水浴提取,相同条件下另设不加纤维素酶的体系。从开始反应的0.5 h 开始,每隔0.25 h 取样0.5 mL,直至3.5 h 提取完全为止,测定提取样品中多糖含有量,得到多糖得率随提取时间的变化规律,结果见图7。
由此可知,无论是否加入纤维素酶,多糖得率都随着提取时间延长而升高;在最适酶解温度下,加入纤维素酶后多糖得率最高,提取过程达到平衡时间最短,其原因是纤维素酶有其最佳酶解温度,低于或者超过该温度时活性均会受到限制,导致其得率下降,达到提取平衡时间延长;但在各提取温度下,加入纤维素酶后多糖得率均高于未加入纤维素酶,表明纤维素酶有助于提高其得率。提取过程动力学方程(X为提取时间,Y为多糖得率)及动力学参数见表4。
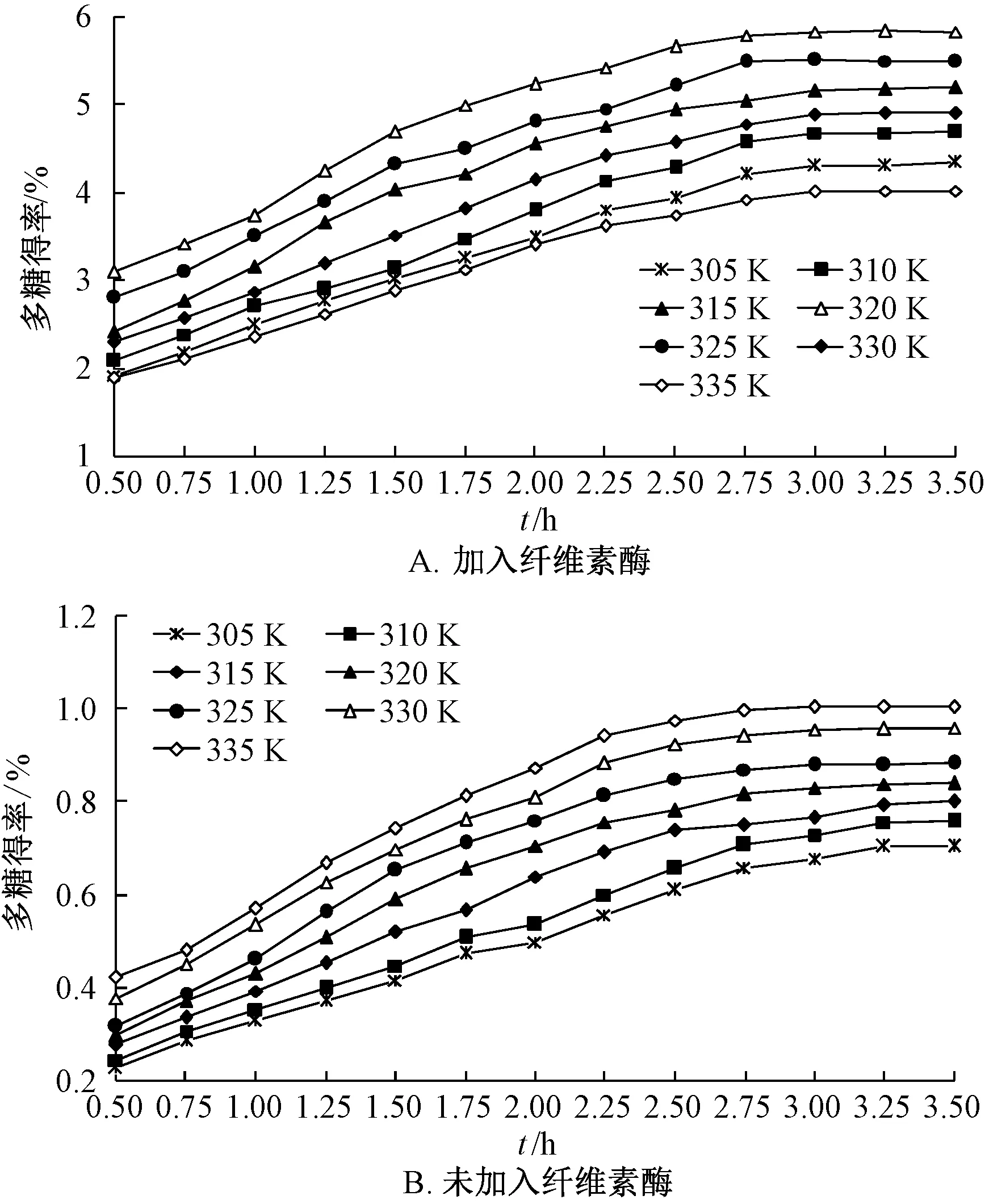
图7 不同温度下多糖得率与提取时间的关系Fig.7 Relationships between polysaccharides yield and extraction time under different temperatures

表4 提取过程动力学方程及动力学参数Tab.4 Kinetic equations and kinetic parameters for extraction process
由此可知,在不同提取温度下无论是否加入纤维素酶,决定系数R2均不小于0.901 3,表明方程拟合情况良好,提取过程符合一级传质动力学模型;加入纤维素酶后,在提取温度305~335 K 范围内提取速率常数(k)先升后降,在320 K 达到最大值,证实将其作为最佳酶解温度时既可保证较好的提取效果,又能达到节约资源的目的;相同提取温度下加入纤维素酶后的k值均大于未加入纤维素酶,表面扩散系数(DS)亦然。
2.6 提取过程热力学分析 当提取过程达到动态平衡时,可通过Van’t Hoff 方程计算热力学参数ΔH、ΔS、ΔG[16-17],计算公式为ln(C/C∞-C)=-ΔG/RT=-ΔH/RT+ΔS/R[ΔG为提取过程的自由能,单位kJ/mol;ΔS为提取过程的熵,单位J/(mol·K);ΔH为提取过程的焓,单位kJ/mol;R为摩尔气体常数,数值8.314 J/(mol·K);T为提取温度,单位K]。
加入纤维素酶后,在提取温度320 K 时多糖提取达到平衡,即C=C∞,将ln [C/(C∞-C)]对1/T作线性拟合,可得2 组线性方程,即ln [C/(C∞-C)]=-7.841 3X+0.029 8(R2=0.988 1)、ln [C/(C∞-C)]=15.468 8X-0.042 3(R2=0.987 3),由此计算ΔH、ΔS、ΔG。由于提取温度320 K 时ln [C/(C∞-C)]无意义,故只计算305、310、315、325、330、335 K 下热力学参数,结果见表5。

表5 不同提取温度下热力学参数Tab.5 Thermodynamic parameters under different extraction temperatures
由此可知,提取温度为305~315 K 时,ΔH、ΔS均大于0,表明提取过程中吸热熵增加[17];为325~335 K 时,ΔH、ΔS均小于0,表明提取过程中放热熵减小;不同提取温度下ΔG均小于0,表明提取过程为自发过程,其中在320 K 前ΔG值减小,表明提取过程容易进行[17],而超过320 K 后ΔG值反而增大,表明提取过程不容易进行,从而印证了最佳提取温度确定为320 K(47 ℃)的合理性。
3 讨论
水酶法是在机械破碎的基础上,利用酶(蛋白酶、淀粉酶、纤维素酶等)破坏细胞壁结构,提高植物细胞膜、细胞壁通透性,加快内容物溶解,从而增加提取效率、产物得率。文献报道,采用该方法提取油橄榄叶[18]、菊苣根[19]、半边莲[20]等药材中的多糖时得率高,安全可控。本实验通过纤维素酶法辅助提取藕节多糖,并结合工业生产可行性和成本应用Box-Behnken 响应面法对提取工艺进行优化,发现所建立的模型稳定可靠。
目前,已有关于天然产物提取过程中动力学、热力学的研究[10,16-17],天然活性成分从实验材料中的溶出过程比较复杂,会受到有效成分分子量大小、药材粉末颗粒形态、药材质地、细胞破碎程度等诸多因素的影响[10],但有效成分向外扩散过程是关键。因此,本实验采用Fick 扩散公式、Van’t Hoff 方程分析有效成分向外扩散过程的动力学、热力学,发现纤维素酶能提高藕节多糖提取过程中提取速率常数(k)、表面扩散系数(DS),从而加快溶出速率。另外,纤维素酶法提取天然活性成分时,应在其最适温度下进行,这样才能充分发挥生物酶的高效性。

