急性缺血性脑卒中患者妊娠相关血浆蛋白A超敏检测方法的建立及评价
曾昭伟,陈淑莲,常艳敏,王学谦
(天津市南开医院 检验科,天津300100)
急性缺血性脑卒中(IS)是临床上常见的心血管系统疾病之一,当血管内皮细胞损伤后释放炎性介质并形成易损斑块,导致血管病变,促进IS进展[1]。妊娠相关蛋白A(PAPP-A)是一种基质金属蛋白酶,在动脉粥样硬化斑块形成过程中起重要作用,是心血管系统炎性疾病的生物标志物之一[2]。但在动脉粥样硬化患者血清中的PAPP-A浓度极低[3],普通ELISA方法难以检测。由于IS是颈动脉粥样硬化斑块发生不稳定、破裂,引起血小板黏附、活化、聚集和血栓形成导致,所以推测PAPP-A是IS的潜在生物标志物,已有少量相关研究[4]支持这一理论。本研究制备基于活性表位集中的特异PAPP-A重组抗原,建立基于微球、生物素标记的PAPP-A与化学发光结合的超敏检测方法,并对IS发生发展时PAPP-A检测的临床意义进行初步评估。
1 资料与方法
1.1 资料
1.1.1临床资料 收集天津市南开医院2017年6月至2018年6月收治确诊的神经内科IS患者血清。包括轻度患者39例,男23例,女16例,平均年龄(56±11)岁;中度患者43例,男24例,女19例,平均年龄(65±9)岁,重度患者患者36例,男20例,女16例,平均年龄(52±12)岁。对照组40例,男27例,女13例,平均年龄(58±16)岁。诊断均经CT/MRI检查确诊。排除标准:肝肾功能不全、严重的心力衰竭、心肌梗死、心源性脑栓塞、颅内出血、近1个月内有外伤史或手术史、肿瘤性疾病、急性感染性疾病、风湿性疾病等。
1.1.2试剂与仪器 Lica research 化学发光分析仪(中国上海博阳生物技术有限公司)、96孔发光微孔板、受体微球及链霉素亲和素包被供体球均购自美国Perkin Elmer公司。定值标准品由Perkin Elmer公司提供,PAPP-A标准品浓度分别为0 mU/L、10 mU/L、40 mU/L、200 mU/L、800 mU/L、2 000 mU/L。
1.2 方法
1.2.1标本采集 患者入院后清晨空腹时,静脉取血4 ml,置真空采血管中,医用低速离心机4 000 r/min 离心10 min,吸取血清检测,其余分装,保存于-80℃冰箱备用。
1.2.2重组PAPP-A制备 利用DNAstar软件分析PAPP-A的CDS区,选择抗原性最强的抗原表位编码区。以PAPP-A-质粒转化菌种为模板制备DNA,PAPP-A的DNA和pET42a质粒分别双酶切,凝胶回收、连接,转化Top10大肠埃希菌,筛选阳性克隆鉴定正确后,转化BL21大肠埃希菌,诱导产生PAPP-A重组蛋白,镍柱纯化PAPP-A重组蛋白。
1.2.3PAPP-A抗体制备、纯化 利用制备的重组PAPP-A注射家兔,制备对应抗PAPP-A多克隆抗体。并用金黄色葡萄球菌蛋白A(SPA)亲和层析法纯化抗体。
1.2.4抗体标记微球 离心管中加入0.1 mg包被抗体,6 000 r/min离心10 min,用PBS缓冲液洗涤,重复3次,加入0.5 mg受体微球及1.5 μl Tween-20,加PBS 缓冲液至100 μl,37 ℃振荡孵育48 h。
1.2.5生物素标记抗体 将抗PAPP-A抗体装入MwCO为12 000的透析袋中,置0.1 mol/L的碳酸盐溶液(pH 9.5)中充分透析,换液3次。将生物素N-羟基琥珀酰亚胺酯(HOSU)溶于二甲基甲酰胺中,最终浓度20 mg/mL。将生物素与抗体混合,室温下搅拌1 h。混合液在4℃下用0.1 mol/L,pH 7.4的PBS溶液透析24 h。
1.2.6PAPP-A检测 在96孔板中依次加入标准品及待测样品25 μl、1∶100稀释标有PAPP-A抗体微球30 μl、1∶2 000稀释的生物素化抗体25 μl,37℃振动孵育30 min;避光加入100 μl链霉素亲和素包被供体球,37℃振动孵育10 min,化学发光分析仪测定信号值。
1.2.7方法学评价 灵敏度、特异度、回收率、准确率、稳定性等方法学评价指标均按照实验室成熟的方案进行。
1.2.8与时间分辨免疫荧光法(TRFIA)检测对比 随机挑选确诊的阳性病例70例检测。时间分辨免疫荧光法按试剂盒说明书操作。
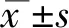
2 结果
2.1 重组抗原的纯化及鉴定针对筛选的抗原决定簇集中表位,制备PAPP-A重组抗原,经过镍柱纯化后,进一步利用亲和层析凝胶柱纯化,1-4管PAPP-A活性较高,见图1;经western blot鉴定有明显目的条带,见图2。
图1 重组PAPP-A蛋白经过免疫亲和层析洗脱

图2 重组PAPP-A蛋白经过western blot鉴定
2.2 标准曲线本研究建立的基于微球标记的化学发光检测方法以参考标准品浓度为横坐标,检测信号值为纵坐标,由logistic曲线拟合(四参数)处理得到标准曲线,线性良好,见图3。

图3 PAPP-A标准曲线
2.3 方法学评价
2.3.1灵敏度 用标准曲线反算出0 mU/L OD值的±2s对应的浓度值,得出该方法的灵敏度为0.30 mU/L。
2.3.2准确度 回收实验证明回收率在96%以上,说明此方法具有很好的准确性,见表1。

表1 不同浓度标本的回收率测定
2.3.3稳定性 稳定性实验显示,在37℃温箱中放置3 d与0 d稳定性无明显变化,5 d后标准品OD值均上升,但线性良好,说明试剂盒的稳定性良好。但放置7 d后,最大OD值较高,且线性变差,见图4。

图4 0、3、5、7天PAPP-A稳定性对比
2.4 方法测定结果的对比本文方法与精密度较高的时间分辨免疫荧光法[5]对比测定70例标本,以TRFIA试剂盒所测得PAPP-A浓度为X轴,本文方法测定PAPP-A浓度为Y轴,绘制散点图,见图5。变量进行相关性分析,r=0.982 (P<0.01),说明两种检测方法相关性良好。
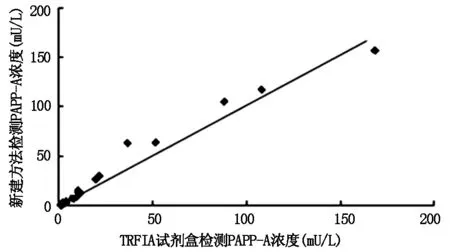
图5 TRFIA试剂盒所测结果与本方法测定结果对比
2.5 各组血清PAPP-A水平比较IS各组PAPP-A 浓度较正常对照组升高,IS轻中重度组血浆PAPP-A 浓度比较差异均有统计学意义,P<0.01,见表2。

表2 IS轻中重度组、对照组PAPP-A 浓度比较
**P<0.01;a与对照组比较,b与轻度组比较,c与中度组比较,P<0.01
3 讨论
IS发病迅猛、病死率高,其病程的主要变化是脑血管动脉粥样硬化、易损斑块的形成及破裂,基质金属蛋白酶在动脉粥样硬化斑块的形成并发展为不稳定斑块过程中起重要作用,早期检测对降低易损斑块、降低患病率、病死率有重要意义[6]。
PAPP-A属于锌离子依赖的基质金属蛋白酶,于1974年在孕妇血清中发现。PAPP-A在孕妇血清中是四聚体形式存在,但是在血管疾病斑块形成中存在形式是同二聚体,且含量极低。迄今为止,所发现的PAPP-A底物之一是胰岛素样生长因子结合蛋白4(IGF binding protein-4,IGFBP-4 )。有报道表明,抑制某些非编码RNA如miR-490-3p可靶向作用于PAPP-A,促进水解IGFBP-4使IGF-1释放[7,8],IGF-1作用于血管平滑肌上的受体,促进炎性介质的释放,促进平滑肌细胞的增殖迁移,间接促进动脉粥样硬化的形成和发展[9],表明PAPP-A是心血管系统动脉粥样硬化斑块形成的重要上游基因。另外,PAPP-A作为金属蛋白酶之一,与多种信号通路相关,具有降解细胞外基质的作用,导致粥样硬化斑块破裂[10]。临床诊断方面,2015年,Wang[4]等研究证实PAPP-A是IS患者良好的诊断指标。Wang[11]等研究发现PAPP-A 在IS患者表达显著升高,PAPP-A可以作为预测IS患者临床事件的预后指标。
目前临床用于检测患者血清PAPP-A含量方法仍主要基于ELISA,在方法学上抗原抗体反应的固有缺陷导致灵敏度不足。TRFIA灵敏度较高,本研究用来作为检测对比标准。但TRFIA操作繁琐,检测昂贵,并非最优方法。本研究试图建立一种增强检测灵敏度及特异度的方法,增强PAPP-A临床检测的应用价值。首先,因为PAPP-A会与proMBP形成四聚体[12],这种基于四聚体形式的抗原制备的抗体,使检测有非特异反应,本研究挑选了PAPP-A的抗原优势表位,制备了表位特异的抗体应用于后续的检测,排除了proMBP抗原成分在其中引起的干扰。其次,由于PAPP-A含量低,ELISA检测难以区分其余正常对照组的含量差别。本研究加样后形成抗体包被发光颗粒-抗原-生物素化抗体的复合物,链霉素亲和素包被的感光颗粒与之结合,适当的间距使感光颗粒在680 nm的激光照射下,促进周围的氧分子激发,形成单线态氧,可引起发光颗粒发射荧光信号,单光子计数器可捕获荧光信号,并根据信号值大小计算待测物的浓度。本研究利用化学发光法的高灵敏度,结合微球标记抗体增大反应面积以及生物素亲和素的级联放大效应可以有效检测出PAPP-A信号值,在IS各组及正常对照组中差异有统计学意义。由此可见PAPP-A与IS患者疾病分层有密切关联,可以作为高效准确的判定指标应用于临床检测IS患者[13]。
本研究建立的方法有效避免了其他表位及proMBP的非特异干扰,从根本上解决了非特异反应的问题,并且生物素亲和素系统的参与以及受体微球及供体微球增大了反应面积,均使此反应体系有极高的灵敏度。本检测方法操作简单,适合于推广。我们计划后续扩大样本量,深入研究IS发病初期及病情在进展中不同阶段PAPP-A浓度的变化,以便早期明确诊断IS患者,并严密监控疾病进展及预后,使PAPP-A的临床应用更广泛。

