结直肠癌筛查及其进展
许俊锋 盛剑秋
中国人民解放军医学院1(100853) 中国人民解放军总医院第七医学中心消化科2
结直肠癌(colorectal cancer, CRC)起源于结直肠黏膜上皮,是临床上最常见的消化系统恶性肿瘤之一,发病率在全球恶性肿瘤中居第三位,死亡率居第二位[1]。随着国人生活水平的提高和饮食习惯的改变,我国CRC发病率总体呈现上升趋势,目前发病率和患病率分居消化系统恶性肿瘤的第二位和第一位[2]。据2018年最新估算数据,我国CRC年新发病例约51.7万,死亡病例约24.5万,新发和死亡病例数均接近全球同期数据的28%,疾病负担沉重[1,3]。因此,降低我国CRC发病率和死亡率是刻不容缓的重大临床问题。
实践证明,CRC筛查不仅可发现早期CRC及其癌前病变,还可通过内镜下切除结直肠息肉预防CRC发生。近年来,欧美等发达国家由于长期对50岁以上人群进行CRC筛查并于结肠镜下切除腺瘤,CRC发病率和死亡率均显著下降。2017年美国癌症报告指出,近20年CRC发病率下降约40%,近40年CRC死亡率下降51%,该结论的反面佐证是同期未普及CRC筛查年轻人群的CRC发病率以约2%的速率逐年上升[4]。我国自20世纪70年代开始重视CRC的筛查,调查显示连续性筛查可降低筛查人群的CRC累积发病率和死亡率[5]。因此,逐步普及CRC筛查和推广内镜下早诊、早治是提高我国早期CRC及其癌前病变诊断率、降低CRC发病率和死亡率的有效途径。本文对CRC筛查及其进展作一概述。
一、筛查模式介绍[2]
1. 自然人群筛查(natural population screening):也称无症状人群筛查(asymptomatic population screen-ing),是通过标准化方法进行的以人群为基础的筛查,多数由国家相关部门或组织出面,以各种手段促使符合筛查条件的全部人群(社区或单位)在规定的较短时间段内参与筛查,需动用较多资源。自然人群筛查目的在于在检出早期CRC的同时发现并干预癌前病变,从而降低人群或地区的CRC发病率和死亡率。
2. 伺机筛查(opportunistic screening):也称机会性筛查或个体筛查(individual screening),是一种基于临床的CRC筛查模式,针对的是去医院门诊和(或)社区医疗保健机构以及体检机构的个体,无需额外资源支持,可操作性强,患者依从性相对较好。其目的主要在于早期检出CRC(包括部分癌前病变),从而优化治疗效果,但无法判断该筛查模式是否能降低某一人群或地区的CRC发病率。
二、国、内外CRC筛查现状
1. 国外现状:长期以来,欧美等发达国家已建立起较为完善的国家CRC筛查体系。美国疾病预防控制中心2012年报告指出,2002年到2010年,美国CRC人群筛查率从54%上升至65%,随后趋于稳定。该报告还显示,美国50~75岁的成人中有65%以上连续接受CRC筛查,仅27.7%从未接受过筛查[6]。此外,美国人群结肠镜检查率从2000年的21%上升至2015年的近62%[4];荷兰等多个欧洲国家人群结肠镜检查率高达50%以上[7]。
2. 国内现状:我国尚未建立起符合国情的全国性CRC筛查体系,仅部分省市或地区开展了区域性CRC筛查。2012—2015年开展的一项城市人群CRC筛查项目涵盖16省22市,共138.16万例 40~69岁人群参与,其中18.29万人经风险评分评估为CRC高危人群,推荐行结肠镜检查,但最终仅2.56万人接受结肠镜检查,结肠镜检查参与率仅为14%,依从性较低[8]。上海市浦东新区的CRC筛查经验同样表明,经风险评分和免疫化学法粪便隐血试验(fecal immunochemical test, FIT)初筛后,高危人群结肠镜检查依从性仅为23.5%[9],远低于欧美水平。
三、国、内外最新CRC筛查指南和共识
1. 国外指南和共识:2017年,美国结直肠癌多学科工作组更新了CRC筛查建议,列出结肠镜等七种筛查技术并概述其优、缺点,并首次提出将“提高人群筛查率”作为CRC筛查的主要目标之一[10]。鉴于年轻人CRC发病率和死亡率呈上升趋势这一现状,美国癌症协会2018年版CRC筛查指南将一般风险人群的筛查年龄提前至45岁,并明确建议其筛查终点时间。同时,不再强调各种筛查方式的优先等级排序或多种筛查方式并行,而是由患者根据自身偏好、支付能力等在可获得的筛查方式中进行选择,以期提高依从性[11]。
2. 国内指南和共识:近年来,中国CRC筛查指南也在不断更新、完善中。最新的《中国早期结直肠癌筛查流程专家共识意见》指出,CRC筛查的目标人群为50~75岁,建议先通过风险评分和(或)初筛试验筛选出高危人群,进一步接受高质量结肠镜检查;非高危人群建议采用多轮非侵入性筛查和定期随访策略[2]。
四、CRC筛查方法
1. 基于高危因素的风险评分问卷:基于高危因素的风险评分问卷是一种经济可行的CRC筛查方法。2014年亚太CRC筛查共识纳入了包括年龄、性别、CRC家族史和吸烟四个危险因素的亚太结直肠筛查(Asia-Pacific colorectal screening, APCS)评分系统(表1)[12]。该评分系统结合FIT检测用于亚太地区12个城市5 657例40岁以上无症状个体的CRC筛查,能有效区分CRC高危人群(0~1分:低危;2~3分:中危;4~7分:高危),APCS评分低危且FIT阴性者可不进行结肠镜检查,从而显著减少结肠镜检查工作量[13]。我国学者在APCS评分系统基础上进一步的研究提示,基于无症状人群年龄、性别、CRC家族史、吸烟、体质指数(BMI)和自诉糖尿病的评分系统(表2)有助于预测CRC风险,且更符合我国实际情况,可应用该评分系统对我国不同人群进行CRC个体化风险分层,根据评分合理选择筛查方案:高危患者(3~6分)可直接行结肠镜检查,低危患者(0~2分)则可考虑粪便隐血试验(fecal occult blood test, FOBT)和(或)血清/血浆标志物检测[14]。
2. 结肠镜检查:结肠镜活检病理检查是目前诊断CRC的金标准。结肠镜检查不仅可直观地发现全结肠和直肠病变,还可行内镜下息肉切除术,从而有效预防CRC发生。然而,结肠镜检查操作复杂,病变检出率受多方面因素的影响,主要包括肠道准备情况、退镜时间、操作者对病变的识别能力等。因此,结肠镜检查仍有一定的漏诊率,主要发生于近端结肠,腺瘤漏诊率高达26%,进展期腺瘤漏诊率为9%[15]。

表1 APCS评分系统
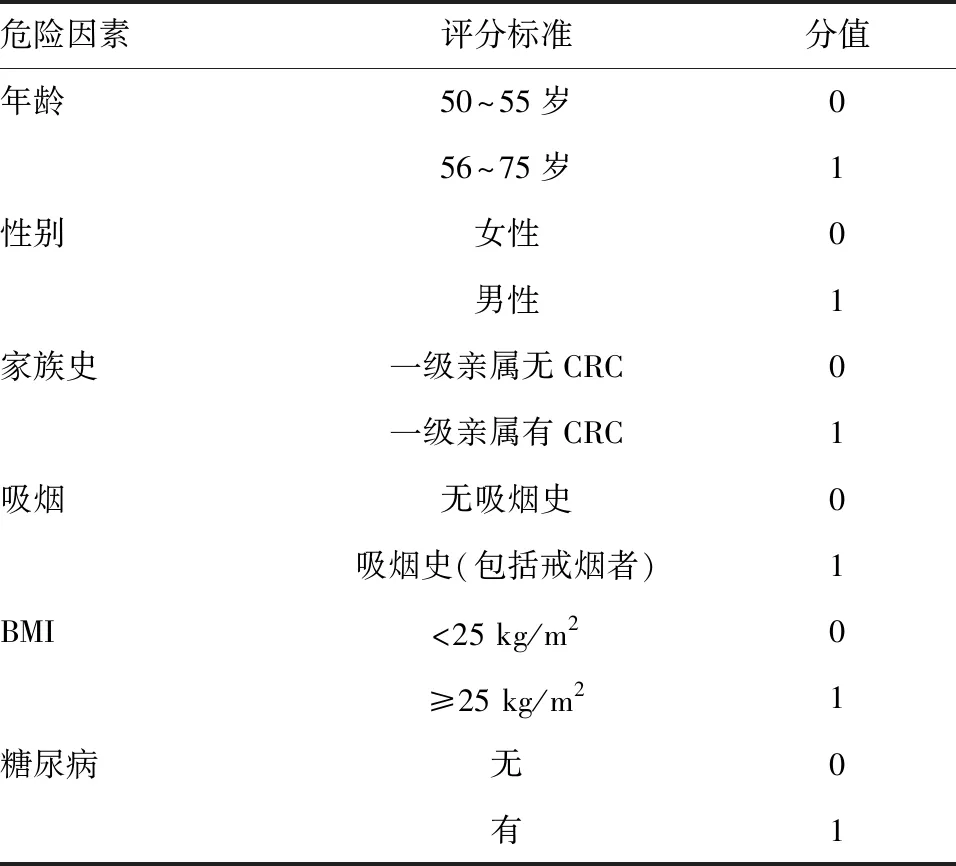
表2 CRC风险预测评分
此外,结肠镜检查属侵入性检查,检查费用相对较高,受检者依从性差,且存在一定的并发症风险,主要包括术后出血(0.26%)、穿孔(0.05%)、死亡(2.9/10万)和麻醉意外[16],目前国内尚无法用于大规模人群筛查,而主要是用于精筛或高危人群的进一步诊断和治疗。
3. FOBT:FOBT是CRC无创筛查最重要的手段,包括化学法[愈创木脂FOBT (guaiac-based FOBT, gFOBT)]和免疫化学法(FIT)。
①gFOBT:gFOBT具有快速、简便、无创等优点,前瞻性随机对照试验证实其为有效的CRC筛查方法之一,可降低CRC死亡率[17]。然而,gFOBT检出CRC及其癌前病变的敏感性较低,故无法显著降低CRC发病率[18]。此外,其检测结果易受饮食和药物影响,假阳性率和假阴性率相对较高,目前已不是CRC筛查的首选方法。
②FIT:FIT检查结果不受食物和药物影响,更适用于无症状人群筛查。目前多个指南均推荐FIT检测时间间隔为1年。一项纳入5万余例无症状成人(50~69岁)的随机对照试验结果表明,每两年一次FIT筛查与单次结肠镜筛查具有相似的CRC检出率(0.1%),而且FIT受试者依从性更好(P<0.001)[19]。但FIT的进展期腺瘤检出率较低(P<0.001)[19],在一般风险人群中仅为23.8%[20],在高危人群中亦不足50%[21]。在各类FIT检测方法中,目前以定性的胶体金试纸法在我国CRC筛查中应用最为广泛,然而有研究[22]表明,在大样本人群CRC筛查中,使用全自动定量FIT检测仪的定量FIT较定性FIT能检出更多的进展期肿瘤(结直肠癌和进展期腺瘤),检出率显著高于胶体金试纸法(0.402%对0.154%,P<0.01)。全自动定量FIT检测仪具有自动化分析、高通量、判读客观、阳性界值可灵活调整等优点。近年一项meta分析结果提示全自动定量FIT在无症状一般风险人群中检出CRC的敏感性和特异性分别为86%和91%[23]。
值得注意的是,在临床实践中,对于FIT阳性患者均建议行结肠镜检查。一项纳入70 124例FIT结果阳性后接受结肠镜检查者(50~70岁)的研究[24]以两项检查的时间间隔为暴露因素进行分析,结果提示应在FIT结果阳性后9个月内行结肠镜检查,9个月后CRC和晚期疾病(Ⅲ、Ⅳ期癌)风险显著增高,且时间间隔越长、风险越高。
4. 粪便DNA检测:粪便DNA检测包括单靶点和多靶点方案,也可与FIT联合使用,具有无需特殊设备、无需限制饮食、无创等优点,美国最新指南推荐其用于无症状人群CRC筛查的时间间隔为每3年1次[11]。Imperiale等[20]纳入9 989例无症状一般风险受试者的临床研究发现,粪便多靶点DNA联合FIT检测(包括KRAS突变、NDRG4甲基化、BMP3甲基化、β-actin和FIT)检出CRC的敏感性高于单独FIT检测(92.3%对73.8%),但特异性略低,联合检测可检出更多的进展期癌前病变(进展期腺瘤和长径≥1 cm的无蒂锯齿状息肉)。我国学者也一直在不断开发适合中国人群CRC筛查的粪便多靶点DNA检测试剂盒。一项多中心回顾性临床研究[25]表明,联合检测粪便SDC2和SFRP2基因甲基化检出CRC和进展期腺瘤的敏感性分别为97.7%和57.9%,均显著高于FIT检测(69.7%和21.1%,P<0.05),且特异性高达98.7%,具有良好的应用前景。然而,该方法费用较高,在我国推广应用尚需多中心大样本人群筛查以及多轮筛查的长期随访数据支持。
5. 血浆Septin9基因甲基化(mSEPT9)检测:mSEPT9是早期CRC的特异性分子标志物。国内Jin等[26]的临床研究纳入476例受试者,分析结果显示血浆mSEPT9检出CRC的敏感性和特异性分别为 74.8%和87.4%,均高于FIT检测(58.0%和82.4%)。但一项国际多中心大样本前瞻性研究[27]表明,在无症状一般风险人群(≥50岁)中,mSEPT9对CRC和进展期腺瘤的敏感性分别仅为48.2%和11.2%,不具有成本-效益优势。目前国、内外指南均不推荐mSEPT9用于人群筛查,只可作为个体化诊断的选择和补充。
五、CRC筛查新技术
1. 循环肿瘤细胞(circulating tumor cells, CTCs)检测:CTCs来源于原发肿瘤细胞的克隆,存在于CRC发生的早期阶段,在肿瘤发展、转移过程中发挥重要作用[28]。CTCs在外周血中分布极少,不同商品化检测平台的诊断效能差异较大。一项纳入620例受试者的前瞻性临床研究表明,CellMax仿生平台(CMx)检出CRC癌前病变的敏感性为76.6%,与结肠镜筛查效果接近(76%~94%),对CRC的敏感性则高达86.9%,优于FOBT的62%~79%[29]。但在现阶段,CTCs检测仍面临一系列亟待解决的问题,如对CTCs亚型的认识还不充分、对CRC诊断效能的评价尚缺乏多中心大样本临床研究验证等。
2. 循环肿瘤DNA(circulating tumor DNA, ctDNA)检测:近年来,由肿瘤细胞释放至循环血液中的ctDNA成为研究热点之一。Xu等[30]的一项小样本研究通过ctDNA全基因组测序构建诊断模型,该模型区分CRC与健康对照者的敏感性为91.7%,特异性为88.9%,且所有早期CRC均被检出。最近我国一项大样本研究[31]鉴定出了CRC患者相对于健康人血液的ctDNA甲基化谱,并发现其中一个关键位点(cg10673833)在高危人群中检出CRC及其癌前病变的敏感性为89.7%,特异性为86.8%,ROC曲线下面积(AUC)为0.9。ctDNA检测是否具有开发成为无创筛查CRC标志物的潜力,有待深入研究。
3. 粪便菌群标志物检测:近年来,越来越多的研究证实肠道菌群与CRC发生、发展关系密切,CRC和进展期腺瘤的微生物标志物研究已成为焦点课题。Wong等[32]的研究发现,CRC和进展期腺瘤患者粪便菌群中的具核梭杆菌(Fusobacteriumnucleatum, Fn)丰度显著增加,FIT与Fn定量检测联合与单独FIT检测相比诊断效能显著提高,检出CRC的敏感性和特异性分别达到92.3%和93%,检出进展期腺瘤的敏感性亦有显著提高(38.6%对15.5%)。新近一项大样本研究[33]采用宏基因组学与代谢组学相结合的方法观察肠道微生物、菌群丰度和代谢产物在CRC进展过程中的动态变化,基于物种、KO基因、代谢物数据的随机森林分类区分健康者与不同阶段CRC(0期或Ⅲ/Ⅳ期)的AUC分别达到0.78和0.85。该研究为CRC菌群相关标志物的研究提供了新思路。
粪便菌群标志物检测用于人群CRC筛查的主要缺点在于价格昂贵,分析方法复杂,其确切价值还需大样本人群筛查研究进一步明确。
六、遗传性CRC综合征人群的筛查
家族性遗传性CRC约占CRC总数的5%~10%,2016年《中国结直肠癌预防共识意见》为不同类型遗传性CRC综合征制订了明确的随访监测方案[34]。结直肠多发息肉为遗传性CRC综合征临床常见且较为典型的表现,但对于一部分没有明确家族史的结直肠多发息肉患者,很难通过现有临床标准进行诊断。特别是衰减型家族性腺瘤性息肉病(AFAP)、林奇综合征(LS)和MUTYH基因相关息肉病(MAP),三者在发生CRC前的临床表现均为结直肠多发息肉,且息肉总数少于100枚,仅依靠结肠镜以及其他常规临床检查很难进行鉴别诊断。美国指南推荐患者结直肠腺瘤性息肉数量多于10枚时,应行APC基因和MUTYH基因种系突变检测[35]。然而,仅检测上述两个基因的种系突变只能鉴别出一小部分携带上述两个基因突变的患者,相当一部分高危患者将被漏诊。
国内一项单中心研究[36]应用自主设计的二代高通量测序技术,评估包含19个CRC相关基因外显子的基因筛查策略对遗传性CRC综合征的诊断效能,研究纳入96例结直肠多发息肉(>10枚,包括腺瘤和错构瘤性息肉),分析显示该策略的敏感性和特异性分别为97%和57%;研究结果提示,当患者结直肠息肉数量在10~20枚之间且有CRC个人史或家族史时,或当患者结直肠息肉数量超过20枚时,应属于遗传性CRC综合征高危人群,建议接受相关基因种系突变检测,以期提高遗传性CRC综合征的早期诊断率,进而指导患者及其家系成员的临床随访和监测。
七、结语
综上所述,CRC的筛查方法多样,一些新的早期诊断技术仍在不断研究、探索中。我国人口基数巨大,目前卫生资源和人力资源相对短缺,因此建议集中力量开展CRC伺机筛查。伺机筛查应以FIT与结肠镜检查的两步法筛查方案为基础,同时为提高筛查参与率,应结合各筛查方法的特点,充分考虑受检者个人意愿,灵活、综合地选用个体化筛查方案。对于遗传性CRC综合征高危人群,应尽早进行相关基因种系突变检测以实现早期诊断。

