2例胸腺黏液表皮样癌
陈乐 陈飞宇 胡福安 王鹏 杜进臣 王占鹏 李庆新
黏液表皮样癌(mucoepidermoid carcinoma,MEC)是由黏液细胞、表皮样细胞和中间细胞按不同比例组成的一种恶性肿瘤,在腮腺、下颌下涎腺及口腔黏膜下的小唾液腺多见,其次在肺、食管、乳腺、子宫颈及皮肤中均有报道。但黏液表皮样癌发生在胸腺部位是罕见,约占所有胸腺癌的2%~3%[1-2]。目前国内外报道不超过30例,国内报道7例[3-9]。本文回顾性从2015年1月至2019年3月,我科收治的2例胸腺黏液表皮样癌患者的临床资料并结合相关文献进行复习,总结诊疗经验,以提高对该病的认识。
临床资料
病例1:患者男性,47岁,因“气短半月”入院。既往有吸烟史,入院后CT示;前中纵隔右侧可见团块状软组织密度影,边缘呈分叶状,实质密度尚均匀,最大截面大小约8.2×10.5 cm,增强病灶轻度强化;病灶与纵隔大血管及心脏分界清晰,上腔静脉受压变扁;右肺上叶前段及中叶内侧段外压性肺不张(见图A、图B)。血常规、肝肾功能、电解质、肿瘤标记物等均未见异常。遂在全麻下经胸骨正中切口行“纵隔肿瘤切除术”,术中见:肿瘤位于右前纵隔,左无名静脉下方,约15×12×12 cm大小,有完整包膜,质硬,侵及右侧胸膜,与心包粘连紧密。术中剖开标本见:灰白色结节状组织大小约16×11×8 cm。术后病理诊断:黏液表皮样癌(见图C)。免疫组织化学结果:CD20(-),CD5(-),CKp(),EMA(+),TdT(-),CKh(),Ki-67指数约50%,Vimentin(-),Syn(+/-),CgA(-),CK19()。病理分期:MasaokaⅡb期,术后2015年10月24日开始放射治疗,每日剂量200Gy,共行20次,总剂量为4000Gy。术后随访4年,未见肿瘤复发及转移。
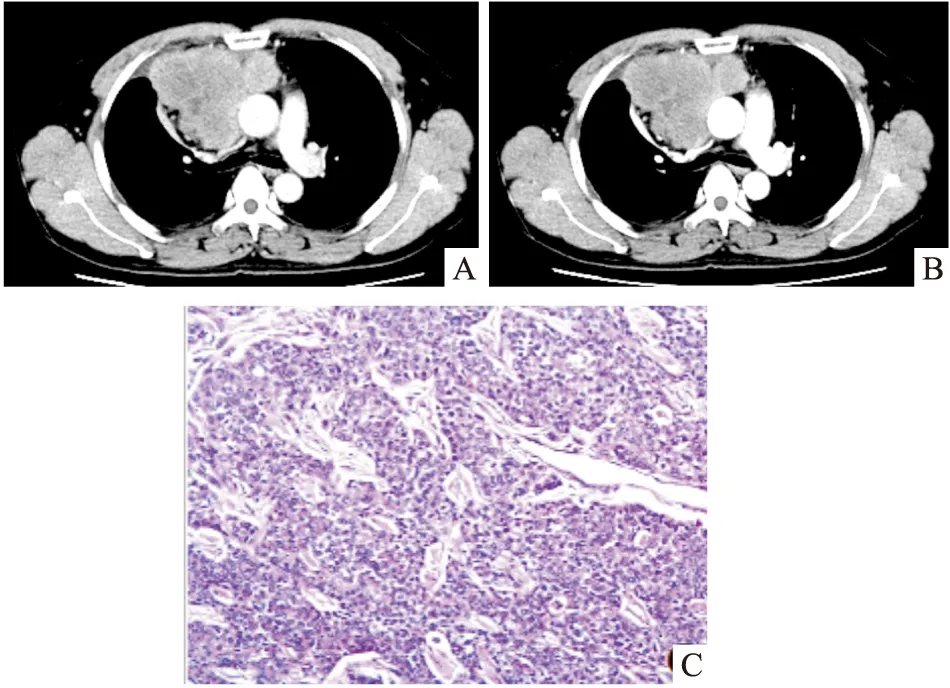
图A、B CT示前中纵隔右侧可见团块状软组织密度影,边缘呈分叶状,实质密度尚均匀;图C 术后病理,HE × 100,镜下可见癌组织有纤维包膜,癌组织呈团巢状排列,其中可见黏液细胞及表皮样细胞
病例2:患者男性,36岁,因“体检发现纵隔肿物1周”入院。既往体健。入院CT示:前纵隔偏右见一囊状低密度影,囊壁见斑点状钙化影,增强各期CT值无明显变化,病灶范围约4.2cm×3.6cm,与心包分界不清。血常规、肝肾功能、电解质、肿瘤标记物等均未见异常。遂在全麻下行“经剑突下达芬奇机器人辅助纵隔肿瘤切除术”。术中见:右前上纵隔可见一大小约4×3.5cm类圆形囊性肿物,质韧,与心包及右无名及上腔静脉粘连较紧密。术后剖开标本见:灰白色囊壁样组织一大小5×3.5×2cm,囊壁厚0.2cm。术后病理诊断:1.形态学改变结合免疫组织化学染色结果,符合黏液表皮样癌(见图F、G),癌组织位于囊壁外侧。2.支气管囊肿。免疫组织化学: CKp(+),CK5/6(+),TdT(-),CKh(),Ki-67指数约30%,P63(+)。特殊染色结果:AB/PAS(+)。现随访1月余,未见肿瘤复发及转移征象。
讨 论
黏液表皮样癌最早由Steward于1945年首先报道并命名[10],于腮腺、下颌下涎腺及口腔黏膜下的小唾液腺多见,其次在肺、食管、乳腺及皮肤中均有报道。但胸腺黏液表皮样癌于1980年以后才被报道[11-12],目前国外报道不超过30例,国内报道7例[3-9]。有文献报道黏液表皮样癌的发生与t(11;19)染色体易位和MECT1-MAML2(mucoepidermoid carcinoma translocated 1-mastermind-like 2, MECT1-MAML2)基因重排,最常见的染色体易位是t(11;19)(q21;p13)。t(11;19)(q21;p13)染色体涉及的两个基因MECT1、MAML2分别位于19p13和11q21。这种易位产生一个新的融合产物,即MECT1-MAML2。它融合了MECT1的外显子1和MAML2的外显子2~5。MECT1-MAML2融合蛋白产物,对Notch信号通路阻断,激活cAMP/CREB(cAMP response element-binding protein, CREB)转录,从而阻断Notch和CREB信号转导通路,诱导肿瘤的发生[13]。Roden等[14]报道了2例胸腺黏液表皮样癌也存在MAML2基因重排,MAML2基因重排可作为黏液表皮样癌与鳞癌和腺鳞癌的鉴别诊断中一项依据,可能存在其他通路诱导胸腺黏液表皮样癌的发生。
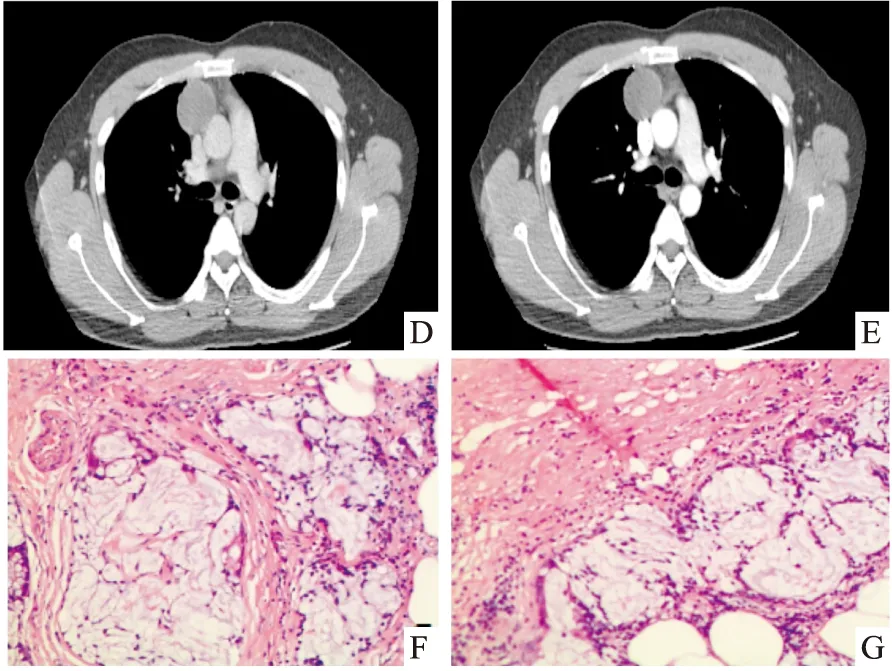
图D、E CT示前纵隔偏右见一囊状低密度影,囊壁见斑点状钙化影 图F、G 术后病理,HE × 100,镜下癌组织中见表皮样细胞及黏液细胞,并可见大量黏液
胸腺黏液表皮样癌(TMEC)是一种罕见的胸腺癌,占胸腺恶性肿瘤的2%~3%[1-2]。研究显示它的发病年龄在8~84岁,年龄在40~60岁之间的患者中多见。胸腺黏液表皮样癌的临床症状与肿瘤的大小及位置,主要是肿瘤对周围组织压迫,早期因肿瘤体积较小对周围组织无明显侵犯,无明显临床症状,待肿瘤逐渐增大后对周围组织压迫时多表现为胸闷、气短、胸骨后疼痛,若肿瘤继续增大时可出现颈部、颜面部肿胀,声音嘶哑和膈肌膨升等表现,全身可有乏力及体重减轻等表现[15]。Woo等[16]报道1例重症肌无力的胸腺黏液表皮样癌,手术切除后重症肌无力症状仍然存在。本文中2组病例均为男性,1例临床表现为气短,1例为体检发现,与文献报道基本吻合。
胸腺黏液表皮样癌与其他胸腺病变相比并无临床特异性,影像学表现亦无特异性。胸腺黏液表皮样癌影像学表现可分为囊性肿块和实性肿块,边界清楚,病变组织密度不均匀,部分增强后有明显不均匀强化,强化明显部分与血管相仿。本文中病例1患者行胸部增强CT后可见轻度强化,病例2患者行胸部增强CT后无明显强化,与文献[3]报道相符合。
考虑胸腺黏液表皮样癌目前多为个案报道,根据胸腺黏液表皮样癌的临床症状,影像学表现并无明显特异性。对于TMEC的术前诊断比较困难,诊断主要依靠组织病理学形态特点及免疫组织化学染色。TMEC的组织学特征与唾液腺等部位相似。显微镜下可见表皮样细胞、黏液细胞及中间细胞,也可见嗜酸性细胞。邻近肿瘤的非肿瘤性胸腺组织可见囊性变或黏液性化生[17]。贾雯等[4]报道肿瘤主要由片状分布的表皮样细胞、黏液细胞及中间细胞构成。黏液细胞呈灶状或散在分布,中间细胞常呈实性条索或片状;表皮样细胞呈巢状或片状排列,部分区域形成囊腔,细胞界限清楚。周围组织汇总可见萎缩胸腺组织。胸腺黏液表皮样癌根据肿瘤内囊实性成分所占比例不同、细胞异型性、核分裂像及是否伴有神经侵犯和坏死的情况分为:低度恶性、中度恶性、高度恶性[18-19]。也可根据肿瘤细胞多表现大小、核分裂像多少以及相关细胞分化特点的显现等可将肿瘤分为高、中、低分化三种类型。
胸腺瘤与胸腺癌采用Masaoka分期系统[20]。分期如期:Ⅰ期:包膜完整,镜下无包膜浸润;Ⅱa期:镜下包膜浸润,Ⅱb期:肿瘤浸润包膜外纵隔脂肪或肿瘤与临近胸膜,心包粘连;Ⅲ期:侵犯邻近组织器官;Ⅳa期:胸膜与心包种植播散,Ⅳb期:远处淋巴结及血行转移。因此根据Masaoka分期并结合组织学分型判断预后是有效的,高级别的患者5年生存率较低。
TMEC的治疗首选手术完整切除病灶、局部淋巴结清扫及尽可能切除周围受侵犯的组织器官。手术方式多采用胸骨正中切口、前外侧、后外侧切口或腋下切口开胸手术,胸腔镜手术或达芬奇手术。胸腔镜手术具有创伤小、疼痛轻、并发症少及恢复快等优势,随着技术不断的发展,达芬奇机器人手术具有病灶定位更精确、创伤更小、操作更灵活,切除更彻底等优势。但手术切除是治疗低级别肿瘤的首选治疗方案,考虑高级别(低分化)局部侵袭强和易远处转移,因此对高级别(低分化)或有复发的TMEC,外科手术将病灶切除后还需积极行放疗和化疗,延长患者生存期。Liu等[21]报道胸腺癌对放疗敏感度较高,并报告术后放疗可使局部复发率降低至17%,对TMEC可以选择用放疗,延长患者生存期。Fuse等[22]报道称伊立替康+顺铂联合的化疗方案,患者出现3个月的完全缓解。因此对不能手术的患者,采用放疗及化疗结合的治疗方案,延长患者生存期。TMEC预后普遍较差,高中分化生存时间较低分化型长。本文中病例1患者病灶侵犯胸膜,术后行放疗,随访4年,未见肿瘤复发及转移。
综上所述,胸腺黏液表皮样癌发病率低且临床症状、体征和影像学检查均无明显特异性。诊断主要依靠术后病理及免疫组织化学结果。目前对于胸腺黏液表皮样癌的治疗首选手术完整切除。TMEC预后普遍较差,高中分化生存时间较低分化型长,因此对TMEC采用手术治疗及放疗、化疗,改善患者生存质量,延长患者生存时间。本文中病例1因病灶较大,与周围组织及器官粘连,因此选择胸骨正中切口,病例2因病灶较小,与周围组织界限较为清晰,故选择达芬奇手术,患者术后恢复好。但手术具体选择哪种手术方式,需要临床医师慎重考虑。

