氯喹对雄性克罗恩病模型小鼠肠炎的治疗作用与机制
朱玉可,徐子龙,何逸凡,周昌旻,沈梦迪,王璐瑶,李 静,张小凤,2
(蚌埠医学院1.第一附属医院中心实验室;2.组织与移植安徽省重点实验室;3.第一附属医院检验科,安徽 蚌埠 233004)
克罗恩病(Crohn’s disease,CD)是炎症性肠病(inflammatory bowel disease,IBD)的一种,近年来在我国的发病率呈逐年上升的趋势[1]。CD的主要病理学改变为非特异性、肉芽肿性炎症,病变可累及口腔至肛管整个消化道,但主要以回肠和结肠为主。虽然手术可以切除病变肠管但仍无法治愈该病,患者仍然面临术后复发的问题。采用药物诱导缓解和维持缓解仍是CD的主要治疗方式。然而遗憾的是,当前针对CD治疗的药物均存在一定程度不足,更为安全、有效的药物亟待开发。氯喹(Chloroquine,CQ)是一种经典的抗疟原虫药物,但新近的报道显示CQ还具有抗炎和免疫调节作用[2],且已被证实对多种免疫相关性疾病有治疗作用,例如:系统性红斑狼疮(SLE)、艾滋病(AIDS)等。CD也是一种免疫相关性疾病,而CQ在CD领域的研究还并不充分。本研究采用IL-10-/-小鼠作为CD动物模型[3],观察CQ对CD样肠炎的作用效果及可能机制,重点探讨对小鼠肠黏膜免疫及肠屏障功能的影响,以期为CD的药物治疗提供参考。
1 材料与方法
1.1 材料选取15周龄雄性IL-10-/-小鼠及野生型小鼠(wild type,WT),饲养于SPF级环境(组织移植安徽省重点实验室),体重为(28~32)g,环境温度为(23±2)℃,小鼠自由饮水,常规饲料喂养。CQ、异硫氰酸(FITC)-葡聚糖购于Sigma Chemicals公司(St. Louis, MO, USA);肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白介素-6(interleukin-6,IL-6)、转化生长因子-β(transforming growth factor-β, TGF-β)及酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)试剂盒购于R&D公司(Emeryville,CA,USA);Claudin、Occludin、p-JAK2、p-STAT3、JAK2、STAT3及β-actin一抗够买于R&D公司(Emeryville、CA、USA)。
1.2 干预方法15周龄IL-10-/-小鼠随机分为氯喹治疗组(CQ组,n=8)和模型组(Model组,n=8)。CQ组干预方法:单次给药剂量为100mg/kg体质量,药物溶于0.2mL生理盐水中,灌胃给药,1次/d[4];Model组每日给予0.2mL生理盐水灌胃。另取8只WT小鼠作为正常对照,仅用于证实IL-10-/-小鼠自发性肠炎的存在。干预4周后处死小鼠并进行相关的检测分析。
1.3 观察指标及检测方法
1.3.1 评估CQ干预对IL-10-/-小鼠肠道炎症的影响 (1)肠炎组织学评分:小鼠结肠组织经HE染色后在光学显微镜下观察并参考Spencer推荐的炎症评分(inflammatory score)[5],对两组小鼠结肠组织的炎症程度进行评估,每张切片选取三个不同的视野分别评分,评分量为0分~4分,炎症越重评分越高,最后取平均数作为最终的评分结果。(2)检测两组小鼠结肠组织炎症介质水平:采用ELISA检测小鼠结肠组织中TNF-α、IL-6以及TGF-β的含量,具体操作参照ELISA试剂盒说明书。
1.3.2 流式细胞检测实验 分离小鼠肠系膜淋巴结,置于5mL 1640培养基中,用玻璃匀浆器研磨,PBS洗一遍,200目滤网过滤掉组织,分离出的单个核细胞采用台盼蓝染色计数,取2×106个细胞接种于48孔板中,加细胞刺激剂及BFA孵育6h,收集细胞进行表面染色及细胞内细胞因子染色,检测Th1(CD3+、CD4+、IFN-γ+)、Th17(CD3+、CD4+、IL-17A+)、Treg(CD4+、CD25+、Foxp3+)细胞比例,并用FlowJo-V10软件对结果进行分析。
1.3.3 肠通透性检测实验 小鼠禁食4h后,用大分子物质FITC-葡聚糖分别对两组小鼠进行灌胃处理,剂量为600mg/kg,待4h后通过颈椎脱臼的方法处死小鼠并从心脏抽取1mL血液,室温下放置1h后分离血清分光光度计(490nm)检测血清中FITC含量。
1.3.4 免疫荧光检测实验 组织切片脱蜡水化后,使用柠檬酸盐抗原修复液进行抗原修复(高压10min),置于室温中冷却。去离子水室温条件下孵育20min,除去内源性过氧化物酶。封闭用山羊血清工作液覆盖于组织面上,37℃温箱孵育20min后倒去血清,勿洗。滴加一抗工作液(兔单克隆Claudin抗体及兔单克隆Occludin抗体,稀释浓度1∶200)覆盖于组织表面,4℃过夜。荧光二抗覆盖于组织表面(山羊抗兔IgG H&L,稀释浓度1∶200),37℃温箱孵育45min(避光)。在黑暗条件下吸弃二抗 (不再冲洗),加入DAPI染液(2.5μg/mL),室温孵育20min,在黑暗条件下使用抗荧光淬灭封片剂封片,荧光显微镜下观察实验结果。
1.3.5 Western blot检测实验 提取胞浆及核蛋白,经Bradford定量,煮沸变性后,每孔加入35μg蛋白,经电泳、转膜、封闭后,再加入Claudin、Occludin、JAK2、STAT3、p-JAK2、p-STAT3和β-actin一抗稀释液(1∶1000),放置在4℃摇床,12h后滴加二抗,洗膜,滴加ECL显影液,即可对结果进行分析。
1.4 统计学分析用SPSS 23.0软件对实验数据进行分析,用“均数±标准差”表示计量资料,组间的比较采用t检验。P<0.05表示差异具有显著性。
2 结果
2.1 CQ干预对IL-10-/-小鼠肠道炎症的影响如图1所示,正常WT小鼠结肠黏膜形态完好,未见明显炎症细胞浸润;Model组小鼠结肠黏膜见大量炎症细胞浸润,部分区域融合成团(图1A黑色箭头处);CQ组小鼠结肠黏膜内可见少量炎症细胞浸润。CQ组小鼠结肠组织炎症评分显著低于Model组(P<0.05);促炎因子TNF-α和IL-6水平显著低于Model组(P<0.05),抗炎因子TGF-β水平显著高于Model组(P<0.05)。

图1 CQ干预对克罗恩病模型小鼠肠道炎症的影响
注:A为小鼠结肠组织HE染色结果(×200);B为小鼠结肠炎症评分的统计学比较;C为小鼠肠系膜淋巴结炎症介质水平的统计学比较。vs Model组,aP<0.05
2.2 CQ干预对IL-10-/-小鼠肠黏膜免疫反应的影响
如图2所示:CQ组小鼠的Th1、Th17细胞比例显著低于Model组(P<0.05),Treg细胞比例显著高于Model组(P<0.05)。

图2 CQ干预对克罗恩病模型小鼠免疫系统的影响
注:A和B为两组小鼠Th1细胞含量的比较;C和D为两组小鼠Th17细胞含量的比较;E和F为两组小鼠Treg细胞含量的比较。vs Model组,aP<0.05
2.3 CQ干预对IL-10-/-小鼠肠屏障功能的影响
如图3所示:CQ组小鼠肠黏膜对FITC-葡聚糖的通透性较Model组显著降低(P<0.05)。

图3 CQ干预对克罗恩病模型小鼠肠黏膜屏障通透性的影响
注: vs Model组,aP<0.05
2.4 CQ干预对IL-10-/-小鼠肠黏屏障结构的影响
如图4所示:CQ组小鼠肠粘膜细胞紧密连接蛋白Claudin和Occludin的蛋白表达量显著高于Model组(P<0.05)。
2.5 CQ干预对IL-10-/-小鼠JAK2/STST3信号通路的影响如图5所示:CQ组小鼠肠黏膜JAK2/STAT3的磷酸化水平显著低于Model组(P<0.05)。
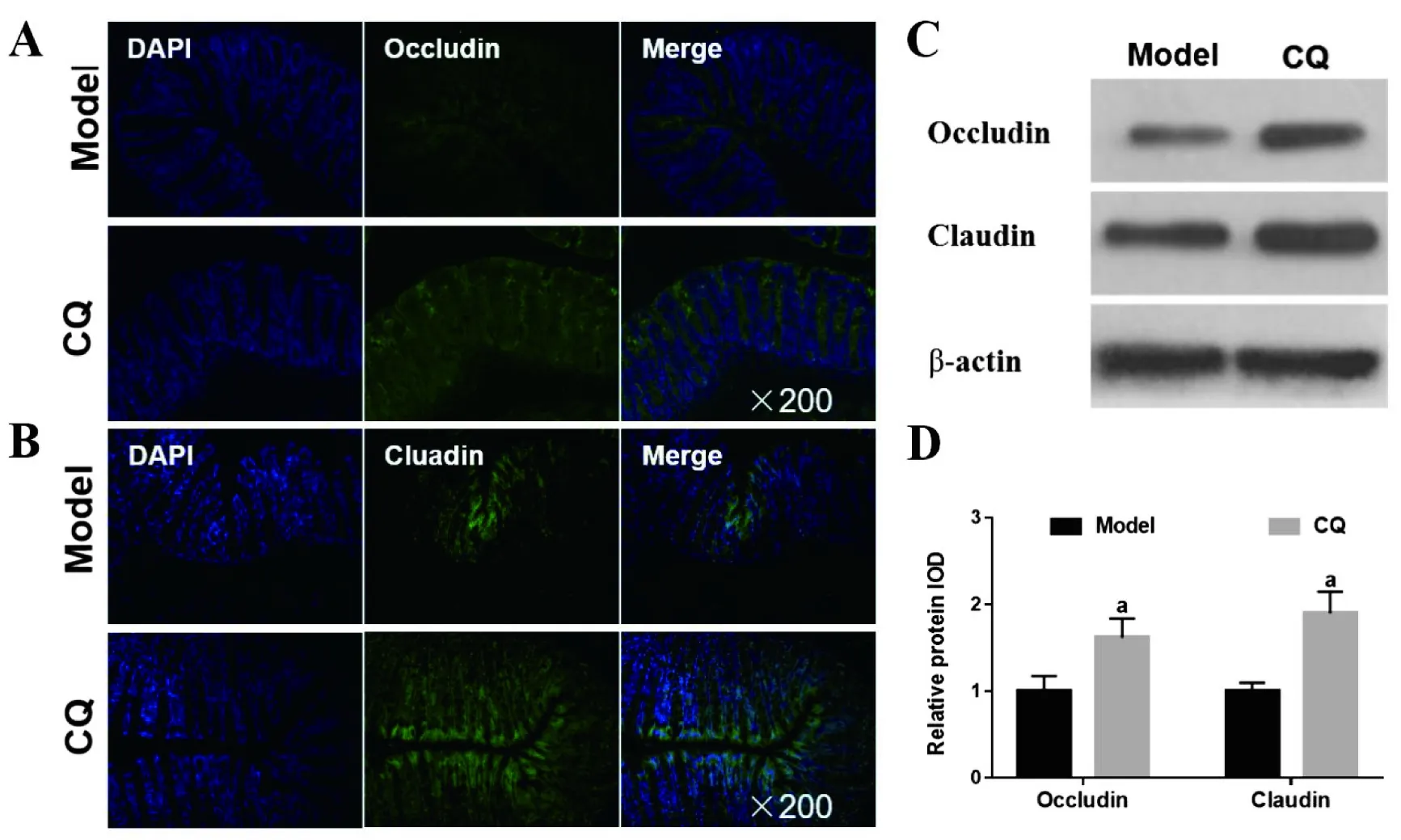
图4 CQ干预对克罗恩病模型小鼠肠黏膜屏障结构的影响
注:A和B为两组小鼠结肠黏膜上皮细胞紧密连接蛋白Claudin和Occludin的表达情况;C为两组小结肠黏膜紧密连接蛋白Claudin及Occludin的Western blot半定量检测结果;D为两组小鼠结肠黏膜紧密连接蛋白Claudin及Occludin表达水平的统计学比较。 vs Model组,aP<0.05

图5 CQ干预对克罗恩病模型小鼠肠黏膜信号通路的影响
注:A为两组小鼠的肠黏膜JAK2/STAT3 信号通路蛋白的Western blot半定量检测结果;B为两组小鼠的肠黏膜JAK2/STAT3 信号通路蛋白表达水平的统计学比较。vs Model组,aP<0.05
3 讨论
既往,CD主要见于欧美高加索人种,但近年来包括我国在内的亚洲地区发病率呈现逐年升高的趋势[6],而与患者日渐增多形成反差的是相对落后的诊疗水平。当前,在我国提高CD的治疗效果具有迫切的现实意义。虽然CD的发病机制并不明确,但肠黏膜免疫异常及肠屏障功能受损是最受认可的发病机制假说之一。围绕这一靶点进行药物治疗探索,有望为CD治疗提供新的选择。鉴于CQ的抗炎和免疫调节功能,我们尝试分析其是否对CD这种免疫性肠炎具有疗效,并进一步分析可能的机制。
本研究选用IL-10-/-小鼠作为CD的动物模型。该品系小鼠在SPF级环境中,饲养至第15周时可形成稳定的、持续性的结肠炎[3]。CQ干预结束后,我们分析发现CQ可显著抑制IL-10-/-小鼠结肠炎症,黏膜中促炎介质IL-6和TNF-α水平显著降低,而抗炎因子TGF-β水平显著升高,这一组结果提示CQ对CD样肠炎具有一定治疗效果。CD肠黏膜免疫反应类型以Th1、Th17为主,而Treg在免疫炎症的发生过程中起抑制作用[7]。通过FCM检测我们发现CQ组小鼠肠系膜淋巴结中Th1和Th17的细胞比例显著减少,而Treg的细胞比例显著升高,这提示CQ具有显著的免疫调节功能。肠屏障受损是CD疾病发生的重要环节,因此维持良好的肠屏障功能可有效地控制和缓解CD的病情发展[8-9]。通透性实验证明CQ干预后小鼠的肠屏障功能得到了显著的改善;IF及Western blot结果显示CQ干预后增加了小鼠肠黏膜紧密连接蛋白Claudin及Occludin的表达量,这提示CQ干预后小鼠的肠屏障结构得到了显著的保护。JAK2/STAT3是调控炎症的关键信号通路,其下游产生的炎症介质IL-6和TNF-α等具有直接破坏肠黏膜屏障的作用;并可引发炎症级联放大,诱发急性炎症和维持慢性炎症[10-11],Western blot结果显示CQ组p-JAK2和p-STAT3的水平显著低于Model组,这说明CQ干预抑制了JAK2和STAT3的磷酸化激活,这可导致IL-6 和TNF-α等促炎介质释放减少,从而减轻对肠黏膜紧密连接蛋白的破坏[12],这提示CQ可能通过抑制JAK2和STAT3的磷酸化激活而发挥对肠黏膜屏障的保护作用。
我们的研究结果具有潜在的临床应用价值。目前CD的常规治疗药物有氨基水杨酸类,糖皮质激素类、免疫调节剂类及生物制剂类[13],虽然可选治疗药物种类很多,但仍然存在效果不稳定、药物抵抗以及毒副作用大等问题,临床上仍要开发高效、低毒的新药物以满足不断增长的治疗需求[14]。
我们的研究存在不足之处:虽然研究选择的IL-10-/-小鼠为国际公认CD动物模型[3],但研究设计之初并没有设置正常对照组以证实所选择模型具有自发性肠炎。本研究仅是增补了正常小鼠结肠组织HE染色,这虽然可以确定所选择的CD模型存在自发性肠炎,但无法证明CQ干预IL-10-/-小鼠后肠炎改善的程度等情况,我们将在今后的研究中考虑更为全面和深入地评估CQ对肠炎的影响与机制。
综上,CQ可通过调节肠黏膜免疫反应及保护肠屏障功能发挥改善CD样肠炎的作用,其作用机制可能部分与抑制JAK2/STAT3信号通路有关。

