应用正交设计优选二歧鹿角蕨球状体分化培养基研究
叶秀仙 方能炎 吴建设 钟淮钦

摘 要:为筛选二歧鹿角蕨球状体分化培养的最佳培养基,建立鹿角蕨球状体分化培养技术体系。以二歧鹿角蕨孢子萌发的绿色球状体为芽分化培养材料,采用正交设计法研究基本培养基、IBA、活性炭(AC)和白糖4种因素对鹿角蕨球状体分化培养的影响,结果表明:各试验因素对鹿角蕨球状体分化培养影响的主次关系为基本培养基>IBA>AC>白糖;筛选出适宜二歧鹿角蕨绿色球状体(GGB)分化的培养基配方为HD2基本培养基+ IBA 0.5 mg·L-1+AC 0.5 mg·L-1+白糖30.0 g·L-1,培养56 d,芽分化系数达6.7,有效提高了其繁殖效率,为种苗规模化育苗提供了技术保障。
关键词:鹿角蕨;球状体;正交设计;快速繁殖
中图分类号:Q943.1 文献标志码:A 文章编号:0253-2301(2020)02-0024-04
DOI:10.13651/j.cnki.fjnykj.2020.02.005
Abstract:In order to select the best medium for the spheroid differentiation culture of Platycerium bifurcatum, a technical system for the spheroid differentiation culture of Platycerium wallichii Hook. was established. The green globularbodies (GGB) germinated from Platycerium bifurcatum spores were used as the culture material for bud differentiation, and the effects of basic medium, IBA, activated carbon and white sugar on the spheroid differentiation culture of Platycerium wallichii Hook. were studied by using the orthogonal design method. The results showed that the primary and secondary relationship of the effect of each factor on the spheroid differentiation culture of Platycerium wallichii Hook. was basic medium>IBA>AC>white sugar. The medium formula suitable for the GGB differentiation of Platycerium bifurcatum was selected as HD2 basic medium+ IBA 0.5 mg·L-1+AC 0.5 mg·L-1+white sugar 30.0 g·L-1. The culture was conducted for 56 d and the coefficient of bud differentiation was up to 6.7, which effectively improved its reproductive efficiency and provided technical guarantee for largescale culture of seedlings.
Key words:Platycerium wallichii Hook;Spheroid;Orthogonal design;Rapid propagation
鹿角蕨Platycerium wallichii Hook.为鹿角蕨科鹿角蕨属多年生常绿草本植物,原产于中国云南西南部盈江县那邦坝,海拔210~950 m山地雨林中,缅甸、印度东北部、泰国也有分布,该种已列入国家二级保护植物[1-2]。其株型奇特,姿态优美,是观赏蕨中姿态最为奇特的一类蕨类植物。鹿角蕨常作为室内垂吊或壁挂的观赏植物,在公园、植物园等地方的装饰与布置十分流行,也是室内观叶中珍贵稀有的精品,亦是室内立体绿化的好材料,雅致而充满异国风情,深受喜爱,应用前景广阔。目前,鹿角蕨的繁殖方法主要以分株繁殖和孢子繁殖为主,但分株繁殖系数小,孢子自然萌发率低,极大限制了鹿角蕨的应用,而采用组织培养技术可以解决快速繁殖育苗问题。
目前,关于鹿角蕨组织培养快速繁殖方面的研究国内已有一些报道[3-9]。金建平等[3]研究表明对生鹿角蕨的孢子萌发及原叶体发育的最佳培養基为1/2MS培养基,最佳原叶体增殖培养基为1/2MS+KT 2.0 mg·L-1+蔗糖20 g·L-1,pH值5.8,最佳培养条件为培养温度 25℃左右,光照时间 16 h·d-1,光照强度2000 lx。黄韶玲等[4]研究发现,以鹿角蕨幼孢子体作为外植体,诱导GGB的培养基为MS+6BA 0.05 g·L-1+IBA 0.05 mg·L-1或 MS+6BA 0.01 g·L-1+IBA 0.2 mg·L-1,诱导丛芽及继代培养基为MS+IAA 0.25 mg·L-1,生根培养基为1/2MS。王承义等[5]报道细胞分裂素、蔗糖对鹿角蕨芽分化的影响,认为6BA适宜不定芽分化,30 g·L-1用糖量为最优。林证明等[6]报道以二叉鹿角蕨无菌孢子体幼苗叶片或茎尖接种到改良MS+6BA 0.1~1.0 mg·L-1+NAA 0.1~0.5 mg·L-1培养基上,20 d左右形成绿白色愈伤组织,120 d左右形成肉眼可见的丛生芽。黄执缨[7]以二歧鹿角蕨幼嫩真叶为外植体,建立了鹿角蕨组织培养技术,筛选出适宜幼嫩真叶诱导球状体(GGB)的培养基为MS+6BA 0.1 mg·L-1+IBA 0.05 mg·L-1,GGB诱导丛生芽适宜的培养基为 MS+KT 0.5 mg·L-1 +IAA 0.5 mg·L-1,生根培养基为1/2MS+NAA 0.1 mg·L-1。可见,不同基因型的鹿角蕨,不同研究者研究报道结果不尽相同。本研究以二歧鹿角蕨孢子萌发形成的GGB为外植体,采用正交设计试验方法,探讨影响GGB分化培养的关键因素,建立其GGB分化培养技术体系,为鹿角蕨种苗繁育及遗传转化等相关研究提供技术保障。
1 材料与方法
1.1 材料
以二歧鹿角蕨Platycerium bifurcatum孢子萌发形成的绿色球状体 (Green globularbodies,GGB)作为芽分化培养材料。试验在福建省特色花卉工程技术研究中心花卉育种实验室进行。
1.2 方法
1.2.1 接种方法 选取生长均匀一致的鹿角蕨GGB团块,切割成大小0.5 cm×0.5 cm,接种到分化培养基中,每瓶接入GGB团块10个,接种完毕置于培养室培养架上进行光培养。
1.2.2 试验设计 分化培养基采用L9(34)正交设计[10],以基本培养基、IBA、AC、白糖为试验因子,各因子设3个水平,详见表1。各处理培养基均附加琼脂粉5.0 g·L-1。每处理接种5瓶,3次重复,共9个处理。
其中,HD1基本培养基的组分为:花宝1号1.8 g·L-1、KNO3 0.95 g·L-1、(NH4)2SO4 0.85 g·L-1、KH2PO4 0.25 mg·L-1、MgSO4·7H2O 0.25 g·L-1、CaCl2·2H2O 0.4 g·L-1、FeSO4·7H2O 27.8 mg·L-1、Na2·EDTA 37.3 mg·L-1、VB1 10.0 mg·L-1、VB5 5.0 mg·L-1、VB6 1.0 mg·L-1、甘氨酸2.0 mg·L-1、肌醇150 mg·L-1。
HD2基本培养基的组分为:花宝1号1.2 g·L-1、KNO3 0.95 g·L-1、(NH4)2SO4 0.85 g·L-1、KH2PO4 0.25 mg·L-1、MgSO4·7H2O 0.25 g·L-1、CaCl2·2H2O 0.2 g·L-1、MnSO4·H2O 16.9 mg·L-1、ZnSO4.7H2O 8.6 mg·L-1、H3BO3 6.2 mg·L-1、KI 0.83 mg·L-1、Na2MoO2·2H2O 0.25 mg·L-1、CoCl2·6H2O 0.025 mg·L-1、CuSO4·5H2O 0.025 mg·L-1、FeSO4·7H2O 27.8 mg·L-1、Na2·EDTA 37.3 mg·L-1、VB1 5.0 mg·L-1、VB5 3.0 mg·L-1、VB6 1.0 mg·L-1、甘氨酸2.0 mg·L-1、肌醇180 mg·L-1。
1.2.3 培养方式与培养条件 采用固体培养基培养方式, pH值5.6~5.8,培养温度为(24±3)℃,光强为1500~2000 lx,光照时间为10~12 h·d-1。
以上试剂均为国药集团化学试剂有限公司生产的分析纯试剂,白糖为厦门古龙牌优质白砂糖;琼脂粉强度1400 g·cm-2;花宝1号产地美国,其N、P、K质量比7∶6∶19。
1.2.4 观测指标与数据分析 每隔14 d对GGB生长情况进行观察,增殖培养56 d时,统计分化丛生芽的GGB团块数、每块GGB分化芽数,分化系数=分化芽总数/ GGB接种团块数[7]。数据统计采用正交设计助手V3.1软件进行分析。
2 结果与分析
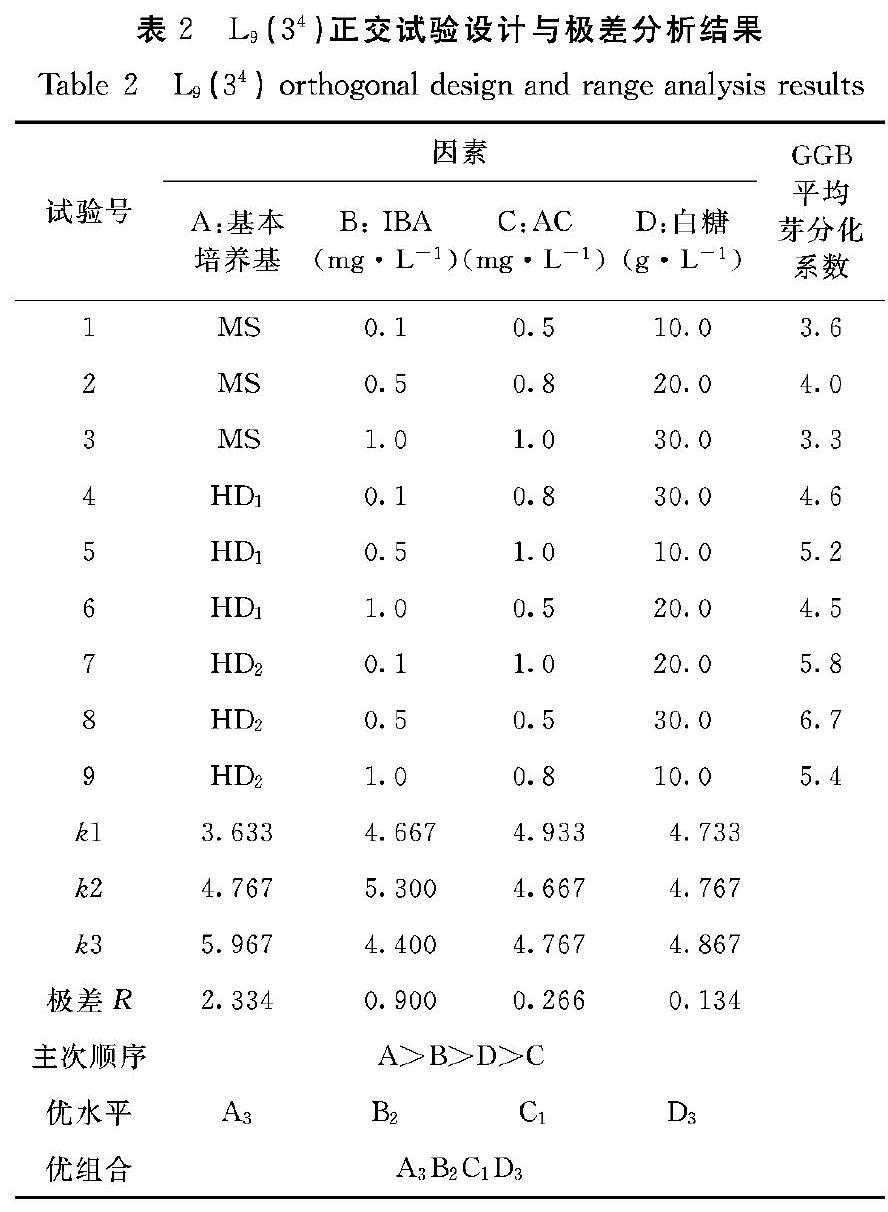
接种14 d时,GGB切口及表面部位开始萌动芽点,28 d时不同处理组陆续分化出芽。培养56 d时,观察与统计GGB分化生长情况,试验统计分析结果见表2、表3。
2.1 不同因素与水平对GGB分化培养的极差分析结果
表2结果表明,从k值大小可以看出,MS、改良1号、改良2号基本培养基对鹿角蕨GGB分化芽影响效果表现为HD2>HD1>MS,说明改良2号成分对芽分化作用较大,以HD2为基本培养基较好;IBA对鹿角蕨GGB分化芽影响效果表现为0.5 mg·L-1IBA>0.1 mg·L-1IBA>1.0 mg·L-1 IBA,其中以0.5 mg·L-1 IBA处理对芽分化效果较好;AC与白糖因素k值大小差异不大,AC适宜浓度为0.5 g·L-1,白糖为30.0 g·L-1。从极差R值大小可以看出,不同因素对GGB分化培养影响的主次关系为A>B>C>D,这说明对鹿角蕨GGB分化起主要作用的是基本培养基,其次是IBA,白糖和AC對芽分化的影响较小。鹿角蕨GGB最佳处理组合是A3B2C1D3,即HD2+IBA 0.5 mg·L-1+AC 0.5 g·L-1+白糖30.0 g·L-1,分化培养56 d,芽分化系数达6.7。
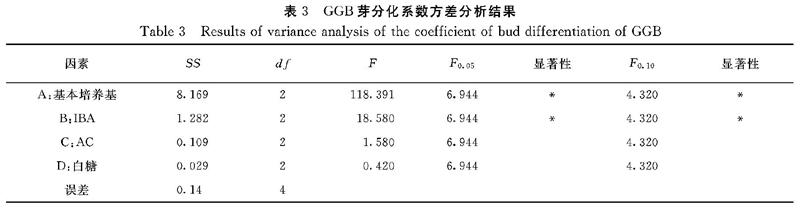
2.2 不同因素与水平对GGB分化培养的方差分析结果
从表3可知,基本培养基和IBA两个因素均显著影响鹿角蕨GGB芽分化系数,但其影响程度的大小有较大差异,表现为基本培养基>IBA,白糖和AC因素无显著影响,与极差分析结果基本一致。
3 讨论与结论
采用鹿角蕨孢子无菌萌发形成绿色球状体(Green globularbodies,GGB)的快速繁殖途径是鹿角蕨组织培养的重要途径。孢子数量具大,以孢子为外植体,取材方便,但由于孢子颗粒极其微小,且裸露于空气中,孢子消毒灭菌到成功萌发是至关重要的环节,笔者在实践中已取得较好成效,同时获得大量GGB,而GGB分化芽的效率直接影响鹿角蕨育苗速度,同时培养基配方的合理选择是GGB分化培养的关键,通过GGB的增殖与分化可以在短时间内实现鹿角蕨试管苗的大量繁殖。
针对不同基因型鹿角蕨,不同研究者的研究报道结果不尽相同[11-13],其中培养基类型、植物生长调节剂的种类和浓度等因素均影响鹿角蕨GGB的增殖与分化。因此,开展特定基因型材料组织培养时, 要摸索适合于外植体材料特点的培养基配方,提高育苗效率。
正交试验设计在植物组织培养试验中已广泛应用[14-16],尤其在培养基配方筛选方面,笔者在文心兰、秋石斛、花叶金线莲等兰花组培培养基优选,皆取得较好的成效[14-18]。本研究选择基本培养基、IBA、AC和白糖为关键试验因素,探索和优化了二歧鹿角蕨球状体分化培养技术。试验结果表明对鹿角蕨GGB分化起主要作用的是基本培養基,其次是IBA,白糖和AC对芽分化的影响较小,GGB分化适宜的培养基为HD2+IBA 0.5 mg·L-1+AC 0.5 g·L-1+白糖30.0 g·L-1,培养56 d,芽分化系数达6.7,为种苗繁育提供了技术保障。关于影响鹿角蕨GGB分化的其他培养因素有待进一步研究。
参考文献:
[1]于永福.中国野生植物保护工作的里程碑:国家重点保护野生植物名录(第一批)出台[J].植物杂志,1995(5):3.
[2]沈晓岚,王炜勇,俞信英.鹿角蕨属植物研究进展[J].现代农业科技,2008(12):32-47.
[3]金建平,兰涛,顾姻.新几内亚鹿角蕨的孢子不完全组织培养[J].植物生理学通讯,1992(3):112.
[4]黄韶玲,张洁莲.鹿角蕨的组织培养[J].植物生理学通讯,1993(1):46-47.
[5]王承义,王颖. 鹿角蕨的组织培养[J].中国林副特产,2000(3):23-24.
[6]林证明,陈晔,韦丽娜,等.二叉鹿角蕨商品化育苗技术研究[J].江苏林业科技,1998(S1):177-180.
[7]黄执缨.二歧鹿角蕨组织培养的研究[J].生物学杂志,2004,21(5):22-24.
[8]郭捡,王玥,郭梦桥,等.鹿角蕨有性世代发育及繁殖技术研究[J].中国农学通报,2012,28(5):216-219.
[9]郭捡,刘婷婷,孟宪利,等.鹿角蕨孢子的培养及其繁殖[J].园艺学报,2013, 40(1):155-162.
[10]盖均镒.试验统计方法[M].北京:中国农业出版社,2000:382-383.
[11]孙全,朱小燕,梁婷,等.应用正交试验优选茎瘤芥子叶组培诱导培养基[J].安徽农业科学,2011,19(34):20961-20962,21020.
[12]游恺哲,陈健,林冠雄,等.正交设计在成龄番木瓜组织培养研究中的应用[J].福建农业科技,2003(3):11-12.
[13]于永明,王军辉,张宋智,等.二次回归正交设计在楸树离体生根培养中的应用[J].南京林业大学学报:自然科学版,2011,35(4):47-50.
[14]叶秀仙,黄敏玲,罗远华,等. 应用正交设计优化文心兰丛生芽增殖培养体系[J].福建农业学报,2013,28(9):897-901.
[15]叶秀仙,黄敏玲,罗远华,等.盆花文心兰组培快繁技术研究[J].福建农业学报,2016,31(11):1198-1203.
[16]叶秀仙,林榕燕,陈艺荃,等.秋石斛离体快速繁殖技术研究[J].福建农业学报,2017,32(8):874-879.
[17]叶秀仙,林榕燕,黄敏玲,等.秋石斛原球茎液体增殖培养研究[J].福建农业学报,2017,32(9):959-962.
[18]叶秀仙,陈艺荃,钟淮钦,等.花叶金线莲茎段诱导植株再生培养技术研究[J].福建农业学报,2018,33(3):258-262.
(责任编辑:柯文辉)

