葡萄ISSR—PCR反应体系的建立与正交设计优化
张娜+李群+高兴旺+赖晓辉+李佳+丁金鹏
摘要:建立和优化稳定的葡萄ISSR-PCR反应体系,为进一步开展葡萄遗传多样性研究和品种选优提供理论依据。运用改良的CTAB法从葡萄嫩叶中提取基因组总DNA,通过单因素试验分析dNTPs浓度、Mg2+浓度、引物浓度、DNA模板用量、Taq DNA聚合酶用量等5个因素对葡萄ISSR-PCR反应体系扩增结果的影响,并采用正交设计试验方法优化建立葡萄ISSR-PCR最佳反应体系。优化的最佳ISSR-PCR反应体系(20 μL)为:10×PCR buffer、0.225 mmol/L dNTPs、Taq DNA聚合酶1.0 U、1.00 μmol/L引物、2.75 mmol/L Mg2+、DNA模板30 ng。利用优化的ISSR-PCR 反应体系能够扩增获得清晰、稳定的DNA条带,可用于后续的葡萄种质资源遗传多样性分析。
关键词:葡萄;ISSR-PCR;反应体系;单因素试验;正交设计;优化
中图分类号: S663.103 文献标志码: A
文章编号:1002-1302(2016)09-0047-04
葡萄属于葡萄科(Vitaceae)葡萄属(Vitis L.)藤本植物,是起源最古老的果树之一,其果实可用于酿酒、鲜食、制汁等,具有重要的经济价值,在世界范围内广泛栽培。由于葡萄的基因组高度杂合,使得其具有丰富的种质资源。种质资源是进行农业生产和创新育种的重要物质保障,也是解决各种病虫害问题有利的“基因武器库”。因此,充分了解葡萄种质资源的遗传信息、分析其种质资源遗传多样性,对有效利用现有的葡萄种质资源以及促进和加快葡萄分子育种进程具有重要意义。目前,分子标记技术已广泛应用于葡萄遗传多样性研究,以期为进一步开展葡萄分子育种奠定了一定的基础。黄远飞利用RAPD技术对53份葡萄材料进行遗传多样性分析,发现53份葡萄材料间具有较高的遗传多样性[1]。吴子龙等建立了葡萄SSR标记和ISSR的反应体系,并研究了葡萄种质资源的遗传多样性[2-3]。张淑静利用SSR技术分析了39份葡萄品种的遗传多样性,发现这些材料间存在明显的遗传多态性差异[4]。郭大龙等建立了适用于葡萄的SRAP反应体系,为葡萄种质遗传多样性评价、遗传改良等研究提供了基础[5]。张君玉等建立了葡萄的目标起始密码子多态性的反应体系,可用于葡萄种质遗传多样性评价[6]。赖呈纯等也分别建立了适用于葡萄的ISSR-PCR反应体系。ISSR标记技术结合了SSR和RAPD等2种标记技术的优点,但其最关键的步骤是须要针对不同的物种建立相应的PCR反应体系[7-8]。虽然前人已建立了适用于葡萄的ISSR技术的PCR反应体系,但均未对Mg2+这一影响因素进行分析,因此本研究通过优化ISSR-PCR反应中的各项参数,建立适用于葡萄ISSR技术的最佳反应体系。以新疆葡萄种质资源嫩叶为材料,通过单因素试验和正交设计试验优化葡萄种质资源ISSR反应体系,并对PCR反应过程中的退火温度进行筛选,为进一步开展葡萄遗传多样性研究和品种选优提供理论依据。
1 材料与方法
1.1 试验材料
供试葡萄种质嫩叶采自新疆鄯善县新疆瓜果研究中心葡萄种质资源圃,-80 ℃冰箱中保存备用。ISSR引物序列参考哥伦比亚大学公布的序列,送往华大基因进行合成;所用试剂dNTPs和Taq DNA聚合酶(简称Taq酶)购自宝生物工程(大连)有限公司,其他药品均为国产分析纯。
1.2 试验方法
1.2.1 葡萄幼叶基因组DNA的提取与检测 采用改良的CTAB法提取葡萄幼叶基因组DNA[9]。改良的CTAB配方为:3% CTAB、100 mmol/L Tris-HCl、20 mmol/L EDTA、2 mmol/L NaCl、4% PVP40、2% β-巯基乙醇、20 mmol/L偏重亚硫酸钠;提取步骤参照徐美隆等的方法[10]进行。取1.0 μL DNA进行1%琼脂糖凝胶电泳检测,并通过紫外分光光度计检测D260 nm/D280 nm,从而确定DNA的浓度和纯度。
1.2.2 单因素筛选试验 研究dNTPs浓度、Mg2+浓度、引物UBC848[(CA)8RG]浓度、DNA模板用量、Taq酶用量5个因素对ISSR-PCR体系的影响(表1)。在单因素分析过程中,当对某一个因素进行梯度优化时,其他因素保持不变,得到的最优浓度带入下一个因素的梯度试验,依次进行。扩增程序为:95 ℃预扩增3 min;94 ℃变性30 s,52 ℃退火50 s,72 ℃延伸90 s,共40个循环;最终72 ℃延伸10 min[11]。PCR扩增产物经1.5%琼脂糖凝胶电泳,EB染色后凝胶成像系统拍照保存。
1.2.3 ISSR-PCR反应体系的正交试验设计 在单因素试验的基础上,对筛选出的dNTPs浓度和Mg2+浓度等的较优浓度进一步细化,引物浓度和DNA模板用量则直接使用单因素筛选的3个较适水平。采用L9(34)进行正交设计,检测dNTPs浓度、Mg2+浓度、引物UBC848浓度及DNA模板用量对ISSR-PCR 结果的影响,从中筛选出最佳组合,方案如表2所示,扩增程序与单因素试验结果一致。
1.2.4 ISSR-PCR反应体系退火温度的优化 利用温度梯度PCR扩增仪,对引物842[(GA)8YG]设置11个温度梯度,即48.0、48.4、49.3、50.7、52.2、53.8、55.5、57.1、58.6、60.0、60.9 ℃,筛选最佳退火温度。
1.2.5 最佳体系稳定性检测 利用筛选的最佳体系和引物842对24个不同葡萄品种DNA样品进行PCR扩增,检测最优体系的稳定性。
2 结果与分析
2.1 葡萄幼叶基因组DNA纯度的检测结果
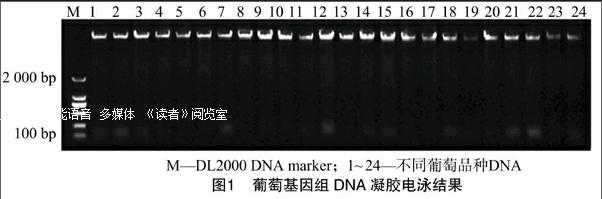
采用改良的CTAB法提取的葡萄幼叶基因组DNA无色、透明,经紫外分光光度计检测发现,D260 nm/D280nm均在1.75~1.88范围内;琼脂糖凝胶电泳检测结果(图1)显示,DNA条带清晰、明亮、整齐、杂质含量低且基本无降解,可用于开展后续试验。
2.2 葡萄ISSR-PCR反应体系单因素水平的优化结果
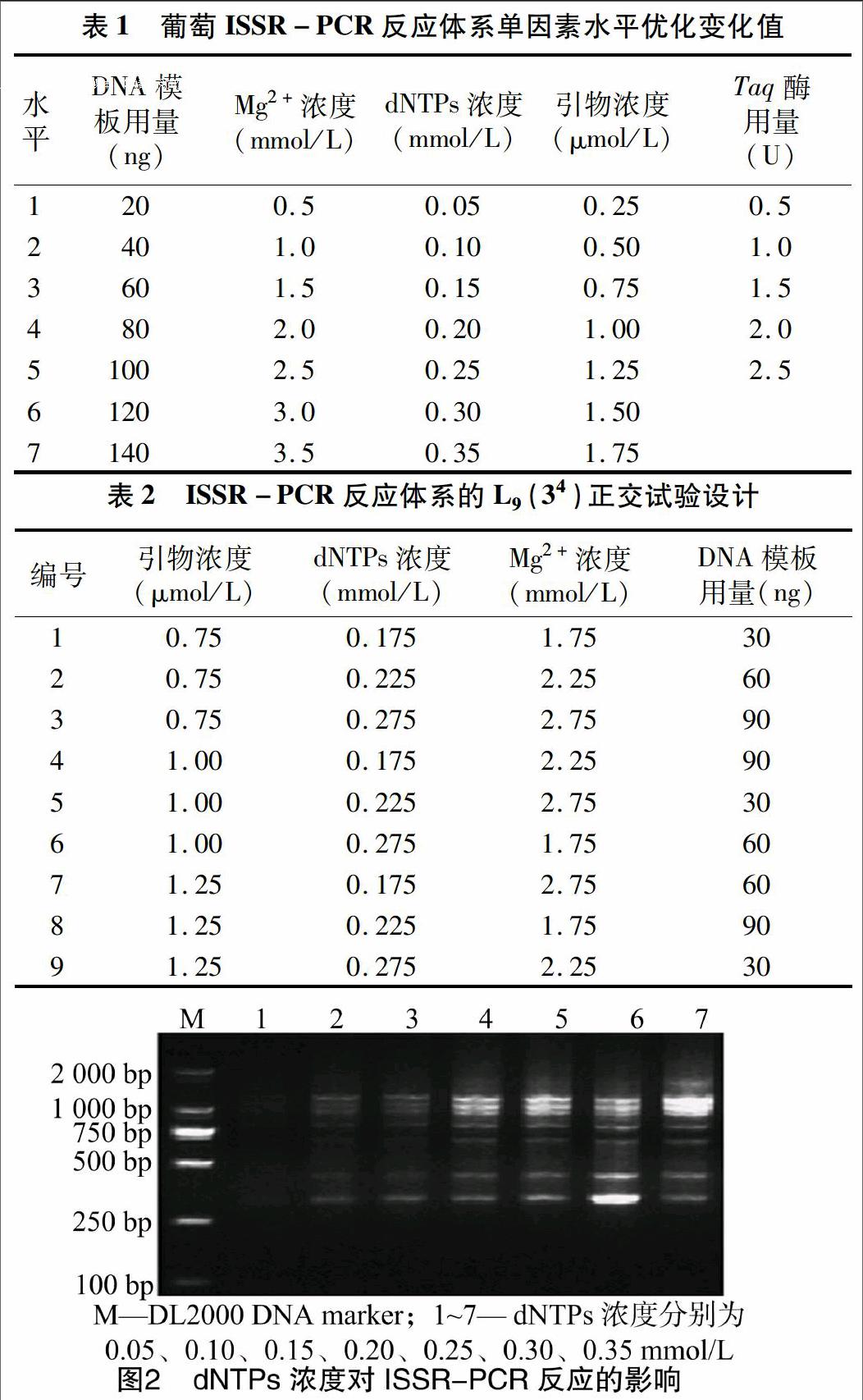
2.2.1 dNTPs浓度对ISSR-PCR反应体系的影响 由图2可知,随着dNTPs浓度的逐渐增大,扩增的条带数和条带亮度均逐渐增高;当dNTPs浓度为 0.05 mmol/L时,扩增反应不完全,扩增的条带数少且亮度暗;dNTPs浓度为0.20~0.30 mmol/L 时,扩增的条带多且亮度较高,所以初步确定dNTPs浓度在0.20~0.30 mmol/L较为合适。
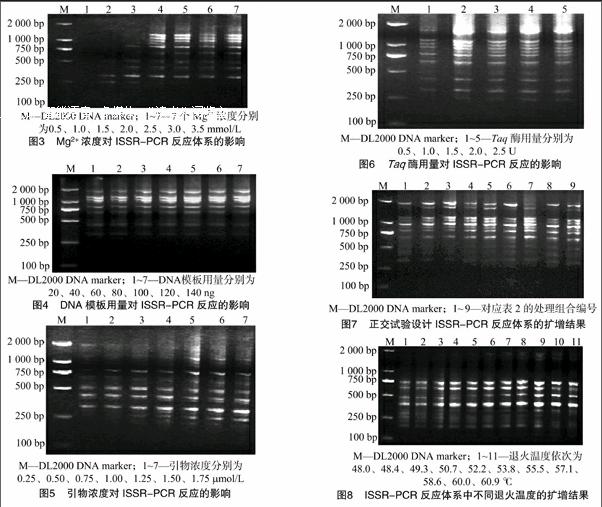
2.2.2 Mg2+浓度对ISSR-PCR反应的影响 从图3可以看出,Mg2+浓度在0.5~3.5 mmol/L范围内增大时,扩增条带明显增多,当Mg2+浓度为2.0 mmol/L时,扩增条带数达到最高,当Mg2+浓度增大至2.0~3.5 mmol/L时,扩增条带数基本不变,但亮度增加。因此,初步确定Mg2+浓度在2.0~3.0 mmol/L 较为合适。
2.2.3 DNA模板用量对ISSR-PCR反应的影响 不同DNA模板用量的扩增结果(图4)显示,DNA模板浓度在20~120 ng范围内逐渐增大时,扩增条带数基本不变,但条带亮度有所增加;其中模板浓度在40~80 ng时,条带亮度最佳,继续增至100 ng时,条带亮度过高,因此初步确定DNA模板浓度在40~80 ng较合适。
2.2.4 引物浓度对ISSR-PCR反应的影响 不同引物浓度扩增结果(图5)显示,当引物浓度在0.25~1.25 μmol/L范围内逐渐增大时,PCR扩增条带的数量增加,亮度也有所增大,当浓度为1.25 μmol/L时条带最多;当引物浓度继续增至1.75 μmol/L时,PCR扩增出的条带数量和亮度变化不明显,因此初步确定引物浓度在0.75~1.25 μmol/L较合适。
2.2.5 Taq酶用量对ISSR-PCR反应的影响 由图6可知,Taq酶用量为0.5 U时,条带亮度较暗,当Taq酶用量在1.0 U 时,PCR扩增条带亮度明显增大;随着Taq酶用量的继续增加,PCR扩增的条带亮度增加不明显,所以最终确定Taq酶用量为1 U。
2.3 正交设计试验结果
由图7可知,1号组合片段模糊,2号、3号组合小片段未扩增出,4号、6号、7号、8号、9号组合大片段扩增结果较模糊,只有5号组合条带亮度均匀且稳定。综合考虑条带亮度及丰富度,最终确定5号组合为最佳的ISSR-PCR反应体系组合,即每20 μL的反应体系中含有10×PCR buffer(Mg2+ free)、dNTPs 0.225 mmol/L、Taq酶1.0 U、引物1.00 μmol/L、Mg2+ 2.75 mmol/L、DNA模板30 ng。
2.4 最适退火温度的确定
引物842不同退火温度的扩增结果(图8)显示,当退火温度较低时,ISSR-PCR扩增的条带模糊,说明扩增的特异性较差;当退火温度较高时,扩增出大片段但条带模糊,说明扩增效率不高;退火温度为55.5 ℃时,扩增条带数较多且条带清晰。因此,确定55.5 ℃为引物842的最佳退火温度。
2.5 优化ISSR-PCR反应体系稳定性检测结果
以24个葡萄品种为材料,检测正交试验设计中组合5的 PCR反应体系的稳定性,结果(图9)显示,所有品种均能得到较为清晰整齐的条带。说明该正交组合可用于不同葡萄品种中扩增出较好的条带,适用于葡萄的ISSR分析。
3 结论与讨论
ISSR技术是基于PCR的一种分子标记,其扩增反应常受引物浓度、DNA模板用量、Mg2+浓度、dNTP浓度及Taq酶用量等多种因素的影响,此外,反应体系还受退火温度的影响[12]。因此,本研究针对这些影响因子进行优化设计,并建立葡萄ISSR-PCR反应体系,结果表明,引物浓度、DNA模板用量、Mg2+浓度、dNTP浓度及Taq酶用量对PCR扩增反应结果均有不同程度的影响,并筛选出55.5 ℃为引物842的最佳退火温度。
目前,已有不少研究者建立了适用于葡萄的ISSR-PCR反应体系,但均未对Mg2+浓度这一影响因素进行分析。通过本研究结果可以看出,Mg2+浓度对ISSR-PCR反应体系的影响较明显,可能是因为Taq酶需Mg2+激活,同时引物与模板的双链杂交体的解链也受二价阳离子的影响[13]。最终确定Mg2+浓度为2.75 mmol/L,与茶树[14]、杨树[15]、枇杷[16]等物种的最适Mg2+浓度接近。
DNA模板的质量是保证ISSR-PCR扩增的重要因素之一,最佳的模板浓度范围取决于研究物种和模板纯度。在DNA 模板不纯的情况下,宁可使用有效浓度范围内的最低限度,使抑制Taq酶活性的影响降到最低[14]。宣继萍等确定苹果ISSR反应体系中DNA模板用量为20 ng[17],刘晓静等确定益智ISSR反应体系中DNA模板用量为100 ng[18],代培红等确定葡萄ISSR反应体系中DNA模板用量为30 ng[8],可见不同物种研究须确定不同的ISSR-PCR模板用量。本研究确定DNA模板用量为30 ng,与代培红等的研究结果[8]一致。
在其他条件不变的情况下,当引物浓度过高时,引物结合模板的效率增高,进而导致大量的非特异性扩增,同时引物本身也容易形成二聚体,导致部分dNTPs和Taq酶被消耗,从而降低模板的扩增效率;当引物浓度过低时,引物与模板不能有效结合,则导致不能有效检测出所有的相应位点,使得多态性降低[19]。本研究确定引物浓度为1.00 μmol/L,高于赖呈纯等对葡萄种质资源ISSR体系的研究结果[7-8],这可能与试验材料、条件不同有关。
已有研究发现,dNTPs浓度会显著影响PCR扩增效率,浓度过高,会造成错误渗入;浓度过低,则会影响扩增产率[16]。在罗汉果[12]、龙眼[20]等物种中确定的最适dNTPs浓度为0.1~0.8 mmol/L,本研究确定的dNTPs浓度为0.225 mmol/L,在上述研究范围之内,且浓度更精确。
酶的用量也直接关系到试验结果,量多不仅会增加试验成本,还容易产生非特异性扩增产物;量少则会使酶过早地消耗完,产物合成效率低[18]。本研究最终确定Taq酶用量为1.0 U,与周俊亚等的研究结果[12,21]一致。
本研究结果表明,不同的反应体系扩增的ISSR结果有一定的差异,PCR反应体系的质量直接影响后续ISSR-PCR的准确性。在体系研究过程中,一方面要保证体系的完整性,另一方面又要考虑到试验成本问题,须在二者之间找到一个平衡点,因此本研究在单因素试验找出各因素较合适的浓度范围的基础上进行正交设计分析,最终确定最佳的反应体系,且建立的葡萄ISSR-PCR反应体系稳定可靠,可为后续的葡萄种质资源分析、品种鉴定、遗传多样性分析、分子育种等方面的研究提供参考。利用正交设计优化得到的ISSR-PCR反应体系可在一系列的葡萄品种中扩增获得清晰、稳定的DNA条带,可用于后续的葡萄种质资源遗传多样性分析。
参考文献:
[1]黄远飞. 葡萄种质资源RAPD分析及亲缘关系研究[D]. 长沙:湖南农业大学,2005.
[2]吴子龙,方连玉,王 军,等. 15份葡萄种质亲缘关系的ISSR分析[J]. 果树学报,2006,23(4):605-608.
[3]吴子龙,王 军,沈育杰,等. 山葡萄种内遗传多样性的SSR分析[J]. 果树学报,2008,25(6):821-827.
[4]张淑静. 葡萄SSR反应体系的建立及遗传多样性分析[D]. 保定:河北农业大学,2008.
[5]郭大龙,张君玉,刘崇怀. 葡萄SRAP反应体系优化及引物筛选[J]. 基因组学与应用生物学,2010,29(2):379-384.
[6]张君玉,郭大龙,龚 莹,等. 葡萄目标起始密码子多态性反应体系的优化[J]. 果树学报,2011,28(2):209-214.
[7]赖呈纯,范丽华,谢鸿根,等. 葡萄ISSR-PCR反应体系的建立与优化[J]. 生物技术通报,2012(2):159-164.
[8]代培红,朱 瑜,姚正培,等. 葡萄种质资源ISSR-PCR反应体系的建立与优化[J]. 南方农业学报,2013,44(8):1258-1262.
[9]田淑芬,李树海,高 杨,等. 玫瑰香葡萄不同时期叶片提取DNA纯度的比较[J]. 天津农业科学,2003,9(2):5-7.
[10]徐美隆,章 雨,倪细炉. 一种高质量葡萄基因组DNA提取方法[J]. 北方园艺,2011(15):172-174.
[11]王果平,樊丛照,李晓瑾,等. 新疆贝母 DNA 提取及 ISSR-PCR 体系的建立与优化[J]. 种子,2012,31(8):27-30, 35.
[12]周俊亚,宾晓芸,彭云滔,等. 罗汉果ISSR-PCR反应体系的建立[J]. 广西师范大学学报:自然科学版,2004,22(3):81-84.
[13]贺 佳,丁小余,褚必海,等. 泽泻ISSR反应体系的建立与优化[J]. 南京师大学报:自然科学版,2006,29(3):86-90.
[14]姚明哲,王新超,陈 亮,等. 茶树ISSR-PCR反应体系的建立[J]. 茶叶科学,2004,24(3):172-176, 206.
[15]汪结明,项 艳,吴大强,等. 杨树ISSR反应体系的建立及正交设计优化[J]. 核农学报,2007,21(5):470-473, 513.
[16]付 燕,罗 楠,杨 芩,等. 枇杷属植物ISSR反应体系的建立和优化[J]. 果树学报,2009,26(2):180-185.
[17]宣继萍,章 镇. 适合于苹果的ISSR反应体系的建立[J]. 植物生理学通讯,2002,38(6):549-550.
[18]刘晓静,王文泉,郭凌飞. 益智ISSR-PCR反应体系建立与优化[J]. 生物技术,2008,18(3):33-37.
[19]隋晓青,王 堃. 克氏针茅ISSR-PCR反应体系的建立与优化[J]. 草业学报,2008,17(3):71-78.
[20]曾黎辉,洪自同,许家辉,等. 龙眼ISSR反应体系的建立和优化[J]. 中国农学通报,2007,23(9):111-114.
[21]赵丽华. 石榴ISSR-PCR反应体系的正交设计优化[J]. 北方园艺,2010(19):148-152.

