牛奶中3种致病菌多重PCR的建立及初步应用
张亚楠,焦仁刚,赵贵,陈锡龙,黄鑫,栾庆祥,章厉劼,彭珊,徐景峨,蒲龄,余波
(1.贵州省农业科学院畜牧兽医研究所,贵阳550005;2.贵州省兽药饲料监察所,贵阳550003)
0 引 言
食源性致病菌是引起人类健康和食品安全的主要因素之一,而微生物污染是导致牛奶质量问题的重要因素,因此牛奶中的致病菌成为消费者关注的焦点。而我国对原料奶的质量要求远低于乳业发达国家。我国乳品新国标中仅规定了生奶中细菌的最低检出总数(少于2×106个/mL),未对牛奶中具体的细菌种类进行规定,这忽视了对病原菌的检测[1]。大肠杆菌、金黄色葡萄球菌、沙门氏菌则是牛奶源主要的致病菌,这些食源性致病菌严重影响着人和动物的健康[2-4]。因此,需要快捷、灵敏的方法对牛奶中食源性致病菌进行检测。
多重PCR(multiplex PCR,mPCR)方法可同时检测多种病原体,且具有特异性强、灵敏度高、检测时间短和检测成本低等特点,适合大量临床样本(特别是混合感染样本)中病原体的快速检测[5]。本研究根据金黄色葡萄球菌femB 基因序列、大肠杆菌phoA 基因序列和沙门氏菌invA 基因序列,分别设计3 对特异性引物,建立一种能够同时快速检测牛奶中3 种食源性致病菌的多重PCR 方法。
1 材料与方法
1.1 菌株
大肠杆菌ATCC®25922标准株、沙门氏菌ATCC®13076 标准株、金黄色葡萄球菌ATCC®6538 标准株、牛结核杆菌、多杀性巴氏杆菌、牛支原体,均由贵州省畜牧兽医研究所畜禽疫病研究室保存。单核细胞增生李斯特氏菌ATCC®7644、志贺氏菌ATCC®8700 购自上海北诺生物科技有限公司。
1.2 主要试剂
细菌基因组DNA 提取试剂盒购自天根生化科技有限公司;DL2000 DNA Marker、500bp DNA Lad⁃der(Dye Plus)、Premix Taq(EX Taq version 2.0 plus dye)等购自宝生物(大连)工程有限公司;LB 液体培养基、营养琼脂培养基等均购自广州环凯微生物科技有限公司。
1.3 引物设计与合成
参考GenBank 中的金黄色葡萄球菌femB 基因序列(检索号:GQ284649.1)、大肠杆菌phoA 基因序列(检索号:NC_011750.1)和沙门氏菌invA 基因序列(检索号:M90846.1),经比对分析后,采用Primer Premier 5.0 分别设计各基因的特异性引物,引物的序列与目的片段大小见表1。
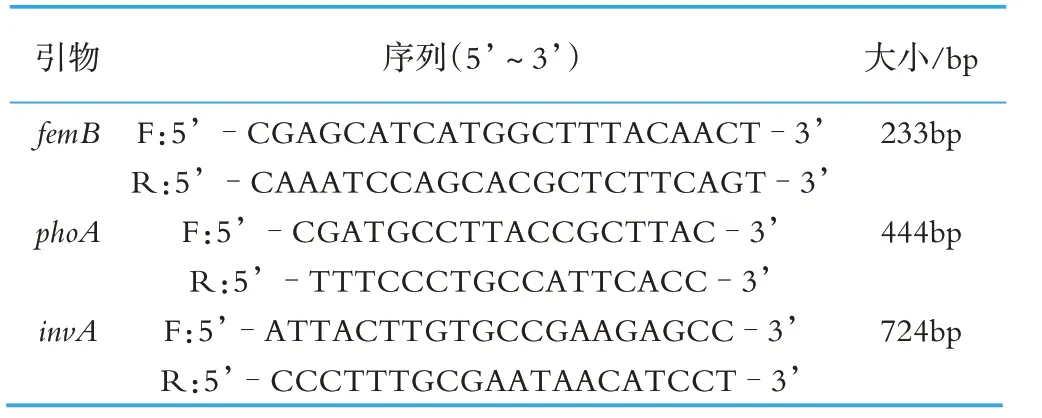
表1 引物信息
1.4 细菌DNA 的提取
将-80 ℃保存的菌株分别接种于相应的营养肉汤复苏,划线于相应的固体培养基37 ℃培养过夜,挑取单菌落于液体培养基中,置于37 ℃,200 rpm 摇床中培养12 h。参照细菌基因组提取试剂盒说明书进行提取细菌DNA,将提取的DNA 模板于-20 ℃保存。
1.5 单一PCR 扩增及产物鉴定
单一PCR 反应采用25 μL 反应体系:Premix Taq(EX Taq version 2.0 plus dye)12.5 μL,模板DNA 1 μL,上、下游引物各0.5 μL,ddH2O 加至25 μL。反应程序:95 ℃5 min;95 ℃30 s,55 ℃30 s,72 ℃30 s,扩增30 个循环;最后72 ℃延伸10 min。取5 μLPCR 扩增产物于1%琼脂糖凝胶电泳进行检测,阳性产物送往生工生物工程股份有限公司进行测序分析。测序结果在NCBI 网站http://www.ncbi.nlm.nih.gov/上进行Blast分析,以确认目的基因。
1.6 多重PCR 反应条件的优化
对多重PCR 反应条件,包括退火温度(50~60 ℃)和引物浓度(5~20 μmol/L)进行优化,以确定最佳反应条件,同时以双蒸水作为空白对照。多重PCR 反应在50 μL 反应体系中进行:Premix Taq(EX Taq version 2.0 plus dye)25 μL,3 种细菌DNA 混合模板2 μL,3 对上、下游引物各1 μL,ddH2O 加至50μL。反应程序:95 ℃5 min;95 ℃30 s,50~60 ℃35 s,72 ℃45 s,扩增30 个循环;最后72 ℃延伸10 min。取5 μL PCR 扩增产物于1%琼脂糖凝胶电泳进行检测。
1.7 敏感性试验
将1.5 测序比对无误的DNA 片段连到PUC57 载体(2 710 bp)上,构建同时携带三个基因的质粒,并转化到大肠杆菌工程菌DH5α 中,在加入IPTG、X-Gal的LB 培养基上挑选白色菌落,经PCR 鉴定筛选出阳性菌株保存。提取阳性菌株的质粒,用蛋白质核酸仪测定浓度后,经10 倍梯度稀释后作为单一PCR 反应和多重PCR 反应的模板,用优化后的PCR 反应程序进行扩增,以检测该方法的敏感性。
1.8 特异性试验
以混合核酸(金黄色葡萄球菌、大肠杆菌、沙门氏菌)、沙门氏菌、大肠杆菌、金黄色葡萄球菌、牛结核杆菌、多杀性巴氏杆菌、牛支原体、单核细胞增生李斯特氏菌、志贺氏菌的核酸为模板分别进行多重PCR 反应,以鉴定该方法的特异性。
1.9 重复性试验
用建立的多重PCR 方法,多次重复检测金黄色葡萄球菌、大肠杆菌、沙门氏菌及3 种细菌的混合阳性样本,以验证多重PCR 的稳定性。
1.10 多重PCR 对临床样品的检测
将临床采集的未经巴氏杀菌的25 份鲜牛奶样品(生乳),参照GB19301-2010 测定生乳中微生物菌落总数。同时,将样品简单增菌(样品∶增菌液=1∶25)后采用细菌基因组提取试剂盒进行提取细菌DNA,进行多重PCR 和单一PCR 扩增。
参照GB27342-2009 将25 份鲜牛奶样品经63~65 ℃、30 min 杀菌处理得到巴氏杀菌乳,参照国标GB4789.3平板计数法、GB4789.10定性检验、GB4789.4分别对大肠菌群、金黄色葡萄球菌、沙门氏菌进行检测。同时,经简单增菌后提取细菌DNA,进行多重PCR 和单一PCR 检测。
2 结果与分析
2.1 单一PCR 扩增及产物的鉴定
单一PCR 结果表明,扩增片段分别为各细菌的特异性条带。测序结果证实金黄色葡萄球菌femB 的大小为233 bp,大肠杆菌的phoA 的大小为444 bp,沙门氏菌invA 的大小为724 bp,均与预期大小相符。经比对分析,结果显示各细菌基因测序结果与NCBI 上公布序列同源性达100%(见图1)。
2.2 多重PCR 反应方法的建立及条件的优化
通过对退火温度和引物浓度等条件进行优化,确定多重PCR 反应在50 μL 反应体系中的最佳反应条件为,退火温度52 ℃,引物浓度10 μmol/L,最佳反应程序:95 ℃5 min;95 ℃30 s,52 ℃35 s,72 ℃45 s,扩增30 个循环;最后72 ℃延伸10 min。各细菌的特异性引物均有效扩增出了其目的片段,分别为724 bp(沙门氏菌),444 bp(大肠杆菌)、233 bp(金黄色葡萄球菌),引物间无非特异性片段产生(见图2)。
2.3 敏感性试验

图1 各基因同源性对比

图2 沙门氏菌、大肠杆菌和金黄色葡萄菌多重PCR
经PCR 鉴定,本研究成功构建同时携带三个基因的阳性质粒,大小为4 111 bp(见图3)。在优化的多重PCR 反应条件中,该多重PCR 对细菌的最低检测量分别为沙门氏菌133.3 pg/mL、大肠杆菌13.3 pg/mL、金黄色葡萄球菌13.3 pg/mL(见图4)。在单一PCR 反应中,各细菌的最低检测量分别为沙门氏菌0.013 pg/mL、大肠杆菌1.33 pg/mL、金黄色葡萄球菌13.3 pg/mL(见图5、6、7)。
2.4 特异性试验
在特异性试验中,对混合DNA(金黄色葡萄球菌、大肠杆菌、沙门氏菌)、沙门氏菌DNA、大肠杆菌DNA、金黄色葡萄球菌DNA均扩增出了相应的目的片段,而对其他菌株的DNA未见扩增产物,表明该多重PCR具有较好的特异性(见图8及图4中11~14孔)。

图3 阳性质粒的多重PCR鉴定
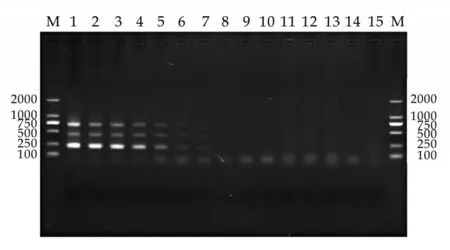
图4 多重PCR敏感性与特异性试验

图5 沙门氏菌单一PCR敏感性试验
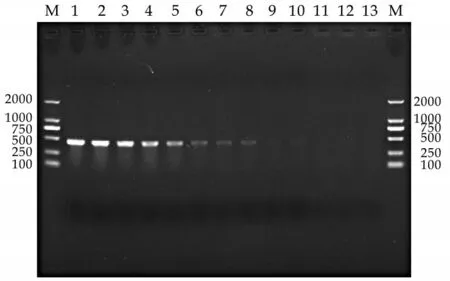
图6 大肠杆菌单一PCR敏感性试验
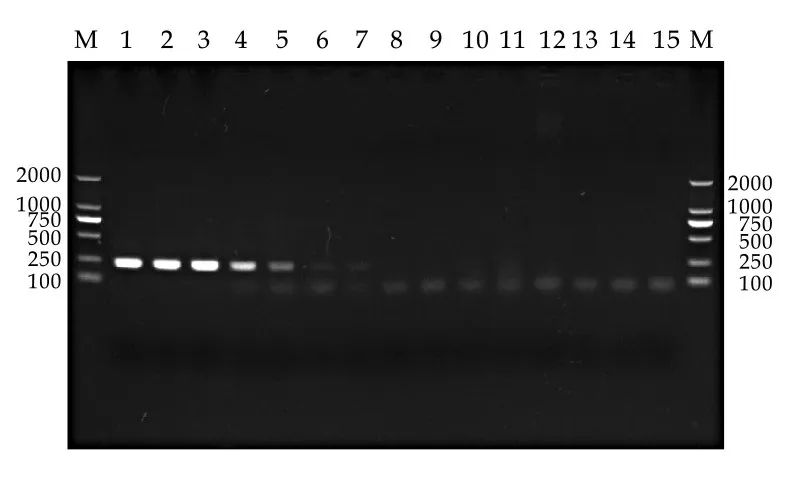
图7 金黄色葡萄球菌单一PCR敏感性试验

图8 多重PCR特异性试验
2.5 重复性试验
用建立的多重PCR 方法,多次重复检测金黄色葡萄球菌、大肠杆菌、沙门氏菌及3 种细菌的混合阳性样本,均能扩增出相应的目的条带,表明该多重PCR方法具有较好的重复性(见图9)。
2.6 临床应用
25 份未经巴氏杀菌的鲜牛奶样品(即生乳)中微生物菌落总数均小于2×106,符合食品安全国家标准生乳中微生物限量的规定;而多重PCR 检测结果显示(见表2),19 份大肠杆菌阳性,2 份沙门氏菌+大肠杆菌双阳性,1 份大肠杆菌+金黄色葡萄球菌双阳性,这与单一PCR 检测结果一致,且与细菌分离鉴定结果一致。多重PCR 和单一PCR 对25 份巴氏杀菌乳经简单增菌后提取的细菌DNA 进行检测,结果无阳性检出。同时依照巴氏杀菌乳国家标准对大肠菌群、金黄色葡萄球菌、沙门氏菌进行传统细菌分离鉴定,结果均为阴性。
3 讨 论
近些年,食品安全问题频发,而细菌性食物中毒则是其重要问题之一。目前,国内主要采用传统的细菌分离鉴定方法检测食品中的病原菌,其操作繁琐、检测周期较长,且混合感染严重导致其方法的灵敏度较低[6]。因此,建立一种快速、有效、灵敏的检测方法是很有必要的。金黄色葡萄球菌、大肠杆菌、沙门氏菌是引起牛奶微生物污染的主要致病菌。本研究建立的多重PCR 反应方法可以对临床牛奶样本中的金黄色葡萄球菌、沙门氏菌和大肠杆菌单独或混合感染进行快速、准确的检测及鉴定。结果表明,该诊断方法检测时间短、敏感性好、特异性高,具有广阔的应用前景。
多重PCR 反应体系中存在多对引物和多个模板,相互之间发生作用的机率很大,很容易导致假阳性出现[7]。因此,多重PCR 的引物设计至关重要,应该选择各自相对保守的基因序列作为靶基因。本研究中所用引物参考GenBank 中金黄色葡萄菌femB 基因序列高度保守,是金黄色葡萄菌区别于其他葡萄球菌的一个特异性染色体标志基因[8-9],同时femB 基因与细菌细胞壁的合成有关,它也是金黄色葡萄球菌产生耐药性的辅助基因[10-11]。而大肠杆菌碱性磷酸酶phoA基因,是普遍存在于所有的大肠杆菌中的持家基因,具有良好的特异性,它编码的酶能催化非特异性磷酸单酯水解,对机体内磷代谢的调节有重要作用,还可以作为信号酶被广泛应用于医学疾病检测、免疫学和分析生物技术[12-14]。沙门氏菌invA 基因是沙门氏菌的一种侵袭蛋白基因,其编码的蛋白决定沙门氏菌对肠粘膜细胞的侵袭力,是致病性沙门氏菌存在的最直接标志[15-16]。本研究根据以上3 种保守基因序列,扩增片段分别为233 bp、444 bp、724 bp,片段大小级差在200 bp 以上,扩增产物经1%琼脂糖凝胶电泳后易于分开,有很高的辨识度,在实际应用中不易造成误判。
影响多重PCR 成功的因素有很多,其中退火温度会直接影响引物与模板DNA 的结合效率,还会导致PCR 反应的非特异性扩增[17]。研究表明,多重PCR 反应体系的退火温度要比单一PCR 扩增时的退火温度低4 ℃左右[18]。同时,所有引物对的最适退火温度要尽可能的相同,这有助于在多重PCR 反应中每对引物都有相同的扩增效率[19]。本研究中的三对引物在单一PCR 反应中退火温度为55 ℃时,均能保证很高的扩增效率;通过条件优化,多重PCR 反应在退火温度为52 ℃时效果最优。

表2 临床应用
同时,本研究构建了同时携带femB、phoA、invA 三个基因的质粒,作为阳性菌株模板。这种方法可获得大量稳定的阳性模板DNA,且保证三个基因的拷贝数准确一致,有利于开展检测方法的敏感性试验,也为后续临床样品的检测提供稳定、准确的阳性对照。
本研究还表明,巴氏杀菌法能有效地将牛奶中的金黄色葡萄球菌、大肠杆菌和沙门氏菌这3 种致病菌杀死,但致病菌产生的毒素蛋白的活性是否已经全部失活还有待我们进一步地探究。同时,生乳中存在的耐药菌株产生的灭活酶,如β-内酰胺酶等蛋白的活性及安全性风险也有待进一步研究。
4 结 论
本研究建立的多重PCR 反应方法可以快速、准确地对临床牛奶样本中的金黄色葡萄球菌、沙门氏菌和大肠杆菌单独或混合感染进行检测。同时构建携带femB、phoA、invA 三个基因的阳性质粒,为临床检测提供稳定、准确的阳性对照,具有广阔的应用前景。

