不同饲料对稻田养殖克氏原螯虾生长、非特异性免疫酶及体成分的影响
刘永涛,董靖,夏京津,王桢月,胥宁,杨秋红,杨移斌,艾晓辉*
(1.中国水产科学研究院长江水产研究所, 武汉 430223; 2.农业农村部水产品质量安全控制重点实验室, 北京 100141;3.湖北省水产品质量安全工程技术研究中心, 武汉 430223; 4.华中农业大学水产学院 武汉 430070;5.上海海洋大学水产与生命学院, 上海 201306)
克氏原螯虾(Procambarusclarkii)俗称红色沼泽螯虾、小龙虾或淡水小龙虾,现已成为中国最重要的淡水养殖虾类。据不完全统计,2017年全国小龙虾的养殖面积已达800 000 hm2,总产量为112.97万t,较2016年增幅36.59%[1-2]。“虾稻模式”是中国小龙虾养殖的主要模式,2017年全国“虾稻模式”养殖面积为566 666.67 hm2,占总养殖面积的70.83%,其中湖北省的稻田综合种养面积为277 880 hm2[3],占全国稻田养殖克氏原螯虾的49.03%。小龙虾的食性杂,能摄食各种谷物、饼类、蔬菜、陆生牧草、水生植物、着生藻类、水生昆虫、小型底栖动物、鱼虾和动物下脚料等,也喜食人工配合饲料。在实际养殖过程中,养殖户经常使用大豆、玉米、大麦、水草、芦苇、螺蛳和不同蛋白含量的商品饲料等[3]。为明确上述饲料对小龙虾养殖性能的影响,本研究测定了“虾稻连作”模式下不同饲料条件对小龙虾体重和体长增长率、非特异性免疫酶活性、含肉率、含水率、失水率、系水力及体成分等指标的影响,旨在全面评价投喂玉米、大豆、商品饲料以及仅利用稻田生态系统天然饵料资源等条件下小龙虾生长、免疫和体组成的差异,以期为小龙虾的稻田高效养殖和品质提升提供有效的参考依据。
1 材料与方法
1.1 试验试剂
溶菌酶(LSZ)、酸性磷酸酶(ACP)和超氧化物歧化酶(SOD)试剂盒购自南京建成生物工程研究所。无水乙醚、乙醇、硫酸、氢氧化钠、盐酸、硫酸铜、硫酸钾、石油醚、碘、碘化钾、柠檬酸钠和苯酚等试剂均购自国药集团化学试剂有限公司。
1.2 养殖试验条件
养殖试验实施于湖北省潜江市龙湾镇全国克氏原螯虾生态繁养基地。将体重为(2.09±0.20) g、体长为(4.54±0.13) cm的克氏原螯虾样品(随机分为6组,分别编号为A1、A2、A3、A4、A5和A6组,每组设置一个平行组。小龙虾养殖稻田为新养殖稻田,稻田面积为800 m2/块,稻田为粘质土壤,田埂内侧四周环形养虾沟的上沟宽4 m,下沟宽1 m,沟深1.0~1.2 m。稻田中水草为伊乐藻(Elodeanuttallii)。稻田中3月份水位为30 cm左右,4月中旬以后,水位逐渐提高至50~60 cm。小龙虾的生长要求水体溶氧丰富,水质清新。平时应注意观察,根据天气、水质变化及时调整水位。如水位过浅要及时补充;水质过浓(有机质过多导致的水体浑浊、水色发黑及发暗等现象)要及时换水,并应保持水位相对稳定。
虾苗放置前,先用VC(0.3 g/m3)水浸泡15 s,再于池塘水中放置2 min后,下池。具体操作如下:将虾筐放置在水平面处的埂边,1/3虾筐在水面上,2/3在水面下,让虾自然爬到水中,6 min后要把虾筐里剩下的活虾倒入水中,而死虾则带走掩埋,并补充规格相当的虾苗。各组养殖环境相同,且均符合NY/T 5361—2016 的要求。养殖稻田中投放的虾苗为该养殖基地老养殖稻田自繁虾捕捞筛选后投放到本试验养殖稻田中,每块试验田各投放15 kg克氏原螯虾虾苗。
玉米和大豆原料购自潜江市中心集贸市场,采购后用粉碎机粉碎成粒径为0.1~0.3 mm的颗粒。2种商品饲料购自湖北加益加生物科技有限公司的龙虾膨化沉性配合饲料,其组成成分及含量见表1。50%复方黄芪多糖由北京生态尔生物科技有限公司提供。

表1 商品饲料组成成分和含量Tab.1 Compositions and contents of commercial feeds %
1.3 试验设计
A1组饲喂玉米、A2组饲喂大豆、A3组饲喂添加复方黄芪多糖的蛋白含量≥26%的饲料、A4组饲喂蛋白含量≥26%的饲料,A5组饲喂蛋白含量≥28%的饲料,A6组不投喂饲料。稻田中的天然饵料基础为稻草、水草、浮游生物和底栖生物。饲养管理:A1~A5组投喂饲料,每日投喂2次,分别为早晨日出前和傍晚日落后各投喂1次,并以傍晚投喂为主,傍晚的投喂量占日投喂量的60%~70%,将饵料投放于池岸或浅滩上,让小龙虾养成定点摄食的习惯。日投喂量为克氏原螯虾总体重的3%。养殖周期为2018年3月22日到5月20日,共计60 d。添加50%复方黄芪多糖饲料的配制:将50%复方黄芪多糖用水溶解后用喷壶均匀喷洒到饲料上,按1.25 g/kg饲料进行制备,晾干后使用。
1.4 试验指标测定
1.4.1 生长性能指标
养殖试验结束后用虾笼将克氏原螯虾捕起,各组及其平行组克氏原螯虾混合后作为一组,并平均分为3个平行,分别测定其生长性能指标。测定的克氏原螯虾的生长指标有体重增重率(RWG)、体长增长率(RLG)、成活率(SR)和饲料转化效率(FC),公式如下。
式(1)
式(2)
式(3)
式(4)
式(1)~式(4)中:W0为试验开始时克氏原螯虾体重(g),Wt为试验结束时克氏原螯虾体重(g),L0为试验开始时克氏原螯虾的体长(cm),Lt为试验结束时克氏原螯虾体长(cm),t为养殖试验天数(d),N0、Nt分别为试验开始和试验结束时克氏原螯虾的尾数,F为饲料消耗量(g)。
曾连发五支白羽令,率江湖盟中人对抗北方异族,江湖盟过半人数折于这一役中,谢星亦是身死,但终取得惨胜,初出茅庐的江湖少年,往往把谢星看作他们心中的榜样。
1.4.2 免疫指标测定
养殖试验结束后,分别从各组及其平行组已混合的克氏原螯虾中随机抽取30尾克氏原螯虾,分别采用1 mL无菌注射器从克氏原螯虾的头胸甲后部插入围心腔中抽取血淋巴200 μL,并将血淋巴置于预先用抗凝剂处理过的1.5 mL离心管中,每尾克氏原螯虾的血淋巴作为一个样品,置于超低温冰箱中-80 ℃保存,一个月内测完。克氏原螯虾血淋巴的酸性磷酸酶(ACP)、溶菌酶(LSZ)及超氧化物歧化酶(SOD)的活力,采用南京建成生物工程研究所生产的试剂盒进行测定。ACP活性测定以100 mL克氏原螯虾血淋巴在37 ℃时与基质作用30 min产生1 mg酚为1个活力单位(U/100mL);LSZ在25 ℃、pH值为6.2的条件下,每分钟引起溶酶小球体溶液于450 nm处吸光度下降0.001所需要的酶量为1个酶活力单位(U/mL);SOD以每毫升反应液中SOD抑制率达50%时所对应SOD的量为1个酶活力单位(U/mL)。
1.4.3 含肉率、含水率、系水力的测定
含肉率的测定:分别从各试验组及其平行组已混合的克氏原螯虾中随机抽取30尾克氏原螯虾。用滤纸擦干克氏原螯虾体表水分,先称取克氏原螯虾的总质量,然后打开甲壳,去除虾壳,从虾的腹部小心取出肌肉并称其质量。含肉率计算公式见式(5)。

式(5)
失水率的测定:分别从各组及其平行组已混合的克氏原螯虾中随机抽取30尾克氏原螯虾。参照张晓红等[4]的方法,采用离心法研究克氏原螯虾肌肉的失水率,将克氏原螯虾肌肉切为1 g左右的小块,精确称其质量,放入离心管中以1 500 r/min转速离心30 min,用镊子取出肉样,并用滤纸吸取克氏原螯虾肌肉表面的水分后再次准确称其质量,失去的水分为离心前与离心后的克氏原螯虾肌肉样品的质量之差。失水率计算公式见式(6)。

式(6)
含水率的测定:分别从各组及其平行组已混合的克氏原螯虾中随机抽取30尾克氏原螯虾。采用冷冻离心法测定克氏原螯虾肌肉的含水率。将克氏原螯虾肌肉切为1 g左右的小块,精确称其质量,放入CHRIST型冷冻干燥机冷冻干燥48 h,精确称其质量,克氏原螯虾肌肉所含的水分为冷冻干燥前和冷冻干燥后肌肉样品的质量之差。含水率计算公式见式(7)。

式(7)
系水力的测定:参照张晓红等[4]的方法,在获得克氏原螯虾肌肉样品中含水率、失水率后,通过式(8)计算出克氏原螯虾肌肉样品的系水力。

式(8)
分别从各组及其平行组已混合的克氏原螯虾中随机抽取30尾克氏原螯虾。取肌肉后用均质机均质,每个样品设置3个平行组,进行体成分测定。克氏原螯虾肌肉粗蛋白的测定采用凯氏定氮法(GB 5009.5—2016)测定[5],粗脂肪采用索氏抽提法(GB 5009.6—2016)测定[6],灰分的测定采用GB/T 5009.4—2016测定[7]。
1.5 数据处理
试验数据用Excel 2013和SPSS Stastic19.0软件进行统计分析,结果以平均值±标准差(Average±SD)表示,用LSD法进行多重比较。
2 结果
2.1 不同饲料对克氏原螯虾生长指标的影响
6个处理组的克氏原螯虾体重和体长的增加率如表2所示。其中A3组体重和体长增加率最大,除与A5组差异不显著(P>0.05)外,与其它各组差异显著(P<0.05)。A1组体重和体长增加率最小,与其它组差异显著(P<0.05)。A2组体重和体长增加率除大于A1组外,均低于其它组,与A6组差异不显著(P>0.05),而与其它组差异显著(P<0.05)。A1~A6组克氏原螯虾成活率为68.51%~82.86%,其中A3组克氏原螯虾成活率最高,其次为A5组,最低的是A1组。A1~A5组饲料系数最低的为A3组(1.87),最高的为A1组(3.10)。

表2 不同饲料对克氏原螯虾生长的影响Tab.2 Effects of different feeds on the growth of crawfish n=30
注:同一列不同的上标字母表示差异显著(P<0.05)。“—”代表无数据。下同。
2.2 不同饲料对克氏原螯虾非特异性免疫酶活性的影响
表3中列出了5组饲喂不同饲料和1组不饲喂饲料克氏原螯虾血淋巴中免疫酶活性的测定结果。其中,A2组的超氧化物歧化酶(SOD)的活性最高,但与其它组差异不显著(P>0.05)。A5组克氏原螯虾血淋巴的酸性磷酸酶(ACP)的活性最高,与A1组差异不显著(P>0.05),与其它组差异显著(P<0.05)。A6组克氏原螯虾血淋巴溶菌酶(LSZ)的活性最高,但与A3组、A2组和A1组差异不显著(P>0.05);A5和A4组的溶菌酶(LSZ)的差异不显著(P>0.05),但与其它组差异显著(P<0.05)。
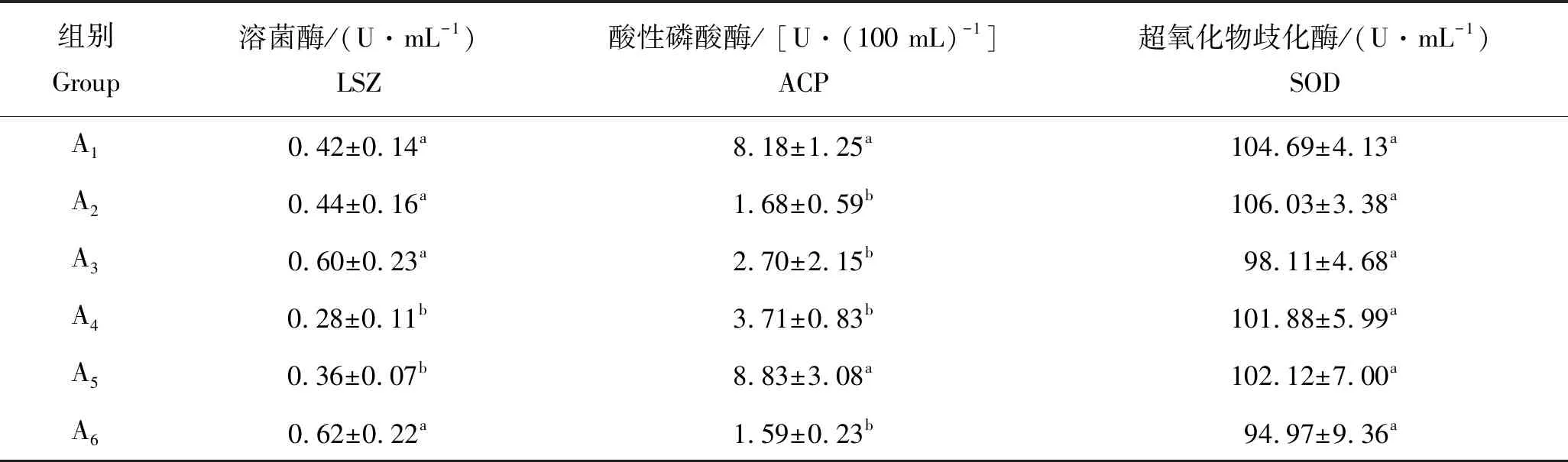
表3 饲喂不同饲料对克氏原螯虾血淋巴中非特异性免疫酶活性的影响Tab.3 Effects of different feed on non-specific immune enzyme activities of crawfish n=30
2.3 不同饲料对克氏原螯虾含肉率、失水率、系水力和体成分的影响
A1~A5组和A6组克氏原螯虾的含肉率、失水率、系水力和常规营养成分含量见表4。由表4可知,A1组克氏原螯虾的含肉率最高为(17.60±2.03)%,与其它组差异显著(P<0.05);A4组含肉率最低(14.16±1.26)%,与A2组和A6组差异不显著(P>0.05),与其它组差异显著(P<0.05)。A6组的含水率最高为(86.14±4.04)%,与其它组差异显著(P<0.05);A5组含水率最低为(79.24±9.31)%,除与A6组差异显著外(P<0.05),与其它组差异不显著(P>0.05)。A1组的失水率最大为(15.59±4.53)%,与A5组差异不显著(P>0.05)外,与其它组差异显著(P<0.05);A3组的失水率最低,除与A1组差异显著(P<0.05)外,与其它组差异不显著(P>0.05)。A3组的系水力最高为(87.58±4.87)%,与A2组、A4组和A6组差异不显著(P>0.05),与A1组和A5组差异显著(P<0.05)。粗蛋白含量最高的是A5组,但与其它各组差异不显著(P>0.05)。A1组克氏原螯虾粗脂肪含量最高为(2.11±0.08)%,其次为A5组,两组差异不显著(P>0.05),但两组与其它各组差异显著(P<0.05);粗脂肪含量最低的是A4组为(1.58±0.19)%,除与A1和A5组差异显著(P<0.05)外,与其它组差异不显著(P>0.05)。粗灰分含量最高的是A4组,但各组差异不显著(P>0.05)。

表4 不同饲料对克氏原螯虾含肉率、含水率、失水率、系水力和常规营养成分含量的影响Tab.4 Muscle content, moisture content, moisture loss, moisture holding capacity and body composition of crawfish %,n=30
3 讨论
3.1 不同饲料对克氏原螯虾生长的影响
洪徐鹏等[8]认为黄芪中的活性物质可以促进克氏原螯虾体内蛋白质的转化,从而提高克氏原螯虾的蜕壳率和存活率,而有研究表明甲壳类动物的生长与蜕壳步调一致[9],本试验结果表明,饲喂添加复方黄芪多糖的A3组克氏原螯虾的体重增重率和体长增长率均高于其它组。孟晶等[10]在水泥池中采用6个脂肪添加水平的饲料饲喂克氏原螯虾60 d的体重增重率为(219.03±3.69)%~(253.60±5.38)%,除与本试验中增重率最低的饲喂玉米的A1组增重率相近外,均低于本试验中的其它组。邓慧芳等[11]在实验室条件下,将克氏原螯虾饲养在无毒塑料养殖盆(60 cm × 40 cm × 21 cm)中,研究了3种不同饲料(2种不同品牌28%蛋白的商品饲料和玉米秸秆生物发酵饲料)对克氏原螯虾体重增重率和体长增长率的影响,结果显示饲喂生物秸秆的克氏原螯虾的体重增重率为(135.62±3.28)%,体长增长率为(52.41±20.55)%,均高于另外2种28%蛋白的商品饲料,但3种饲料对克氏原螯虾体重增重率均低于本研究中5种不同饲料组和不饲喂饲料组克氏原螯虾的体重增重率和体长增长率,这可能与稻田养殖模式下克氏原螯虾有较大的生活空间,而且还有一部分自然的食物来源等因素有关。即便是不投喂饲料的A6组克氏原螯虾的增重率也高于水泥池或塑料盆中养殖的克氏原螯虾,可能是与克氏原螯虾在天然条件下可以摄食有机物碎屑、着生藻类、丝状藻类、水蚯蚓、蚯蚓、水生昆虫的卵和蛹等有关。本试验中饲喂玉米和大豆的A1和A2组体重和体长增加率均小于其它组,可能的原因是克氏原螯虾对生的玉米和大豆吸收利用率低,而且易导致克氏原螯虾患肠炎,如果在饲喂前将玉米和黄豆高温煮熟后再饲喂,可能使克氏原螯虾对其消化吸收利用率更高,也更安全。
3.2 不同饲料对克氏原螯虾免疫指标的影响
甲壳类动物通过体液免疫因子或协助免疫细胞发挥免疫功能[12],其中ACP会在甲壳类动物血淋巴进行吞噬和包围化的免疫反应中释放[13],SOD能清除超氧化物,保护细胞免受氧化损伤,其活性与生物的免疫水平密切相关[14],LSZ在机体免疫过程中能催化水解细菌的细胞壁而导致细菌溶解死亡,也可诱导调节其他免疫因子的合成与分泌[15]。王天神等[16]在水族箱中研究了3种不同饲料(2种不同品牌的罗氏沼虾商品饲料,1种生物饲料)对克氏原螯虾免疫指标的影响,结果显示,饲喂饲料组克氏原螯虾的ACP的活性略高于生物饲料组(粗蛋白含量为43.72%),而饲喂生物饲料组克氏原螯虾的LSZ和SOD活性高于另外2个饲喂饲料组(粗蛋白含量分别为≥36.0%和≥40.0%),本试验中饲喂蛋白含量高的商品饲料的A5组的ACP活性高于其它组,而LSZ和SOD活性最高的则分别是不饲喂饲料的A6组和饲喂大豆的A2组,出现这种差异,可能与不同的饲料配方和养殖环境有关。赵朝阳等[17]研究表明饥饿一段时间的克氏原螯虾亲虾免疫学指标ACP、LSZ和SOD会显著下降,本试验中不饲喂饲料A6组的克氏原螯虾,ACP和SOD活性最低,其中ACP活性与A1组和A5差异显著(P<0.05),与其它组差异不显著(P>0.05),SOD与其它组差异不显著(P>0.05);本试验中A6组的LSZ活性较其它组高,且与A4和A5组差异显著(P<0.05),这可能与不饲喂饲料A6组克氏原螯虾主要摄食稻田中的水生昆虫、水草和动物尸体等,会接触大量的病原微生物而产生防御有关。
3.3 不同饲料对克氏原螯虾含肉率、失水率、系水力和体组成的影响
含肉率是评价水产品生产性能和经济性状的重要指标之一。本试验中A1~A6组克氏原螯虾的含肉率的范围为(14.16±1.26)%~(17.60±2.03)%,含肉率最高的是A1组,最低的是A4组。孟晶等[10]研究了在水泥池中6个脂肪添加水平的饲料饲喂克氏原螯虾的含肉率为(13.94±0.47)%~(15.35±0.94)%,低于本试验A1和A3组。费志良等[18]研究了南京地区克氏原螯虾成虾春季含肉率为(15.33±2.31)%,也低于本试验A1和A3组,南京地区和本试验各组克氏原螯虾的含肉率均高于盐城市亭湖区养殖克氏原螯虾的含肉率(13.60±0.56)%[19],但低于大别山南湾水库中克氏原螯虾的含肉率19.96%[20]、洞庭湖中克氏原螯虾的含肉率20.21%[21]和贵州湄潭稻田养殖克氏原螯虾的含肉率(18.40±1.6)%[22]。克氏原螯虾含肉率的差异可能与养殖模式、产地、生长阶段和生长周期不同有关。与其它虾类相比,克氏原螯虾的含肉率明显低于其它养殖虾类的含肉率,如日本沼虾含肉率为36.3%[20]、日本对虾含肉率为(39.21±1.94)%[23]、罗氏沼虾为(34.08±0.04)%和南美白对虾为(57.58±1.26)%[19]。
系水力是指肌肉通过自身的物理化学特性对水分的束缚能力,系水力的高低可影响到肌肉的物理形态、风味、颜色及嫩度等特性,水分的流失还会导致可溶性蛋白的流失[24],肌肉系水力越高,肉品质越好[25-26]。本试验中A1~A6组克氏原螯虾肌肉的系水力为(81.20±5.17)%~(87.58±4.87)%,低于张晓红等[4]报道的伊犁马肌肉的系水力为(91.41±3.25)%。有学者采用肌肉蒸煮法计算了生态草鱼(Ctenopharyngodonidellus)、饲料草鱼、1龄黄颡鱼(Pelteobagrusfulvidraco)、池塘组和水库组斑点叉尾鮰(Ietaluruspunetaus)肌肉的失水率分别为(17.17±5.63)%、(15.24±2.89)%、(15.94±3.44)%、(17.19±3.03)%和(27.16±4.80)%,失水率作为系水力的评价指标之一[27-29],研究表明,饲料草鱼肌肉的系水力优于生态草鱼,黄颡鱼肌肉的系水力优于斑点叉尾鮰,池塘斑点叉尾鮰肌肉系水力优于水库组。本试验参照张晓红等[4]采用离心法测定了虾稻养殖模式下不同饲料对克氏原螯虾肌肉的失水率和系水力的影响,结果显示,饲喂玉米的A1组克氏原螯虾的系水力最小,而饲喂添加复方黄芪多糖蛋白质含量≥26%的商品饲料的A3组系水力最大。
含水率是指肉中水分含量的多少,直接影响其贮藏和加工特性。江苏常熟市克氏原螯虾肌肉中的含水率为78.42%[30],低于本试验中各组克氏原螯虾肌肉中含水率。洞庭湖水域、鄱阳湖水域和江苏盱眙县克氏原螯虾肌肉中含水率分别为(79.46±0.41)%[21]、79.59%[31]和80%[32],高于本试验中A5组,而低于其它组。贵州湄潭稻田和盐城市亭湖区养殖的克氏原螯虾肌肉中的含水率为82.07%[22]和(82.35±0.74)%[19],低于本试验中A1组和A6组,而高于本试验中其它组。其它虾类,如澳大利亚红螯螯虾(Cheraxquadricarinatus)的含水率为79.92%[33],除高于本试验A5组克氏原螯虾肌肉的含水率外均低于其它试验组,而罗氏沼虾、日本沼虾、南美白对虾、网箱养殖和池塘养殖凡纳滨对虾肌肉的含水率分别为(76.73±0.01)%、(79.19±0.01)%、(77.68±0.03)%[19]、(68.58±0.94)%和(70.71±1.06)%[34],均低于本试验中各组克氏原螯虾肌肉中的含水率。
澳大利亚红螯螯虾肌肉干燥样品中粗蛋白含量为87.12%[33],高于本试验A1~A6组克氏原螯虾肌肉干燥样品中粗蛋白含量(80.78%±0.86%)~(82.37%±1.10%);孟晶等[10]报道了不同脂肪水平(1.82%~11.95%)饲料饲喂克氏原螯虾对其体组成的影响,其中脂肪水平为9.91%的试验组克氏原螯虾的粗蛋白含量最高为(83.05±1.62)%,高于本试验中克氏原螯虾肌肉粗蛋白含量最高的A5组;当脂肪水平为1.82%时,克氏原螯虾肌肉蛋白含量为78.38%[10],低于本试验各组中克氏原螯虾粗蛋白含量。盐城市亭湖区养殖池塘养殖的克氏原螯虾和罗氏沼虾肌肉干燥样品中粗蛋白含量分别为(76.19±2.40)%和(76.66±0.88)%[19],均低于本试验中各组克氏原螯虾的粗蛋白含量,而该湖区养殖的日本沼虾和南美白对虾肌肉中粗蛋白含量相近分别为(82.17±0.79)%和(82.29±2.35)%,两者略低于本试验的A5组,均高于其它试验组。
脂肪含量与肉质和风味密切相关[35-36],肌间脂肪含量的增加,肉的柔嫩度、多汁性和香味都会有所增加[37]。澳大利亚红螯螯虾和盐城市亭湖区养殖池塘养殖的克氏原螯虾肌肉干燥样品中粗脂肪含量分别为2.05%和1.94%[19, 30],低于本试验A1和A5组,而高于其它组;用添加脂肪的饲料饲喂克氏原螯虾,其肌肉干燥样品中粗脂肪的含量为(3.46±0.45)%~(4.36±0.20)%[10],明显高于本试验各组中粗脂肪的含量;盐城市亭湖区养殖池塘养殖的日本沼虾、罗氏沼虾和南美白对虾肌肉干燥样品中粗脂肪含量分别为(2.71±0.04)%、(1.68±0.01)%和(1.54±0.09)%[19],其中日本沼虾粗脂肪含量高于本试验组克氏原螯虾粗脂肪的含量,而南美白对虾粗脂肪含量低于罗氏沼虾、日本沼虾和本试验各组克氏原螯虾粗脂肪的含量,罗氏沼虾的粗脂肪含量大于本试验A3、A4和A6组,而低于其它组。
克氏原螯虾肌肉的粗灰分是指克氏原螯虾的肌肉在高温炉中有机物质全部氧化后剩余的残渣,主要为矿物质氧化物或盐类等无机物质。澳大利亚红螯螯虾肌肉干燥样品中粗灰分含量为6.36%[30],仅高于本试验A3组,而低于其它组;盐城市亭湖区养殖池塘养殖的克氏原螯虾肌肉干燥样品粗灰分含量为(8.52±0.15)%[19],高于本试验各组粗灰分的含量,该地区养殖的日本沼虾、罗氏沼虾和南美白对虾肌肉干燥样品中粗灰分含量分别为(6.91±0.04)%、(6.58±0.14)%和(6.57±0.05)%[19],其中日本沼虾粗灰分含量低于本试验A4组,而高于其它组;罗氏沼虾和南美白对虾粗灰分含量低于日本沼虾粗灰分含量,高于本试验A2和A3组,而低于其它组。
4 结论
稻田养殖模式下,不同饲料对克氏原螯虾生长特性、非特异性免疫酶活性、含肉率、系水率和体成分的影响不同。A3组体重增加率、体长增加率和系水力最大,与超氧化物歧化酶(SOD)的活性最高的A2组差异不显著,与溶菌酶(LSZ)活性最高的A6组差异不显著,分别与含肉率和粗灰分最高的A1和A4组差异不显著,分别与粗蛋白和粗灰分含量最高的A5和A4组差异不显著;仅与粗脂肪含量最高的A1组和酸性磷酸酶(ACP)活性最高的A5组差异显著。因此, 在本试验条件下,通过综合分析不同饲料对克氏原螯虾生长特性、非特异性免疫酶活性、含肉率、系水率和体成分的影响,建议采用添加复方黄芪多糖蛋白含量≥26%的饲料用于克氏原螯虾的养殖。

