多糖对大豆分离蛋白乳液及乳液凝胶性质的影响
朱秀清 ,王 婵,孙禹凡,钟明明,齐宝坤
(1.东北农业大学食品学院,哈尔滨 150030;2.哈尔滨商业大学食品工程学院,哈尔滨 150076;3.哈尔滨市食品产业研究院,哈尔滨 150028)
人造食品通常以胶体形式存在,如乳液、泡沫、凝胶和分散体等。乳液是两种不混溶液体混合物,一种分散于另一液体中[1];可通过酸诱导、盐诱导、热诱导等方法使乳液形成一种软固体材料,通常称为乳液凝胶,包括传统制造食品奶酪、酸奶、冰淇淋、甜点、涂抹酱和加工肉等[2]。乳液凝胶基于乳液递送系统,调整凝胶组成、尺寸、形状和内部结构,在食品界备受关注。
大豆分离蛋白(Soybean protein isolate,SPI)是重要植物蛋白产品,具有重要营养作用和功能特性,应用广泛。研究发现,单一SPI在功能上无法满足食品加工需要,油脂、蛋白质、糖为重要营养物质[3],影响食品稳定性和质构,通过向SPI 中添加某种特殊成分可改善SPI特殊功能。
多糖与蛋白结合可提高食品乳液及凝胶稳定性,中性及阴性多糖稳定效果优于阳性多糖[4],本文选用阴性和中性多糖与SPI 相互作用。研究复合物形成乳液及乳液凝胶稳定性。瓜尔豆胶是中性多糖,在食品工业中发挥稳定剂和增稠剂作用,与蛋白可通过氢键作用相互结合。Santos 等利用马铃薯蛋白为原料,瓜尔豆胶为稳定剂,制备瓜尔豆胶-马铃薯蛋白乳液,发现乳液稳定性提高[5]。卡拉胶是阴离子多糖,广泛应用于食品中,可作为增稠剂、胶凝剂、稳定剂及脂肪替代品等[6]。
近年蛋白-多糖复合物研究广泛,其中瓜尔豆胶和卡拉胶研究较多,但比较两种多糖对SPI乳液及乳液凝胶稳定性的影响研究甚少。本文比较两种多糖对SPI 乳液稳定性的影响,通过CaCl2诱导形成乳液凝胶,观察多糖种类及浓度对乳液凝胶基本性质影响,为制备具有高稳定性递送系统及低脂肪软固体食品替代物提供理论依据。
1 材料与方法
1.1 材料与试剂
瓜尔豆胶,购自天津市东丽区天大化学试剂厂;卡拉胶,购自天津市东丽区天大化学试剂厂;亚麻籽油,购自北京金世仓粮油贸易有限公司;CaCl2,购自天津市光复精细化工研究所;磷酸氢二钠,购自北京新光化工试剂厂;磷酸二氢钠,购自北京新光化工试剂厂;其他试剂均为分析纯。
1.2 仪器与设备
ULTRA-TURRAX UTL 2000 高压均质机,购自上海标本模型有限公司;LGR20-W 台式高速冷冻离心机,购自北京京立离心机有限公司;Mastersizer 2000 激光粒度仪,购自英国马尔文仪器有限公司;购自UV-5100 型高性能紫外可见分光光度计, 购自上海奥析科学仪器;MAGNA-IR 560傅里叶变换红外光谱仪,购自美国NICOLET 仪器股份有限公司。
1.3 方法
1.3.1 SPI提取
通过碱溶酸沉方法提取大豆分离蛋白[7]。将大豆磨粉后过80 目筛,将所得豆粉与正己烷以料液比1:3(m/V)比例混合,常温下搅拌1 h 脱脂3 次,将脱脂豆粉按料液比为1:10(m/V)加入去离子水,1 mol·L-1NaOH 溶液调豆粉溶液pH 为8.5,以9 000 g 离心30 min 去除其中不溶性物质。取上清液用2 mol·L-1HCl溶液调pH为4.5,再9 000 g离心30 min,蛋白质处于等电点状态而凝聚沉淀。取离心沉淀物,加5倍去离子水,调节pH为7.0,水洗离心(9 000 g、30 min)2 次,弃上清液,将沉淀物冷冻干燥得到SPI。
1.3.2 SPI-多糖乳液制备
将适量SPI分散在磷酸盐缓冲液(0.02 mol·L-1,pH 7.0)中,室温下搅拌2 h 以确保蛋白质完全溶解。将SPI(最终浓度为5%,W/V)溶液分别加入卡拉胶、瓜尔豆胶(最终浓度为0、0.05%、0.1%、0.2%和0.3%,W/V)溶液中,边滴边利用磁力搅拌,形成复合物搅拌30 min后,加入10%(V/V)亚麻籽油,1 100 r·min-1条件下均质3 min,80 MPa下高压均质,制备不同乳液,4 ℃条件贮藏。
1.3.3 SPI-多糖乳液凝胶制备
在1.3.1基础上,向乳液中加入1 mol·L-1CaCl2分散液,使CaCl2浓度达到35 mmol·L-1,搅拌均匀后将其放入60 ℃水浴锅中加热30 min,取出后即于冰水浴中冷却至室温,将新鲜制备乳液凝胶4 ℃冰箱储存备用。
1.3.4 动态光散射
应用Mastersizer 2000 仪器测量蛋白质颗粒尺寸分布(d4,3)和ζ-电位。根据Khales 等[8]方法略有改动。将制备不同带电荷多糖乳液分散到0.02 mol·L-1,pH 7.0磷酸盐缓冲液中,样品稀释至0.1 wt%,在室温下测量3次,计算平均值和标准偏差。分散体(SPI)使用1.450 折射率,连续相使用1.331折射率[9]。
1.3.5 微观结构
采用激光共聚焦(CLSM)观察乳液微观结构,采用Okuro[10]方法略有改动。分别称取一定量尼罗蓝和尼罗红溶于异丙醇中,充分溶解最终浓度分别为1%和0.1%,将制备尼罗红和尼罗蓝过滤膜,过去残渣。准确吸取上述制备新鲜乳液200 μL,稀释5 倍,加入25 μL 尼罗蓝和20 μL 尼罗红,充分混匀,30 min 后制片,全程避光。样品染色以后,置于表面皿上,放置在激光共聚焦显微镜后,采用10倍目镜和60倍物镜,552和488 nm波长下与相应燃料对应,观察拍照。
1.3.6 乳化活性、乳化稳定性
根据Zhang 等[11]方法略改动,测定乳化活性(Emulsion activity index, EAI)及 乳 化 稳 定 性(Emulsion stability index,ESI)取上述1.3.2 新鲜制备乳状液40 μL,8 mL 0.1%十二烷基磺酸钠(SDS)溶液稀释40 倍,漩涡振荡器使其充分混匀。以0.1%SDS 为空白,使用紫外分光光度计在500 nm波长下测量吸光值,记为A0;静置30 min 后再次在500 nm 波长下测量吸光值,记为A30乳化活性(EAI)和乳化稳定性(ESI)测量公式如下:
式中,EAI为单位质量乳液乳化表面积(m2·g-1);N为稀释倍数(200);C 为乳化液形成前蛋白质水溶液中蛋白质质量浓度(g·mL-1);φ为乳化液中油相体积分数0.1;A0为0 min时吸光值;A30为30 min时吸光值。
1.3.7 红外光谱(FTIR)分析
采用程志先和Bekale等[12]方法稍作修改。将多糖与SPI复合物直接冷冻干燥,冷冻干燥后样品置于干燥器中用P2O5充分干燥,取样品1.5 与200 mg溴化钾研磨混匀后压片测定红外光谱。为减少水蒸汽影响干扰,用干燥N2持续注入测量室。测定时波数为4 000~400 cm-1,扫描次数64,分辨率4 cm-1,得到红外吸收曲线采用Peak fitting 软件和高斯曲线拟合,分析蛋白在不同多糖添加量下二级结构含量变化。
1.3.8 凝胶作用力分析
根据Tang等[13]方法,略有改动,分析添加不同多糖处理后形成SPI-多糖乳液凝胶作用力。配置4种缓冲溶液分别为:A(离子水);B(pH 8.0 Tris-Gly 缓冲液);C(B+2% SDS);D(C+1%β-ME);称取2 g 乳液凝胶样品分别置于30 mL 上述4种缓冲溶液中,4 ℃环境下搅拌1 h,将分散液在4 800 g离心力下离心15 min,取上层乳状液经相应缓冲液稀释,600 nm 下测量吸光值,计算浊度值。乳液浊度值计算公式:
式中,T 为每cm 浊度;A 为600 nm 下吸光度;D是稀释倍数;L是容器路径长度(cm)。
1.3.9 质构
按照Zhao 等[14]描述方法并在此基础上略有改动,将1.3.3 所制备乳液凝胶在4 ℃冰箱内储藏过夜,取出放在室温(25 ℃)下平衡至少30 min,利用TA-XT Plus质构仪测定SPI乳状液凝胶硬度、弹性等。探头为P/0.5,侧前速度5 mm·s-1,测定速度1 mm·s-1,测后速度5 mm·s-1,触发力为5 g,测定距离为凝胶高度1/2。
1.3.10 持水性
乳液凝胶持水性测定根据Boutin等[15]方法适当修改。取上述制备乳液凝胶样品约20 g,放置于50 mL 离心管中,在4 ℃、10 000 g 条件下离心15 min,离心后将离心管倒置30 min,使析出水分充分释放,用滤纸小心将释放水分析出后称量。持水率为离心后凝胶中水分含量与离心前总水分含量百分比,计算公式如下:
式中,WHC:持水率;W1:离心析出水后凝胶与离心管总重量;W2:离心前凝胶样品与离心管总重量。
1.4 数据处理
数据均为3 个平行样平均值,采用SPSS 22.0分析软件和Origin 8.0软件处理,ANOVA分析数据差异显著性(P<0.05)。
2 结果与分析
2.1 动态光散射
不同多糖种类及浓度经相同均质压力与SPI相互作用形成乳液平均粒径d4,3变化趋势如表1所示,未添加多糖形成乳液d4,3值一般分布在300 nm,而添加多糖乳液随多糖类型及添加量不同,d4,3均呈增大趋势,电位绝对值不同。当多糖添加量较小(≤0.1%)时,在相同多糖添加量下,乳液d4,3表现为阴离子多糖乳液<中性多糖乳液,即SPI-卡拉胶乳液<SPI-瓜尔豆胶乳液,在多糖添加量为0.1%时,形成稳定复合物,d4,3增加量相对于其他增加量较小,电位绝对值最大,证明在多糖添加量为0.1%时形成乳液最稳定,优于空白组。当多糖添加量较高(>0.1%)时,在相同多糖添加量下乳液d4,3表现为SPI-卡拉胶乳液<SPI-瓜尔豆胶乳液,电位绝对值随多糖浓度添加降低。由于卡拉胶是阴离子多糖,加入带负电荷SPI 乳状液中二者相互排斥,导致电位绝对值明显降低,d4,3略增加;瓜尔豆胶是中性多糖,加入带负电荷SPI乳液中二者通过氢键及疏水相互作用结合,电位绝对值无明显变化,d4,3增加;当添加多糖浓度比较高时,溶液粘度比较大,流动性较差,形成乳状液具有更大粒径。结果表明,当添加多糖浓度为0.1%时,乳液可达最稳定状态,阴离子多糖-卡拉胶形成乳液稳定性优于中性多糖-瓜尔豆胶所形成乳液。

表1 不同多糖及添加量下乳液动态光散射Table 1 Dynamic light scattering of emulsions with different addition rates of different polysaccharides and polysaccharide
2.2 乳液微观结构分析
不同类型多糖及不同多糖添加量下形成乳液微观结构见图1。可见,当卡拉胶浓度较低(≤0.1%)时,乳液分散状态较好,粒径较小较均匀;在卡拉胶添加量为0.1%时,乳液稳定性最佳,由于阴离子多糖可通过静电相互作用与SPI形成使系统和乳液更稳定。由图1 可知,当浓度超过0.2%、0.3%时粒径明显变大,与前文粒径电位结果一致。瓜尔豆胶在不同浓度下形成的乳液,多糖添加量为0.1%时粒径最小,浓度超过0.1%时,粒径明显变大。结果表明,多糖添加量为0.1%时,形成乳液相对较稳定,卡拉胶稳定乳液优于瓜尔豆胶稳定乳液。
2.3 乳化性分析
由图2 可知,两种多糖可改善乳液乳化特性。阴离子多糖卡拉胶-SPI 形成乳液,随卡拉胶添加量增加EAI、ESI 呈现先增后降趋势,在添加量为0.1%时达最高,这是因为在中性条件下,卡拉胶与SPI 带正电荷部分结合形成SPI-卡拉胶复合物,吸附于界面,提高乳化性,一定浓度卡拉胶可增加体系黏稠度、增大界面膜厚度,防止乳粒聚集沉淀,提高其稳定性,而卡拉胶添加量达0.2%、0.3%时,EAI、ESI 明显下降说明卡拉胶浓度过高不利于乳液稳定性,这是由于多糖与蛋白质在界面上竞争吸附作用较强,使界面蛋白吸附量减小,乳化性降低。中性多糖瓜尔豆胶-SPI 所形成乳液,随瓜尔豆胶添加量增加EAI 呈先升后降趋势,ESI呈先降后升趋势。在添加量为0.1%时EAI达最大,因为随多糖添加量变化可改变SPI二级结构含量,改善蛋白质乳化性,这与粒径电位结论一致。
2.4 红外光谱(FTIR)分析
通过红外光谱表征不同多糖种类及添加量稳定蛋白乳液中SPI 二级结构含量变化,利用Peak Fit拟合软件分析计算图谱(见图3),得到不同多糖与SPI 形成乳液中SPI 二级结构含量变化如表2 所示。结果表明,相比未添加多糖SPI乳液,添加多糖后乳液中SPI β-折叠含量均增加,当多糖添加量较低(≤0.1%)时,β-折叠呈增加趋势,α-螺旋、β-转角及无规则卷曲呈减少趋势;多糖添加量超过0.1%时,β-折叠、β-转角及无规则卷曲含量均降低,α-螺旋含量升高,说明多糖添加改变SPI中α-螺旋、β-折叠、β-转角和无规则卷曲4种二级结构含量,与对乳液稳定性与蛋白结构改变关系预测结论一致。卡拉胶与瓜尔豆胶添加量为0.1%时,β-折叠结构含量最高,高达56.1%和45.0%,其他含量变化不明显,因此推测SPI二级结构改变可增加柔性结构,蛋白质分子由无序变为有序,改变SPI基本性质,提高乳化性及稳定性。
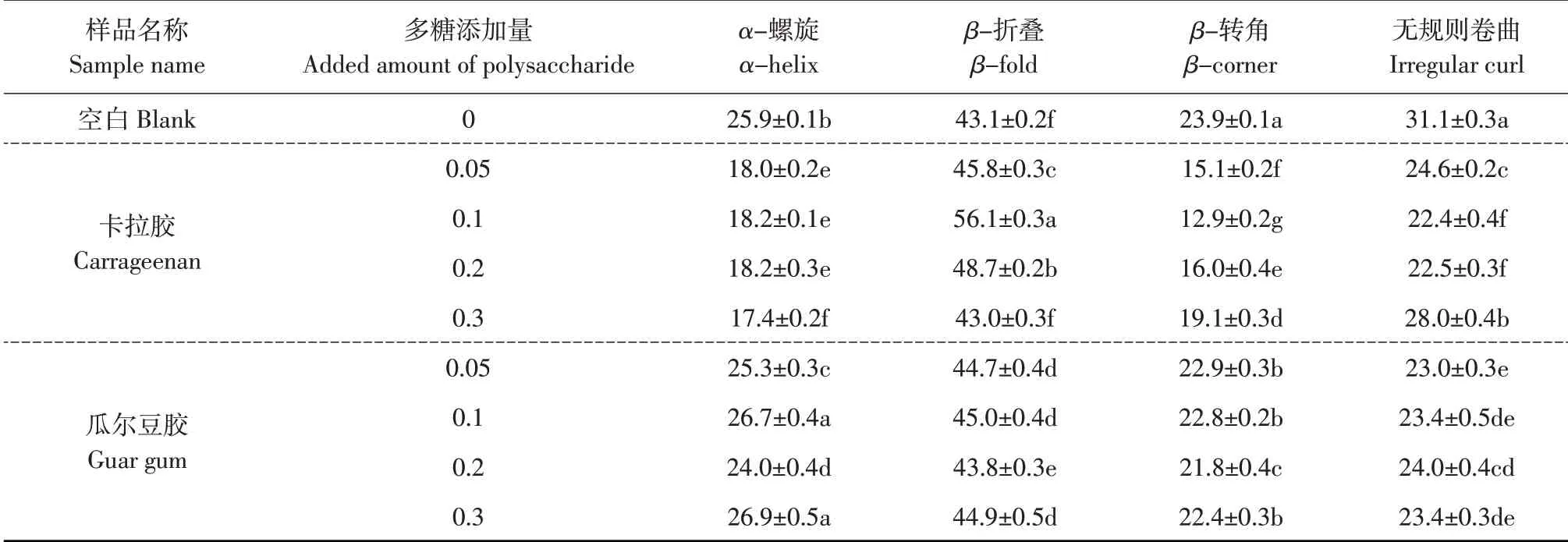
表2 不同多糖乳液中蛋白二级结构含量Table 2 Secondary structure of proteins in different polysaccharide emulsions (%)
2.5 凝胶作用力分析
由图4可见,不同种类乳液凝胶在B中溶解度比A 中溶解度高,而瓜尔豆胶-SPI 乳液凝胶溶解度比卡拉胶-SPI 乳液凝胶溶解小,但高于对照组。各样品在C中溶解度高于B,说明疏水相互作用在维持凝胶结构中发挥作用;而添加多糖样品在C和B中溶解度差值略大于空白组样品,说明添加多糖促进SPI 乳液在形成凝胶过程中疏水键生成,各样品在D中溶解度高于C,说明二硫键在凝胶结构中发挥作用。乳液凝胶在各缓冲溶液中溶解度差值证实多糖加入增强各种作用力,增加凝胶强度。
2.6 质构
不同多糖及多糖添加量对CaCl2诱导SPI乳液凝胶硬度及黏弹性的影响见表3。
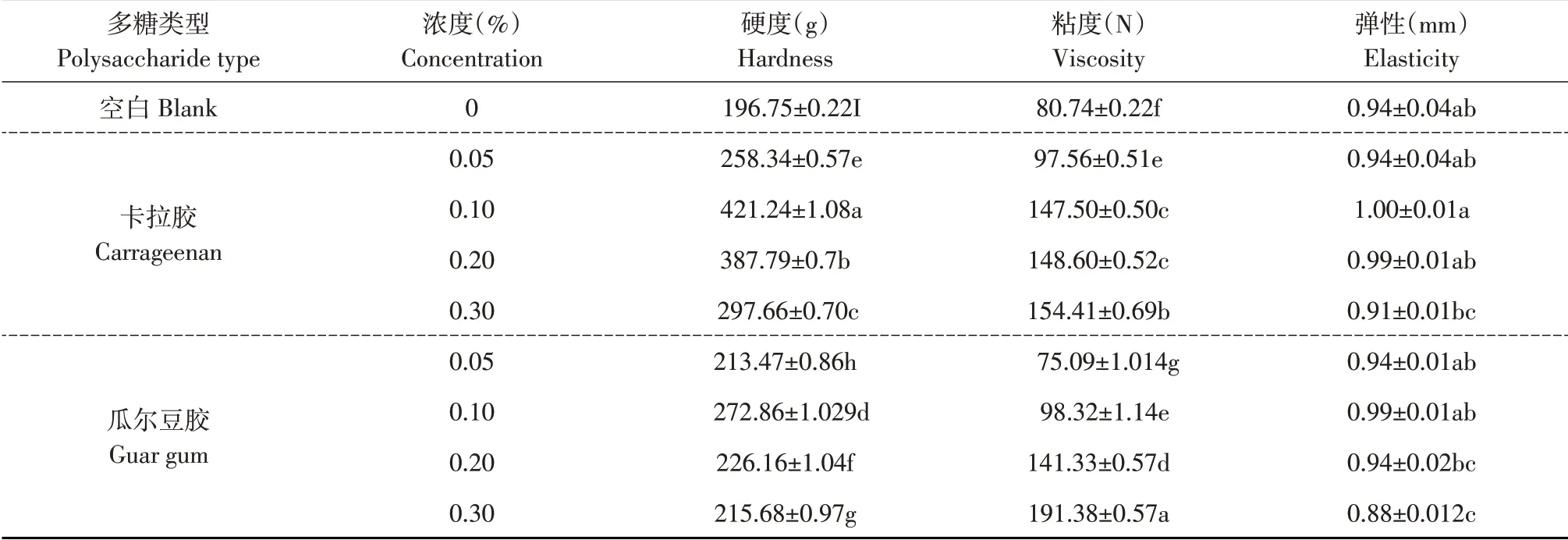
表3 不同多糖及多糖添加量下乳液凝胶质构Table 3 Texture of emulsion gels with different polysaccharides and polysaccharides added
由表3可知,卡拉胶、瓜尔豆胶两种多糖形成乳液凝胶硬度及黏弹性均差异明显,由于多糖添加量不同所形成乳液凝胶表现不同质地特性,表明多糖浓度及类型对乳液凝胶影响较大。多糖添加量增加形成乳液凝胶黏度逐渐增大,瓜尔豆胶-SPI乳液凝胶更明显;当多糖添加量0~0.1%时,制备乳液凝胶硬度和弹性呈增加趋势,0.2%~0.3%在中性条件下,卡拉胶与SPI呈相互排斥状态时,由于体系排阻作用使卡拉胶对大豆分离蛋白凝胶增效,加入卡拉胶固定大量水分,增浓大豆蛋白,促进凝胶形成,提高凝胶强度[3],瓜尔豆胶可通过增加体系黏度发挥增稠作用提高凝胶硬度及弹性,但多糖超过某一浓度,因排斥作用而产生絮凝,导致凝胶硬度及弹性逐渐降低。Tang 等研究证明凝胶微观结构影响凝胶硬度,当多糖添加量为0.1%时,凝胶具有最高硬度及弹性,可形成更聚集凝胶网络,而多糖添加量超过0.1%时硬度及弹性呈相反趋势[16]。因此,当多糖添加量为0.1%时乳液凝胶硬度及弹性具有最优表现,阴离子多糖卡拉胶形成乳液凝胶结构性质更佳。
2.7 持水率
不同多糖及多糖添加量对CaCl2诱导SPI 乳液凝胶持水率影响见图5。当多糖添加量0~0.1%时,乳液凝胶WHC随多糖添加量增加而增加,多糖添加量0.1%时持水率达最高,这是因为多糖与SPI产生协同效应,混合乳液凝胶网络结构稳定,因此截留水量大;多糖添加量为0.1%~0.3%时,随多糖添加量增加,形成乳液凝胶WHC降低,因为随多糖含量增加降低混合凝胶强度,大分子热力学活性和凝胶网络微观结构对WHC影响较大,高浓度生物聚合物非相容性诱导形成更多孔网络,通过毛细管力具有较低持水能力,因此增加脱水能力,导致渗出网络水分增加,此结论与Kuhun等[17]及任菲[18]研究结果相似。通过以上分析得出结论,当多糖添加量为0.1%时所形成乳液凝胶持水率最高,阴离子多糖作为稳定剂优于中性多糖。
3 结 论
当多糖添加量为0.1%时所形成SPI-多糖复合物乳液粒径分布均匀稳定,乳滴形状规则,表现较好乳化活性和乳化稳定性,形成乳液凝胶硬度、弹性及持水能力显著(P<0.05)增加。多糖添加改变SPI二级结构,提高乳化能力添加多糖为卡拉胶时SPI中β-折叠结构含量最高,影响蛋白质构象柔韧性,增加乳液稳定性;当多糖添加量超过或低于0.1%时对乳液稳定性及形成乳液凝胶宏观结果造成不利影响。因此,本试验结果表明,多糖添加量为0.1%时,形成乳液最稳定最好,凝胶硬度、粘弹性及持水能力最高,阴离子多糖优于中性多糖。

