香菇多糖纯化前后结构和生物活性的比较
王嘉铭,雷于国,胡国元*,但冬梅
(1. 武汉工程大学 绿色化工过程教育部重点实验室/环境生态与生物工程学院,湖北 武汉 430205;2. 湖北裕国菇业股份有限公司,湖北 随州 441300)
香菇(Lentinula edodes)又名香菌、香蕈、花菇,是一种重要的食用菌[1],具有良好的食用和药用功能。 香菇多糖作为香菇中一种重要的活性组分,在食品,医药等方面有广泛的应用。 研究发现,香菇多糖具有抗氧化[2],抗病毒[3]以及抗肿瘤[4]等功效,并且因为它丰富的来源和极低的毒副作用,其逐渐成为当前的研究热点。 研究发现香菇具有降脂[5]和降血糖[6]的作用,香菇多糖对溃疡性结肠炎小鼠也有一定改善作用[7]。
目前关于香菇提取物分离纯化,结构特性和活性的报道已经很多,如:单联刚[8]通过无机陶瓷膜超滤法使回收率达到了95.4%;唐庆九等[9]通过对香菇提取物分析,首次分离到了腺嘌呤;陈万超等[10]对香菇特征指纹图谱进行了构建;汲晨锋等[11]研究表明香菇多糖结构与抗肿瘤间的关系,其结构主要体现为同多糖和杂多糖两种形式;魏元[12]研究表明香菇多糖主要是阿拉伯糖和鼠李糖组成的吡喃型多糖;张超等[6]通过对香菇等食用菌提取物的研究发现了他们胰岛素代谢的影响;CHEN Y 等[2]通过研究发现香菇多糖具有抗氧化活性;胡国元等[20]研究发现香菇多糖对金黄色葡萄球菌具有较好的抑制作用。 但是系统性对纯化前后香菇多糖结构和生物活性进行比较的报道还较少,前期研究结果显示从香菇未成熟期子实体提取的粗多糖醇沉组分的抗氧化等生物活性优于其他生育期。
作者通过对香菇未成熟期子实体粗多糖组分进行分离纯化,然后通过紫外光谱,红外光谱,刚果红络合物分析,电子显微镜扫描,粘均相对分子质量测定,抗氧化活性以及抑菌活性的测定,比较了纯化前后的香菇多糖在结构和生物活性上的差异,为活性香菇多糖的制备和利用提供一定的依据。
1 材料与方法
1.1 材料和试剂
香菇未成熟期子实体(菌幕形成,菌盖直径约为1.5~2.0 cm):湖北随州裕国菇业有限公司提供。供试样品60℃烘干后,粉碎过60 目筛(0.25 mm)备用。
考马斯亮蓝、纤维素DEAE-52,源叶生物、核黄素、甲硫氨酸、氮蓝四唑、1,1-二苯基-2-硝基苯肼(DPPH)、阿拉丁公司产品;牛肉浸膏:北京双旋微生物培养基制品厂产品;蛋白胨:安琪酵母股份有限公司产品;琼脂:北京生东科技有限公司产品;金黄色葡萄球菌:作者所在实验室保藏。
1.2 仪器与设备
Genesys 10s 紫外可见分光光度计:美国Thermo Scientific 公司产品;JSM-5510LV 型扫描电镜;Nicolet 380 红外光谱仪:美国赛默飞公司产品;AL 104 电子分析天平:梅特勒-托利多上海有限公司产品;FW-100 高速万能粉碎机:北京市永光明医疗仪器厂产品;SHD-DIII 循环水式多用真空泵:巩义市予华仪器有限责任公司产品;GZX-9030 MBE数显鼓风干燥箱:上海博讯实业有限公司医疗设备厂产品;DK-S28 电热恒温水浴锅:上海精宏实验设备有限公司产品;LDZX-50KBS 立式压力蒸汽灭菌锅;上海申安医疗器械厂产品。
1.3 实验条件
1.3.1 粗多糖的制备 称取香菇样品10 g,按照料液质量体积比1 g:20 mL 加入蒸馏水,100℃提取2 h,抽滤,得到浸提液后按照浓缩比1:4 进行旋转蒸发浓缩,加入无水乙醇至终体积分数20%,4℃静置12 h,离心收集沉淀,烘干后得香菇粗多糖样品(命名为L0),避光保存备用。
1.3.2 粗多糖的脱色和脱蛋白 称取5 g 香菇粗多糖样品,溶于250 mL 蒸馏水后,充分溶解过滤备用。 根据蛋白质与氯仿溶液混合会变性沉降的特点,配置氯仿-正丁醇混合溶液,氯仿和正丁醇体积比为4∶1,向样液中加入配置好的氯仿-正丁醇混合液(样液的1/3),在25℃摇床中以 150 r/min 振摇30 min 后,放入离心机中在4 000 r/min 条件下离心15 min,用移液枪吸出水层,再加入氯仿-正丁醇混合液重复2 次。
取脱蛋白的多糖溶液,加入质量分数1%活性炭,调节 pH 至 3.5,置于 20 ℃摇床中以 190 r/min振摇100 min 后过滤。
1.3.3 粗多糖柱层析 将Cellulose DEAE-52 填料在0.5 mol/L 的NaOH 溶液中浸泡12 h,用蒸馏水充分洗涤至中性后抽滤; 然后转入0.5 mol/L 的HCl溶液中浸泡12 h,用蒸馏水洗涤至中性后抽滤;最后再用0.5 mol/L 的NaOH 溶液浸泡12 h,洗涤至中性。 湿法装柱,用蒸馏水平衡24 h 后备用。
将脱蛋白质和脱色后的多糖溶液加入到处理过的Cellulose DEAE-52 纤维素柱中,依次用蒸馏水、0.2 mol/L、0.4 mol/L 的 NaCl 溶液进行梯 度洗脱,控制流速在 15 滴/min。 每只试管收集 10 mL,采用苯酚-硫酸法在490 nm 处检测OD 值,以吸光度为纵坐标,管数为横坐标制作洗脱曲线[13],合并含多糖的各管样品,透析脱盐,冷冻干燥,收集纯化后多糖样品 得到3 个多糖组分,依次命名L1,L2,L3。
1.3.4 紫外光谱扫描分析 分别将各多糖样品溶于蒸馏水中,在200~400 nm 范围内进行紫外扫描,根据260 nm 和280 nm 等处是否有吸收峰,判断样品中是否含有核酸和蛋白质。
1.3.5 红外光谱扫描分析 取适量的各多糖样品,和溴化钾充分碾磨混合后压片,用红外色谱仪在红外光4 000~450 cm-1区间下扫描。
1.3.6 粘均相对分子质量的测定 准确称取0.5 g各组分多糖样品,溶解于2 mol/L 的NaCl 溶液中,用3# 砂芯漏斗抽滤,弃去初滤液,精密量取续滤液10 mL 自管沿管壁加入乌氏粘度计。 乌氏粘度计垂直固定于水浴槽中10 min 以上,使管内温度和水浴温度平衡,然后按照文献[15]对各组分特性粘度进行测定,其中 a 值由张翼伸(1983)确定为 1[14],再由标准葡聚糖样品测得K 值,最后根据[η]=KMa计算各组分粘均相对分子质量[15]。
1.3.7 电子显微镜扫描 取少量的各多糖样品粉末,减压条件下喷镀一层金原子,用扫描电子显微镜在15 kV 的加速电压下放大1 000 倍成像。
1.3.8 刚果红分析 分别取40 mg 多糖样品溶于20 mL 蒸馏水,加入 2 mL 刚果红溶液,分别加入NaOH 溶液至浓度为(0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5 mol/L),在 200~800 nm 进行紫外扫描,测定最大吸收峰,观察最大吸收峰的变化,以NaOH 浓度为横坐标,最大吸收峰为纵坐标制作曲线[16]。
1.3.9 抗氧化活性测定
1) 对 DPPH 自由基的清除测定 参照 LIU Yong 方法进行修改[17],取各多糖样品溶于蒸馏水中,配成 0.5 mg/L 的溶液。 取 5mL 的 6.4×10-4mol/L DHHP,定容于50 mL 容量瓶中摇匀待测。 利用DPPH 溶液的特征紫红色吸收峰,按照A0:2.0mL DPPH+2.0 mL 溶剂;A1:2.0 mL DPPH 溶液+2.0 mL样品溶液;Aj:2.0 mL 样品溶液+2.0 mL 溶剂; 在波长517 nm 处用分光光度计测定各个溶液吸光度,吸收峰的下降表示对有机自由基的清除能力。 清除率计算公式为:清除率(%)=(1-(AI-AJ)/A)×100%。
2) 对羟自由基的清除测定 参照ZHU Liancai方法进行修改[18]取各多糖样品溶于蒸馏水中,配成0.5 mg/L 的溶液。 采用邻二氮菲-Fe2+氧化法,吸取4.0 mL pH 7.4 磷酸钠缓冲液,加入1.5 mL 5.0 mmol/L 邻二氮菲,充分混匀。 然后再加入 1 mL 7.5 mmol/L FeSO4溶液,立即混匀。 加入1.0 mL 各组分多糖溶液,再加入1.5 mL 蒸馏水补充体积,最后加入1.0 mL 1%H2O2溶液,混匀,于 37℃水浴中反应 60 min,在536 nm 测定吸光度。 按照公式进行计算:清除率(%)=(A加药-A损伤)/(A未损-A损伤)。 式中:A加药为加入样品实验组测得的吸光度,A损伤为加入H2O2而不加入抗氧剂所测得吸光度,A未损为不加H2O2和抗氧化剂所测得吸光度。
3) 对超氧阴离子的清除测定 取各多糖样品溶于蒸馏水中,配成0.5 mg/L 的溶液。 采用光照核黄素-氮蓝四唑(NBT)法[19],取 1 mL pH 7.8 磷酸缓冲液,加入 0.5 mL 3.3×10-5mol/L 核黄素、0.5 mL 0.02 mol/L甲硫氨酸、5.1×10-4mol/L NBT 和 1 mL 样品溶液。光照20 min 后与560 nm 测定样品吸光度。 以溶剂代替样品测定空白吸光度A0。 按照公式进行计算:清除率(%)=(1-(A/A0))×100%。 式中 A0为溶剂替代样品测定的空白吸光度;A 为样品吸光度。
1.3.10 抑菌活性的测定
1)多糖溶液的配置 将各多糖样品溶于蒸馏水中,配制成10 mg/mL 的多糖溶液,通过孔径为0.45 μm的滤器过滤后放置于4℃冰箱保存,备用。
2) 菌悬液的制备 将金黄色葡萄球菌接种到牛肉膏蛋白胨培养基制成的平板上,置于37℃培养24 h 进行活化,然后挑取一块菌苔,用无菌生理盐水进行稀释,制成含菌量为106~108CFU/mL 的菌悬液,置于4℃冰箱中保存,备用。
3) 最小抑制浓度的测定 在装有固体培养基的平板上加入50 μm 菌悬液,并用涂布棒涂布均匀,将滤纸片放入经两倍稀释法稀释后的不同浓度的多糖溶液中浸泡20 min,用蒸馏水做对照。 用灭菌后的镊子将直径6 mm 滤纸片夹出放置于含菌平板上,重复3 次,37 ℃倒置培养24 h,然后用十字交叉法,测量抑菌圈直径大小,计算平均值,以有抑菌圈的最低浓度为最小抑制浓度 (minimum inhibitory concentration)[20-21]。
2 结果与分析
2.1 粗多糖的纯化
香菇粗多糖样品(L0)为黑褐色,呈块状,经过脱蛋白、脱色和纤维素柱层析纯化后,为淡黄色,表明粗多糖中部分杂质已经被脱除。 洗脱曲线如图1所示,L0 经水洗脱(1~30 管)后,得到多糖组分 L1(4~14 管);经 0.2 mol/L NaCl 线性梯度洗脱(31~60管) 后得到多糖组分 L2 (31~44 管); 经 0.4 mol/L NaCl 线性梯度洗脱(61~90 管)后得到多糖组分L3(61~69 管)。 其中 L1 为淡黄色块状,L2 和 L3 均为淡黄色粉末。 根据峰面积和含量大小成正比的关系,可知L1 组分最多,为多糖主要成分。
2.2 紫外光谱扫描分析
对纯化前后各组分多糖在200~400 nm 进行紫外扫描,结果如图2 所示,纯化后组分在260 nm 和280 nm 波长范围内仅有一个微弱的吸收峰,而未纯化样品在260 nm 和280 nm 波长范围内有较强的吸收峰,说明经过纯化后,多糖样品中基本不含核酸和蛋白质杂质。

图1 香菇粗多糖经DEAE-纤维素-52 柱层析梯度洗脱曲线Fig 1 Elution curve of crude polysaccharide by DEAE-cellulose-52 chromatography.
图2 不同香菇多糖组分紫外光图谱Fig 2 UV spectra of different polysaccharides fractions
2.3 红外光谱扫描分析
当一束红外光透过物质,和红外光震动频率一样的基团会吸收能量跃迁。 如图3 所示,3 420.14 cm-1(L0)、3 387.06 cm-1(L1)、3 450.59 cm-1(L2)、3 445.11 cm-1(L3)吸收峰由于糖链上的伸缩振动引起[22]。 2 932.26 cm-1(L0)、2 936.14 cm-1(L1)吸收峰由于 C-H 的伸缩振动引起。 1 700~1 750 cm-1内4个组分多糖均没有很强的吸收峰,表明4 个多糖组分中均不含糖醛成分[23]。 1 641.08 cm-1(L0)、1 647.57 cm-1(L1)、1 634.97 cm-1(L2)、1 635.56 cm-1(L3)出现C=O特征吸收峰[24]。 1 406.68 cm-1(L0)、1 410.79 cm-1(L1)、1 414.74 cm-1(L3)由于 C-H 弯曲引起,为多糖类化合物的特征吸收峰,进一步的验证了样品为多糖类物质。 同时,L1 多糖组分在1 078.96 cm-1和1 052.24 cm-1存在较强的吸收峰,是糖苷键C-O-C 的非对称振动峰,并且在1 100~1 000 cm-1只存在两个吸收峰,表明L1 多糖组分中存在呋喃糖环;4 个多糖组分在890 cm-1附近均有较强的吸收峰,表明存在β-糖苷键;纯化前多糖组分L0 与L1 表现出相似的结构,但是吸收峰强度较L1 弱,进一步验证L1 为多糖中的主要成分。 而L2 和L3 多糖组分在1 075.24 cm-1和1 078.98 cm-1处的吸收峰归于吡喃糖环上C-O 的伸缩振动。 与L1 多糖组分相比,L2 和L3 虽然与 L1吸收峰较为相似,但是在指纹区却没有出现密集的高强度吸收峰,根据红外光谱分析所能获得的信息较少。
图3 不同香菇多糖组分红外光图谱Fig 3 FI-IR spectra of different polysaccharides fractions
2.4 粘均相对分子质量的测定
纯化前后香菇多糖样品粘均相对分子质量如图4 所示,纯化前粗多糖粘均相对分子质量为2.19×105,纯化后的多糖组分粘均相对分子质量分别为 8.34×104、4.40×104、3.66×104,纯化后相对分子质量明显低于纯化前,进一步说明经过脱蛋白,脱色和纤维素柱层析后,许多大分子杂质被去除。 同时,洗脱时盐浓度对相对分子质量也有一定的影响,即盐浓度越高,洗脱所得组分相对分子质量越小。
图4 不同香菇多糖组分粘均相对分子质量Fig 4 Viscosity-average molecular weight of different polysaccharides fractions
2.5 电子显微镜扫描
4 个不同多糖组分扫描电镜如图5.所示,L0 呈现纤维状,可能由于不同的分子或者分子基团聚集成不同形态的聚集体所造成;L1 呈现不规则的块状,中间有一定的缝隙,有突出的褶皱结构,说明多糖分子间有一定的排斥力,吸引力较弱;L2 和L3 形态较为相似,都表现为碎屑状堆积,分子间存在孔洞间隙,使得多糖并未完全集合。 通过电镜扫描图片,进一步证实了分离出的组分中所含物质和多糖种类都有一定的差异,其中L1 与L2,L3 组分差异较大。

图5 不同香菇多糖组分电镜照片Fig5 Electronmicroscopyimagesofdifferentpolysaccharide fractions
2.6 刚果红分析
刚果红与具有三螺旋结构的多糖能够形成络合物,在一定NaOH 浓度内,最大吸收波长与为结合的刚果红相比会发生红移(向波长增大的方向移动)。4 个不同多糖组分与刚果红络合物最大吸收波长与 NaOH 浓度关系如图 6 所示。 L0 和 L1 在NaOH 浓度小于0.3 mol/L 时,最大吸收峰与对照组相比发生红移,说明L0 和L1 中存在三螺旋结构,与刚果红络合后在NaOH 作用下发生一定的红移,当NaOH 浓度大于0.3 mol/L 时,最大吸收波长开始表现出下降趋势,表明三螺旋结构解体,变成没有规则的自由卷曲状态;而L2 和L3 最大吸收波长随着NaOH 浓度增加一直下降,与对照组趋势相似,没有发生红移,表明L2 和L3 中不含有三螺旋结构。
2.7 对DPPH 自由基清除能力
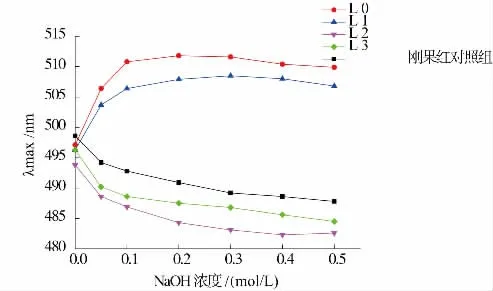
图6 刚果红络合物随NaOH 浓度改变其最大吸收波长的变化Fig 6 Maximum absorption of Congo red complex in solution with various concentrations of NaOH
纯化前后不同多糖组分对DPPH 自由基清除效果如图7 所示,在DPPH 自由基清除实验中,4 个组分与标准抗氧化剂VC 相比,对DPPH 自由基均有一定的清除作用,并且随着浓度升高,对DPPH清除作用逐渐增大,4 个多糖组分均在8 mg/mL 时,清除率达到最大,分别为 L0 (66.06±1.16)%、L1(64.22±1.10)%、L2(56.53±0.91)%、L3(33.61±0.55)%;VC 活性明显高于各个组分,在2 mg/mL 时就达到92.50%。 同时纯化前后多糖组分对DPPH 清除能力有一定的差异,L0 对DPPH 清除能力最强,可能是因为未纯化的L0 中含有蛋白质以及其他的活性物质,使其在和多糖的共同作用下对DPPH 有更好的清除作用。 而纯化后的3 个组份中,L1 清除效果明显高于L2 和L3。
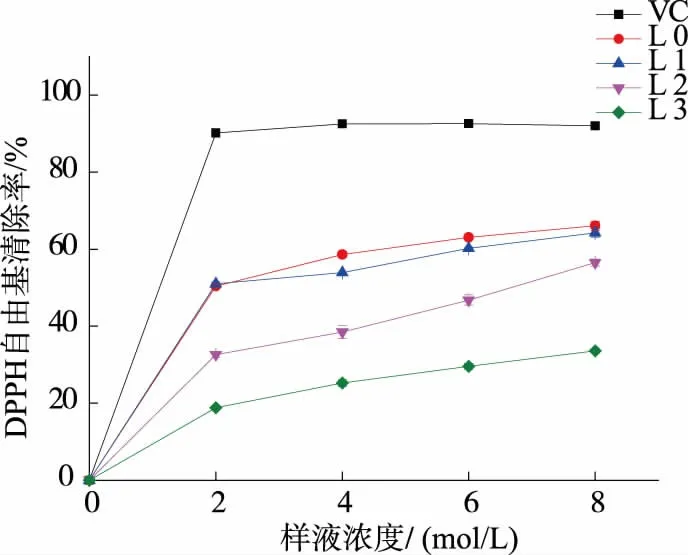
图7 香菇多糖对DPPH 自由基的清除能力Fig 7 DPPH free radical scavenging capacities of different polysaccharides fractions
2.8 对羟自由基的清除能力
纯化前后不同组分对羟自由基清除能力如图8所示,在羟自由基清除实验中,虽然四个多糖组分与标准抗氧化剂(VC)相比,VC 在 2 mol/L 时对羟自由基清除率已经达到(97.11±0.483)%,但是 4 个多糖组分对羟自由基扔有一定的清除能力,并且随着样液浓度提高,清除作用逐渐升高,均在8 mg/mL时达到最大,分别为 L0(29.31±1.03)%、L1(25.55±0.48)%、L2(21.41±0.50)%、L3(18.50±0.44)%。 未纯化多糖组分L0 对羟自由基清除能力高于纯化后的样品,纯化后的样品L1 清除能力与L0 接近,明显高于L2 和L3 组分,而L2 和L3 对羟自由基的清除活性较为相似。
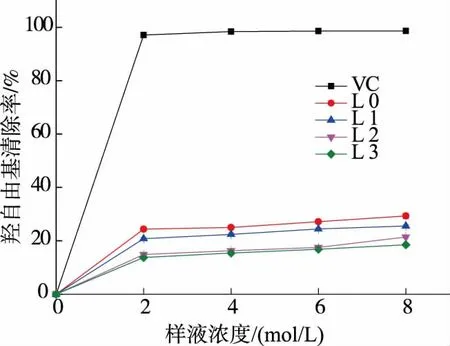
图8 香菇多糖对羟自由基的清除能力Fig 8 Hydroxyl radical scavenging capacities of different polysaccharides fractions
2.9 对超氧离子清除能力
纯化前后不同组分对超氧阴离子清除能力如图9 所示,在超氧阴离子清除实验中,VC 对超氧阴离子的清除作用明显高于4 个多糖组分,在2 mg/L时即达到(97.47±0.54)%,而 4 个多糖组分对超氧阴离子清除能力较为接近,其中L0 清除能力最强,在8 mg/mL 时最大,可以达到(19.90±0.46)%,L1 清除能力高于L2 和L3 组分,而当质量浓度大于7 mg/mL时,L3 的清除能力超过L2。
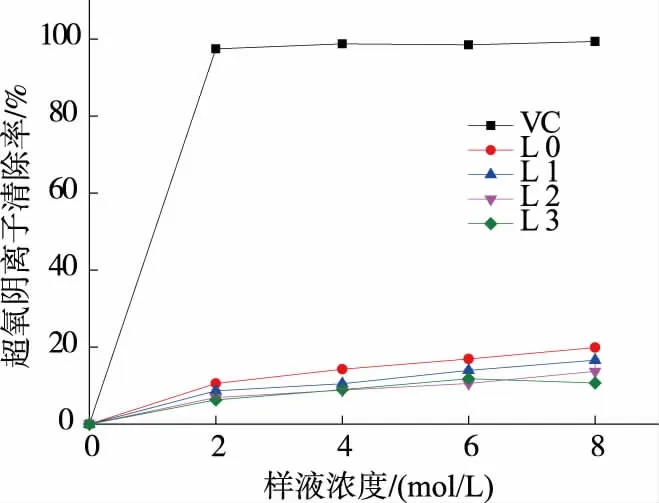
图9 香菇多糖对超氧离子的清除能力Fig 9 Superoxide anion radical scavenging capacities of
2.10 抑菌活性的测定
2.10.1 不同多糖组分的抑菌活性 不同多糖组分对金黄色葡萄球菌的抑制作用如表1 所示,L2 和L3 多糖组分对金黄色葡萄球菌均无抑制作用;L0和L1 多糖组分对金黄色葡萄球菌均有一定的抑制作用,其中L1 对金黄色葡萄球菌的抑制作用比L0好,说明纯化后的多糖具有更好的抑菌作用,可能由于L1 经纯化后其中活性多糖成分含量更高,使其对金黄色葡萄球菌有更好的抑菌作用。
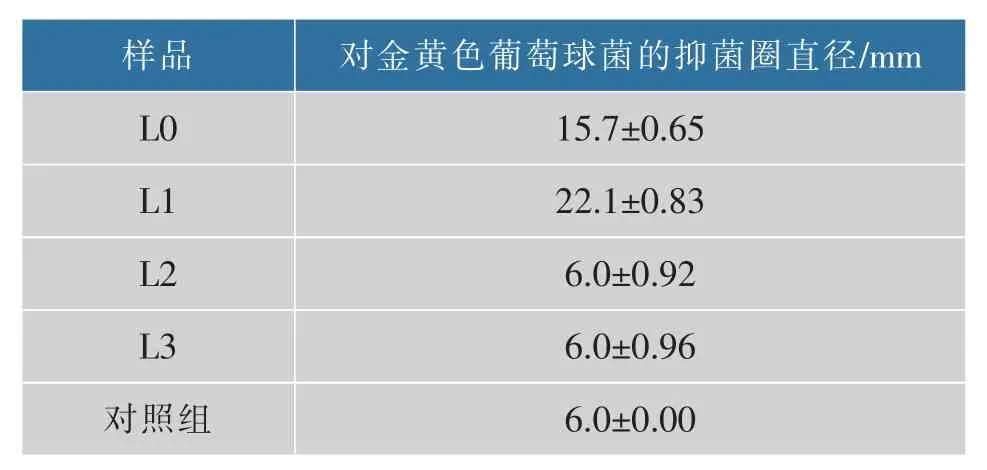
表1 香菇不同多糖组分的抑菌活性Table 1 Antimicrobial activities of different polysaccharides fractions
2.10.2 香菇不同多糖组分的最小抑制浓度 以金黄色葡萄球菌为供试菌株,研究不同组分多糖的最小抑菌浓度(MIC),结果如表 2.所示,L0 和 L1 对金黄色葡萄球菌的最小抑制质量浓度分别为5 mg/mL和2.5 mg/mL,纯化后的多糖组分L1 对金黄色葡萄球菌的最小抑制浓度明显低于未纯化组分L0。
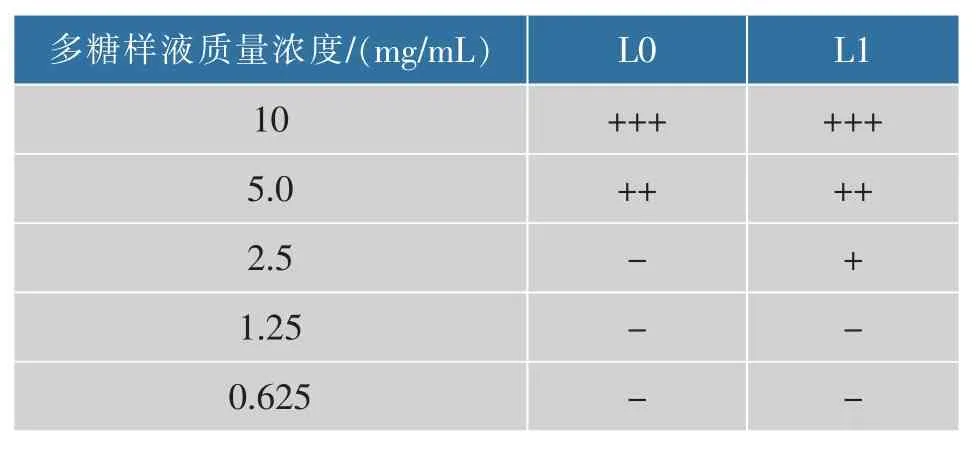
表2 香菇不同多糖组分的最小抑菌浓度Table 2 The MIC of different polysaccharides fractions
3 结 语
作者前期对不同生长发育期香菇子实体不同醇沉组分粗多糖结构和生物活性进行了研究,发现香菇未成熟期子实体粗多糖体积分数20%醇沉组分具有最优的生物活性,由于粗多糖中含有的也会对活性有一定的影响,为了进一步探究香菇粗多糖中的色素和蛋白质等物质对其生物活性的影响,作者通过对香菇未成熟期子实体粗多糖体积分数20%醇沉组分进行纯化,比较纯化前后香菇多糖的结构及其生物活性差异。
供试样品的结构分析结构显示:紫外光谱扫描图谱表明L1、L2 和L3 不含有核酸和蛋白质,而L0出现较强的核酸和蛋白质吸收峰;根据红外光谱扫描和SEM 分析,发现纯化前后香菇多糖均含有显著的多糖特征吸收峰,并且都能观察到其中起活性作用的主要部位β-糖苷键,L0 可能由于不同的分子或者分子基团聚集成不同形态的聚集体而呈现纤维状,但是L1 呈现出有褶皱的块状,L2 和L3 呈现碎屑状堆积,进一步证明了纯化后多糖中物质或者种类发生了变化; 刚果红结果表明,L1 中仍保留了L0 中存在的三螺旋结构,而L2 和L3 中三螺旋结构已经消失;粘均相对分子质量的测定结果,发现纯化后的香菇多糖粘均相对分子质量明显降低,并且随着洗脱浓度的增大,相对分子质量越来越小。
供试样品的生物活性测定结果显示:尽管各多糖组分与阳性对照VC 相比,其抗氧化活性都较低,但是由于多糖是一种大分子化合物,在相同浓度下低于VC 属于正常情况,因此这4 个多糖组分均具有一定的抗氧化活性,但其中L0 表现出更好的抗氧化活性,说明可能是其中蛋白质或者其他的活性物质与多糖的共同作用,使其具有更好的抗氧化能力,抗氧化活性和结构之间的联系还需要进一步的研究。 香菇多糖组分对金黄色葡萄球菌的抑菌试验结果表明L0 和L1 对金黄色葡萄球菌具有明显的抑制作用,而L2 和L3 对金黄色葡萄球菌均无抑制作用,可能是因为L0 和L1 中含有更多的活性成分β-葡聚糖,同时三螺旋结构的存在也可能增加其对金黄色葡萄球菌的抑制作用。
致谢:感谢湖北裕国菇业股份有限公司提供支持。

