反式肉桂醛对副溶血性弧菌的抑制作用
郭 都,张文婷,郝旭昇,尹术华,郭 晓,郑杨洋,于海波,石 超
(西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100)
副溶血性弧菌(Vibrio parahemolyticus)是一种无芽孢、无荚膜、有鞭毛、能运动的短杆或弧杆状的革兰氏阴性细菌,属于弧菌科弧菌属[1]。 副溶血性弧菌是一种嗜盐菌,可在含盐量为0.5%~8%的环境中正常生长[2],广泛分布于近岸海水、海底沉积物和海产品中[3],其在海产品中的检出率夏季(7~9 月份)可高达50%以上[4],其中虾类、鱼类和贝类受副溶血性弧菌污染尤其严重[5]。
近年来,随着经济的发展和人民生活水平的不断提高,海鲜食品逐渐进入内陆,产销量逐年增加,由副溶血性弧菌引起的食物中毒事件也呈逐年上升趋势[6]。 副溶血性弧菌引起的食源性疾病一般为急发病,潜伏期2~24 h。 人体感染副溶血性弧菌后,轻者会出现以恶心、呕吐或腹痛为主要症状的急性肠胃炎[7],重者可能会脱水、休克、昏迷甚至死亡[8]。据统计,在东南亚国家,约50%的肠胃炎是由副溶血性弧菌引起的;在美国、欧洲地区,副溶血性弧菌也是危害公众健康的主要致病菌之一,其感染发生率逐年增加[9];在中国,由副溶血性弧菌引起的食物中毒事件在数量上已超过沙门氏菌中毒案例(2012年报道),副溶血性弧菌已成为首要的食源性致病菌[10]。由此可见,副溶血性弧菌引起的食物污染在世界范围内严重危害着公众的健康安全。
为降低海产品中副溶血性弧菌的污染风险,目前应用的控制措施主要包括辐照保鲜、 气调保鲜、化学防腐剂保鲜以及生物保鲜等技术[11-13]。 辐照保鲜和气调保鲜虽然能够很大程度地保留食品的营养和香味,但其缺点在于对技术及工厂方面安全防护措施的要求高,实际应用成本也较高[14-15];化学防腐剂虽然有良好的抑菌效果,但易使菌体产生耐受性,而且有可能改变食品的自然风味和质构,往往具有潜在毒性,不被消费者接受[16]。 因此寻求安全、有效的控制海产品中副溶血性弧菌的方法具有重要意义。 近年来,植物源活性物质因具有天然、安全和营养等优点而受到广泛关注[17],越来越多的研究者将目光投向天然植物源活性物质抑制食源性致病菌[14,18]。
肉桂醛是肉桂精油的主要活性成分,主要存在于肉桂树皮,它在自然界中的天然存在形式为反式肉桂醛(C9H8O,trans-cinnamaldehyde,TC)[19]。 反式肉桂醛已被美国食品药品监督管理局 (Food and Drug Administration,FDA) 列为公认安全的食品成分(Generally Recognized as Safe,GRAS)。 反式肉桂醛作为一种食品添加剂,已被应用于多种食品中,如口香糖、冰淇淋、糖果和饮料等,它还可以与山毛榉坚果壳粉混合成商品化的肉桂粉,用于面包、蛋糕及其他烘焙产品[20]。 据报道,反式肉桂醛具有抗癌、抗炎和治疗糖尿病等多种生理功能[21],并且其已被证实对多种致病菌如金黄色葡萄球菌、肠出血性大肠杆菌O157:H7 和沙门氏菌具有良好的抑制作用[22-24],但目前反式肉桂醛对海产品中副溶血性弧菌的抑制作用及抑菌机理却尚未研究。
因此,作者以副溶血性弧菌为检测对象,首先通过测定反式肉桂醛对副溶血性弧菌的最小抑菌浓度,评价其抑菌效果;其次通过测定反式肉桂醛对副溶血性弧菌生长曲线、生长动力学参数、细胞膜完整性和细胞形态的影响,探究其抑菌机理;最后通过构建副溶血性弧菌污染的鲜虾模型,评价反式肉桂醛对鲜虾中副溶血性弧菌的控制作用,旨在为反式肉桂醛作为一种植物源抑菌剂用于控制海产品中副溶血性弧菌的污染提供理论依据。
1 材料与方法
1.1 菌种、培养基、试剂与鲜虾
副溶血性弧菌(Vibrio parahemolyticus)标准菌株ATCC 17802、ATCC 33847:购于美国模式培养物集存库(American type culture collection,ATCC);副溶血性弧菌分离菌株 241、245、247、249:由香港理工大学食物安全及科技研究中心分离自鲜虾。
NaCl 胰蛋白胨大豆琼脂培养基:胰蛋白胨15 g、植物蛋白胨 5 g、氯化钠 30 g、琼脂 15 g,加蒸馏水定容至1 L,加热煮沸至完全溶解后,121 ℃高压灭菌15 min 备用;3 g/dL NaCl 胰酪胨大豆肉汤培养基(3 g/dL NaCl Tryptone Soya Broth,3 g/dL NaCl TSB):胰蛋白胨17 g、植物蛋白胨3 g、氯化钠30 g、磷酸氢二钾2.5 g、葡萄糖2.5 g,加蒸馏水定容至1 L,加热煮沸至完全溶解后,121 ℃高压灭菌15 min备用。
反式肉桂 醛 (trans-cinnamaldehyde,HPLC ≥99%):购于美国 Sigma 试剂公司;LIVE/DEAD®BacLightTM细菌活性检测试剂盒:购于赛默飞世尔科技公司;二甲基亚砜(DMSO,HPLC≥99.5%):购于天津市科密欧化学试剂有限公司;试验所用其他试剂:均为国产分析纯。
鲜虾:购于陕西省咸阳市杨凌示范区盛世阳光超市,鲜活低温条件运回实验室,平均体长(7.0±0.5)cm,平均体重(4.44±0.25) g。
1.2 仪器与设备
微生物全自动生长曲线分析仪:芬兰Bioscreen公司产品;低温冷冻离心机5804R:德国Eppendorf公司产品;多功能微孔板检测仪Microplate Readers Spectra Max M 2:美国Molecular Devices 公司产品;激光共聚焦显微镜Nikon A1:日本Nikon 公司产品;场发射扫描电镜S-4800:日本Hitachi 公司产品。
1.3 方法
1.3.1 菌株活化与菌悬液制备 将-80 ℃保存的副溶血性弧菌菌株(ATCC 17802、ATCC 33847、分离菌 241、245、247、249) 划线于 3 g/dL NaCl TSA 培养基,经37 ℃恒温培养12 h 后,分别挑取单菌落接种于3 g/dL NaCl TSB 肉汤,置于 37 ℃恒温摇床(120 r/min)培养 12 h。 随后,将菌悬液离心(4 ℃ 8 000 g,离心10 min),使用无菌磷酸盐缓冲溶液(Phosphate Buffer Solution,PBS,pH 7.2)清洗菌体两次,离心参数设置同前。 随后使用PBS 溶液调整菌悬液600 nm处吸光度值(OD600nm)为0.5(菌悬液浓度约108CFU/mL)备用。
1.3.2 反式肉桂醛对副溶血型弧菌最小抑菌浓度的测定 试验参照 Yousef 等(2013)[25]的方法,略有修改。 在 24 孔板的第一个孔中加入 1 mL、45~55 ℃经高温高压灭菌的3 g/dL NaCl TSA 培养基,将反式肉桂醛加入至第一个孔,充分吹打混匀,使其质量浓度为 200 μg/mL。 随后使用 3 g/dL NaCl 的 TSA 在24 孔板中逐步稀释,使反式肉桂醛终质量浓度分别为 140、100、70、50、35 和 25 μg/mL (每孔终体积为0.5 mL,DMSO 质量分数为0.5%)。 以不添加反式肉桂醛的3 g/dL NaCl TSA 培养基 (含质量分数0.5%DMSO)为阴性对照组,以添加卡那霉素(0.1 mg/mL)的3 g/dL NaCl TSA 培养基为阳性对照组。待琼脂冷却凝固后,分别取1.3.1 中制备的菌悬液2 μL 接种至24 孔板各孔中央,将样品置于37 ℃培养箱,24 h后观察。试验将经过24 h 培养后肉眼观察无明显菌落生长的最低反式肉桂醛质量浓度作为最小抑菌浓度(Minimum Inhibitory Concentration,MIC)。
1.3.3 反式肉桂醛对副溶血型弧菌生长曲线的影响 试验选取副溶血型弧菌ATCC 17802 进行后续研究。 参照 Silvaangulo 等(2014)[26]的方法,将 1.3.1中制备的副溶血性弧菌ATCC 17802 菌悬液离心 (4 ℃8 000 g,离心 10 min),使用无菌 3 g/dL NaCl TSB肉汤将菌体清洗两次。 随后使用3 g/dL NaCl TSB调整菌液OD600nm=0.5,并使用3 g/dL NaCl TSB 肉汤将菌液稀释100 倍(约106CFU/mL)。在蜂窝板每孔中加入 125 μL 菌悬液。 随后,向蜂窝板每孔加入125 μL 使用3 g/dL NaCl TSB 肉汤溶解的反式肉桂醛溶液,使反式肉桂醛终质量浓度分别为MIC、1/2MIC、1/4MIC、1/8MIC、1/16MIC、1/32MIC。 试验设置不含反式肉桂醛的菌悬液(含0.5% DMSO)作为对照组,同时设置3 g/dL NaCl TSB 肉汤 (含0.5%DMSO)作为背景空白对照组,每组设置6 个平行。将样品置于Bioscreen 全自动生长曲线分析仪,于37 ℃下每隔1 小时测定24 h 内各孔吸光度值,绘制生长曲线。
选取修正Gompertz 模型拟合菌株生长状况,并表征其生长参数。 修正Gompertz 模型的表达式为:
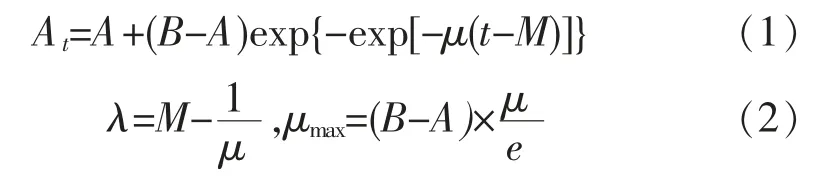
其中,At表示在 t 时的菌液浓度;t 表示培养时间(h);A 表示初始菌液浓度;B 表示最大的菌液浓度;μ 为指数期的相对生长速率;λ 为迟滞期 (h);M 为菌株达到指数期所用的时间(h);μmax为最大生长速率。 采用SPSS 20.0 软件中的非线性回归方法拟合A、B、μ、λ、M 和 μmax参数值。
1.3.4 反式肉桂醛对副溶血型弧菌细胞膜完整性影响的测定 反式肉桂醛对副溶血型弧菌细胞膜完整性影响的测定参照Alakomi 等(2005)[27]所采用的LIVE/DEAD®细菌活性检测试剂盒方法。试剂盒中含有SYTO 9 和碘化丙啶 (PI) 两种核酸染料,SYTO 9 是小分子染料,能够进入细胞膜完整或细胞膜损伤菌并与其DNA 或RNA 结合从而发出绿色荧光[28]。PI 是大分子染料,它只能够进入细胞膜损伤的细胞中并与其核酸结合从而使菌体染色为红色并覆盖SYTO 9 的绿色荧光[29],因此红色荧光强度比例代表细胞膜损伤菌所占比例。试验使用0.85 g/dL NaCl 将1.3.1 中离心收集的菌体洗涤2 次,随后加入2 mL 0.85 g/dL NaCl 使菌体重悬浮。 为获得细胞膜完整菌和细胞膜损伤菌,分别取1 mL 上述重悬菌液于 20 mL 0.85 g/dL NaCl 溶液(活菌组)和 20 mL 体积分数70%异丙醇溶液(死菌组)中,于25 ℃培养箱培养1 h(每15 分钟摇匀一次)。随后使用0.85 g/dL NaCl 溶液洗涤菌体并重新悬浮,调整菌悬液OD600nm=0.5(两组误差不超过0.01)。 将死菌组细胞与活菌组细胞混合,使死细胞比例分别为0%、10%、50%、90%和100%作为标曲组。
在活菌组菌悬液中添加反式肉桂醛,使其终质量浓度分别为 0、MIC 和 2MIC。 将样品在 37 ℃培养30 min 后离心(4 ℃、11 000 g,离心 1 min),随后使用0.85 g/dL NaCl 溶液重悬浮菌体。各取样品组、标曲组100 μL 加入到黑色96 孔酶标板中,每组 3 个平行。 将红色荧光染料 PI (2×)、 绿色荧光染料SYTO 9(2×)和无菌水以体积比 3∶3∶1 000 混合,在黑色96 孔酶标板各孔中加入100 μL 混合染料,充分吹打混匀。 将96 孔酶标板置于25 ℃培养箱避光孵育15 min,随后使用多功能微孔板检测仪检测各孔荧光强度值。 SYTO 9 染料的激发波长/发射波长为485/542,PI 染料的激发波长/发射波长为485/610。通过测定红色荧光强度,构建细胞膜不完整细菌与其对应的红色荧光强度的线性关系作为标准曲线。最后测定样品组红色荧光强度,根据标准曲线计算各组细胞膜不完整细菌百分比。
1.3.5 反式肉桂醛对副溶血型弧菌细胞膜完整性影响的观察 参照 Gu 等(2012)[30]的方法,将 1.3.4中不同浓度反式肉桂醛(0、MIC 和2MIC)与活菌组菌悬液作用 30 min 后的菌体离心 (4 ℃、10 000 g,离心2 min),随后使用0.85 g/dL NaCl 溶液将菌体重悬浮。 将红色荧光染料PI(2×)与绿色荧光染料SYTO 9(2×)等体积混合,在上述菌悬液中分别加入3 μL 混合染料并轻柔混匀,避光孵育15 min。随后,将样品滴加于载玻片,盖上盖玻片,使用激光共聚焦扫描显微镜观察菌体荧光染色情况。
1.3.6 反式肉桂醛对副溶血型弧菌细胞形态的影响 为测定反式肉桂醛对副溶血型弧菌细胞形态的影响,按照1.3.1 中的方法制备菌悬液。 将添加不同质量浓度反式肉桂醛(0、MIC 和2MIC)的菌悬液置于37 ℃培养箱培养,分别在2 h 和4 h 取出,使用 PBS 溶液洗涤菌体两次。 参照 Lv 等(2011)[31]的方法,将上述洗涤后的菌体经体积分数2.5%戊二醛溶液4 ℃固定过夜后,使用PBS 溶液和无菌水依次漂洗,在质量分数1%锇酸溶液中固定5 h(4 ℃)后,分别使用体积分数30%、50%、70%、80%和90%乙醇脱水10min,最后使用100%乙醇脱水。 将样品滴加至专用玻片后干燥,将玻片有序贴附于载物台抽真空干燥后喷金,使用场发射扫描电镜观察细胞形态。
1.3.7 反式肉桂醛对鲜虾中副溶血型弧菌的抑制作用 使用PBS 溶液将1.3.1 中制备的副溶血型弧菌ATCC 17802、 分离菌241 和分离菌245 菌悬液分别稀释至约106CFU/mL,随后将3 种菌悬液等体积混合备用。 参照孙亚军等(2014)[32]的方法处理鲜虾。 在无菌条件下,将鲜虾在无菌水中清洗1 次,随后在质量分数0.2% NaClO 消毒液中浸泡5 min,将鲜虾在无菌水中再清洗2 次以除去残留的NaClO。将反式肉桂醛添加至3 种菌悬液的混合菌液,使反式肉桂醛终浓度质量分数为 0%、0.1%、0.2%和0.4%,同时将鲜虾样品放入其中均匀混合。 随后将鲜虾取出置于无菌培养皿沥干3 min 后,转移至4 °C冰箱。分别在 0、1、2、4、6、8 h 取出鲜虾样品,置于含有30 mL PBS 溶液的离心管中涡旋,使鲜虾上的菌体充分脱落。 吸取涡旋后的上清液,使用PBS 不稀释或进行10 倍稀释后涂布于3 g/dL NaCl TSA 培养基。 37 ℃恒温培养24 h 后,记录细菌总数,每组设置3 个平行。
1.4 数据处理
数据以平均值±标准差表示,使用SPSS 软件(version 20.0,Inc.,Chicago,IL) 对数据进行统计分析,显著性检验采用单因子方差分析,P<0.05 为差异显著(*),P<0.01 为差异极显著(**)。
2 结果与分析
2.1 反式肉桂醛对副溶血性弧菌的最小抑菌浓度
反式肉桂醛对副溶血性弧菌的MIC 测定结果见表1。结果表明:反式肉桂醛对副溶血性弧菌标准菌株 ATCC 17802 和 ATCC 33847 的 MIC 分别为50 μg/mL 和 70 μg/mL。 可见,反式肉桂醛对ATCC 17802 的抑制效果强于ATCC 33847。反式肉桂醛对分离自鲜虾的副溶血性弧菌菌株241、245、247 和249 的 MIC 一致,均为 70 μg/mL。 部分学者也探究了其他植物源活性物质对副溶血性弧菌的抑制作用:Direkbusarakom 等(1998)[33]研究发现番石榴与苦瓜素对副溶血性弧菌的MIC 分别为0.625 mg/mL和1.250 mg/mL;Packiavathy 等(2013)[34]测定了姜黄素对副溶血性弧菌ATCC 17802 的MIC 为0.15 mg/mL;贺怡琼等(2016)[35]的研究表明,酸浆根茎叶提取物对副溶血性弧菌的MIC 为50 mg/mL。 通过比较已研究的植物源活性物质对副溶血性弧菌的最小抑菌浓度,可以得出,反式肉桂醛对副溶血性弧菌具有良好的抑制作用。

表1 反式肉桂醛对副溶血性弧菌的最小抑菌浓度Table 1 Minimum inhibitory concentrations of transcinnamaldehyde against different strains of Vibrio parahaemolyticus
2.2 反式肉桂醛对副溶血性弧菌ATCC 17802 生长曲线的影响
反式肉桂醛对副溶血性弧菌ATCC 17802 生长曲线的影响见图1。由图1 可知,未经反式肉桂醛处理的副溶血性弧菌 (对照组)5 h 后生长趋于稳定,开始进入稳定期。 当反式肉桂醛质量浓度为MIC时,副溶血性弧菌的生长完全受到了抑制。 质量浓度为1/2MIC 的反式肉桂醛虽没有完全抑制副溶血性弧菌的生长,但与对照组相比,副溶血性弧菌生长延滞期增长,培养约7 h 后才开始进入指数期。1/8MIC、1/16MIC 和1/32MIC 反式肉桂醛组副溶血性弧菌的生长曲线与对照组相比无明显差异。
本研究结果表明:经琼脂稀释法测定得到的最小抑菌质量浓度的反式肉桂醛(50 μg/mL),在肉汤中也能够抑制副溶血性弧菌ATCC 17802 的生长。生长曲线试验反映了微生物生长各个阶段的菌体数量,本研究使用液体稀释法通过测定菌悬液光密度值(OD600nm)间接反映菌体数量,也有研究采用平板计数法测定细菌在不同时间的菌落数绘制生长曲线,如 Hermans 等(2011)[36]采用平板计数法发现反式肉桂醛对空肠弯曲菌具有呈现浓度依赖性的抑制效果。 两种方法均能反应微生物的生长规律,但与本试验采用的比浊法相比,平板计数法虽能直接反映细菌数量,但实验误差较大且费时不方便。

图1 不同反式肉桂醛浓度作用下副溶血性弧菌ATCC 17802 在含3 g/dL NaCl TSB 肉汤中的生长曲线Fig. 1 Growth curves for Vibrio parahaemolyticus ATCC 17802 in 3 g/dL NaCl TSB with various concentrations of trans-cinnamaldehyde
试验通过拟合Gompertz 模型表征不同质量浓度反式肉桂醛作用后的副溶血性弧菌生长动力学参数,各拟合方程的 R2均大于 0.98,表明修正Gompertz 模型能够较好地拟合菌株的生长状况。 如表2 所示,与对照组相比,经各质量浓度反式肉桂醛处理后,副溶血性弧菌的生长延滞期(λ)均增加,质量浓度为1/2MIC 的反式肉桂醛使λ 由对照组的1.756 h 增加至7.420 h。 此外,不同质量浓度的反式肉桂醛使副溶血性弧菌最大生长速率(μmax)显著减小,最大光密度值(ODmax)显著降低,并呈现质量浓度依赖性。
2.3 反式肉桂醛对副溶血性弧菌ATCC 17802 细胞膜完整性的影响
首先构建了不同比例的副溶血性弧菌细胞膜损伤菌与其对应的红色荧光强度值之间的线性关系作为标准曲线(y=143.88x+298.03),结果显示线性良好(R2=0.99)。在此基础上研究了反式肉桂醛对副溶血性弧菌细胞膜完整性的影响,结果见图2。未经反式肉桂醛处理的(对照组)副溶血性弧菌红色荧光强度值为300.05±1.05,细胞膜不完整细菌比例为1.4%。 与对照组相比,当反式肉桂醛质量浓度为MIC 时,副溶血性弧菌红色荧光强度值显著增加,细胞膜损伤菌比例增加至8.3%(P<0.05)。质量浓度为2MIC 的反式肉桂醛使副溶血性弧菌细胞膜损伤菌比例增加至29.9%(P<0.01)。由此得出,反式肉桂醛对副溶血性弧菌细胞膜完整性有显著性降低作用,且呈现质量浓度依赖性。

表2 不同反式肉桂醛质量浓度作用下副溶血性弧菌ATCC 17802 的生长动力学参数Table 2 Growth kinetic parameters of Vibrio parahemolyticus ATCC 17802 with different concentrations of trans-cinnamaldehyde
细胞膜的完整性是菌体正常生长代谢的重要条件。 细胞膜完整性被破坏后,可能会导致一些重要细胞组分如蛋白质、核酸和糖类物质流出,从而影响菌体的正常生长代谢[37]。 作者通过测定LIVE/DEAD®试剂盒中所含的两种染料 (SYTO 9 和PI)与细胞膜完整及不完整菌体核酸结合后所产生的特异性荧光来分析反式肉桂醛对副溶血型弧菌细胞膜完整性的影响。 还有一些方法也可用于测定细胞膜完整性:Diao 等(2014)[18]通过测定菌悬液 260 nm 处吸光度值 (胞内流出的核酸及蛋白质在260~280 nm 有较大吸收峰)评价不同浓度的茴香精油对志贺氏菌细胞膜完整性的破坏作用,得出质量浓度为2MIC 的茴香精油使志贺氏菌OD260nm值增加了16.64 倍。Zhou 等(2005)[38]测定了含有质量分数0.125%壳寡聚糖的变形链球菌培养上清液中乳酸脱氢酶及γ 谷丙转氨酶的含量,结果菌液上清液中的这两种胞内酶含量显著高于空白对照组(P<0.05),表明壳寡聚糖使细菌明显出现了胞内酶溢出的现象,以此评价壳寡聚糖对变形链球菌细胞膜完整性的破坏作用。Shi 等(2016)[39]也采用 LIVE/DEAD®试剂盒方法测定了柠檬醛对阪崎肠杆菌细胞膜完整性的影响,通过构建细胞膜完整菌比例与其对应的绿色荧光强度之间的线性关系,测定了经柠檬醛处理后的阪崎肠杆菌细胞膜完整菌所占比例。 结果表明,质量浓度为2MIC 的柠檬醛使阪崎肠杆菌细胞膜完整菌的比例显著降低了85%(P<0.05)。

图2 反式肉桂醛对副溶血性弧菌ATCC 17802 细胞膜完整性的影响Fig. 2 Effect of trans-cinnamaldehyde on the membrane integrality of Vibrio parahemolyticus ATCC 17802
2.4 反式肉桂醛对副溶血性弧菌ATCC 17802细胞膜完整性影响的观察
试验利用激光共聚焦成像结合荧光染色技术进行反式肉桂醛对副溶血性弧菌细胞膜完整性影响的观察和分析,结果见图3。
由于PI 只能透过细胞膜损伤菌,所以,当在共聚焦显微镜下观察到细胞呈红色时,则意味着菌体细胞膜的完整性遭到了破坏。 由图3 可知,未经反式肉桂醛处理的(对照组)副溶血性弧菌几乎全部被 SYTO 9 染为绿色(图 3(a)),这说明对照组细菌细胞膜完整。与对照组相比,经质量浓度为MIC 的反式肉桂醛处理后,菌体呈现少量红色荧光(图3(b))。随着反式肉桂醛质量浓度增加至2MIC,约30%~40%的绿色荧光被红色荧光覆盖,呈现橘红色的弧杆状形态(图3(c))。这表明反式肉桂醛能够降低副溶血性弧菌细胞膜完整菌的比例,并呈质量浓度依赖性,这与2.3 的测定结果相吻合。

图3 激光共聚焦显微镜观察未经反式肉桂醛处理(a)、经质量浓度为MIC 反式肉桂醛处理(b)及2MIC 反式肉桂醛处理(c)的副溶血性弧菌ATCC 17802 细胞膜完整性Fig. 3 Confocal laser scanning microscope analysis of Vibrio parahemolyticus ATCC 17802 untreated with trans-cinnamaldehyde,treated with transcinnamaldehyde at MIC and 2MIC
2.5 反式肉桂醛对副溶血性弧菌ATCC 17802 细胞形态的影响
试验利用场发射扫描电镜观察反式肉桂醛对副溶血性弧菌细胞形态的影响,结果见图4。未经反式肉桂醛处理的副溶血性弧菌细胞形态呈现弧形、杆状、外观饱满、表面光滑(图 4(a),图 4(d))。 与对照组相比,质量浓度为MIC 的反式肉桂醛作用2 h后,副溶血型弧菌菌体呈现轻度皱缩且中心凹陷(图 4(b))。 当反式肉桂醛质量浓度增加至 2MIC 且作用于副溶血性弧菌4 h 后,大部分菌体出现干瘪皱缩(图 4(f))。 以上结果表明,反式肉桂醛影响了副溶血型弧菌的细胞形态。

图 4 未经反式肉桂醛作用 2 h(a)、4 h(d),经浓度为 MIC反式肉桂醛作用 2 h(b)、4 h(e),经浓度为 2MIC 反式肉桂醛作用 2 h(c)、4 h(f)后副溶血性弧菌 ATCC 17802 场发射扫描电镜图Fig. 4 Field emission -scanning electron micrographs of Vibrio parahemolyticus ATCC 17802 untreated with trans-cinnamaldehyde for 2 h (a) and 4 h(d),treated with trans-cinnamaldehyde at MIC for 2 h (b) and 4 h (e),treated with transcinnamaldehyde at 2MIC for 2 h(c) and 4 h(f)
类似的,Liu 等 (2016)[40]通过扫描电镜观察发现,1.5MIC(MIC=0.625 mg/mL)和 5MIC 的二氢杨梅素(藤茶中的主要活性物质)使副溶血性弧菌菌体干瘪、表面粗糙,当质量浓度增加为10MIC 时,菌体出现破裂。蓝蔚青等(2014)[41]发现经壳聚糖、茶多酚和溶菌酶复合保鲜剂处理后,金黄色葡萄球菌菌体发生扭曲变形、干瘪破裂的现象。张赟彬等(2015)[42]观察了质量浓度为MIC 的肉桂醛使金黄色葡萄球菌失去了圆滑的球状形态、使大肠杆菌菌体细胞凹陷,胞膜表面褶皱,但未使菌体溶解破裂。
2.6 反式肉桂醛对鲜虾中副溶血性弧菌的抑制作用
为探究反式肉桂醛的实际应用效果,试验构建了副溶血型弧菌污染的鲜虾模型,并结合鲜虾运输、销售及家庭冷藏过程中的常用温度考虑,探究了反式肉桂醛在4 ℃对鲜虾中副溶血型弧菌的抑制效果,结果见图5。 在0 h 时,对照组及各质量浓度反式肉桂醛处理组的鲜虾中副溶血性弧菌细菌总数均为 5.7。 在 1 h 时,0.1 mg/mL 和 0.2 mg/mL 反式肉桂醛使鲜虾中的副溶血性弧菌细菌总数分别下降至4.8 和3.6,而质量浓度为0.4 mg/mL 的反式肉桂醛使细菌总数降低至检出限以下。在8 h 时,副溶血性弧菌细菌总数经0.1 mg/mL 和0.2 mg/mL 反式肉桂醛处理后分别下降了2.2 和3.4。反式肉桂醛对鲜虾中副溶血型弧菌的抑制作用随反式肉桂醛质量浓度的升高而增强。

图5 反式肉桂醛在4 ℃对鲜虾中副溶血型弧菌的抑菌作用Fig. 5 Inhibitory effects of trans -cinnamaldehyde on Vibrio parahaemolyticus in shrimp at 4 ℃
类似的研究表明,反式肉桂醛能够降低多种食品中的食源性致病菌的数量。Amalaradjou 等(2009)[24]证明了0.5 mg/mL 反式肉桂醛在4 ℃对复原婴幼儿牛乳中阪崎克罗诺肠杆菌具有良好的抑制效果,处理10 h 后细菌总数全部降低至检出限以下。 研究表明,当牛肉馅中大肠杆菌O157:H7 初始细菌总数为7.0 lg(CFU/g)时,0.15 mg/mL 反式肉桂醛处理牛肉馅1 d 后使牛肉饼中大肠杆菌O157:H7 细菌总数显著降低了 3.0(P<0.05),且呈现质量浓度依赖性[43]。
虾类产品作为世界范围内主要的海鲜食品,具有较高的商业价值。 但包括鲜虾在内的海产品中的副溶血性弧菌检出率较高,这增大了人体感染的风险,使得海产品零售产业受到了限制。 研究结果表明,反式肉桂醛能够有效抑制鲜虾中的副溶血性弧菌。反式肉桂醛已被美国FDA 认证为公认安全的食品成分,广泛应用于食品领域,它有潜力作为一种天然抑菌剂应用于虾类及其他海产品,其控制海产品中的副溶血性弧菌具有广阔的应用前景,这对提升我国海产品质量安全水平具有较高的实际应用价值。 然而,反式肉桂醛对鲜虾感官品质的影响需要在实际应用前进一步探讨。
3 结 语
探究了反式肉桂醛对副溶血型弧菌的抑制作用机理及其对鲜虾中副溶血性弧菌的控制效果。 结果表明:反式肉桂醛对6 株副溶血性弧菌的最小抑菌质量浓度为50~70 μg/mL,使菌体最大生长速率显著减小,最大光密度值显著降低。 并且,反式肉桂醛使副溶血性弧菌细胞膜完整性显著降低并改变了菌体的形态,使菌体干瘪塌陷。 反式肉桂醛对鲜虾中副溶血性弧菌具有良好的抑菌效果,且抑菌效果随其质量浓度增大而增强,当反式肉桂醛质量浓度为0.4 mg/mL 时在4 ℃作用鲜虾,鲜虾中副溶血性弧菌在1 h 全部降低至检出限以下。综上所述,反式肉桂醛对副溶血型弧菌有着良好的抑菌效果,其是通过使副溶血性弧菌细胞膜完整性降低,使细胞形态干瘪、皱缩发挥抑菌作用的。 结合其对鲜虾中副溶血型弧菌的抑菌效果,我们认为,反式肉桂醛有潜力作为天然抑菌剂应用于鲜虾及其他海产品中控制副溶血型弧菌的感染。

