高效液相微柱色谱在检测体液中二甲双胍的应用
李金祥, 周雨晴, 杨 悦
(辽宁师范大学化学化工学院,辽宁 大连 116029)
引 言
二甲双胍近年作为治疗胰岛素分泌缺陷和胰岛素体内生物作用效率低的2型糖尿病的常用口服药,其作用机理在于能够多方面作用,协同降糖。例如,对于肝脏,二甲双胍能够抑制糖异生;对于肌肉、脂肪组织,改善肌肉糖原合成,降低游离脂肪酸浓度,提升胰岛素活性,提高葡萄糖吸收和利用率;激活腺苷酸活化蛋白激酶活性,提高肌肉、肝脏等的能量代谢;还可以作用于肠道,减少对葡萄糖的吸收,从而共同达到降糖的作用。然而,尽管二甲双胍毒性相对较低,但服用不当药物累积过多仍会引起副作用,如,食欲不振、恶心、呕吐、腹泻等胃肠道反应;乏力、疲倦;乳酸中毒;贫血等。为了防止用药频繁导致体内积累过多二甲双胍而危及健康,确保人体内二甲双胍的血药浓度维持在一定安全范围内,快速检测体液中的二甲双胍浓度对于临床用药治疗以及药物代谢动力学研究具有重要意义。
二甲双胍为白色无特殊味结晶,易溶于水,可溶于甲醇,pKa=12.4,碱性较强,极性大。以往有很多检测片剂、体液体系中二甲双胍含量的方法,如高效液相色谱法、紫外分光光度法、离子色谱-直接电导法、薄层色谱法、离子选择电极法等。目前较为常用的方法是高效液相色谱法。Himal等[1]用C18反相柱对处理后的人体血液中的二甲双胍进行了离子对分离,后用紫外检测器检测。Neda等[2]基于柠檬酸盐封端的金纳米颗粒设计了一种简便的比色和分光光度传感探针,以测定人血清中的二甲双胍含量;Park S等[3]用分光光度法测定服用吉格列汀和二甲双胍缓释固定剂量组合片剂后血液中的二肽基肽酶4的活性,使用串联质谱法测定吉格列汀和二甲双胍的浓度;Florentin等[4]在双相体系中用对硝基苯甲酰氯对二甲双胍进行衍生化反应,浓缩萃取后经等度洗脱,在HPLC-DAD检测人体血浆中二甲双胍的含量;杨欢杰等[5]使用Capcell PAK SCX UG80正相色谱柱对人体血浆和尿液中的二甲双胍含量完成测定;佟若菲等[6]用Lichrospher ODS色谱柱对服用复方二甲双胍格列吡嗪片的健康人群的尿液中二甲双胍含量进行测定。
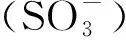
1 材料与方法
1.1 仪器与试剂
仪器与试剂见第32页表1、表2。
1.2 色谱柱的制备
分别将内径为150 μm的石英毛细管和粒径为10 nm~20 nm的硅胶颗粒进行表面双键预活化处理。分别配制A、B、C 3种溶液,其中,A为V(水)∶V(甲醇)∶V(环己醇)=1∶2∶2的三元致孔剂,B为用A配制的SPMA质量分数为12%的单体溶液,C为用A配制含2.5% AIBN的引发剂溶液。A、B、C均用N2除氧,并超声振荡均匀。称取10.00 mg预处理的纳米硅胶颗粒,加入27.5 μL B溶液和7.5 μL A溶液,混合液上层吹N21 min并超声混匀,加入5 μL C溶液,上层吹N21 min并超声混匀,迅速将反应液注入预处理后的毛细管中,两端密封。放入60 ℃水浴中反应6 h,取出后用大于50倍柱体积的甲醇冲洗整体柱,制得有机与无机杂化强阳离子交换整体柱。

表1 实验仪器
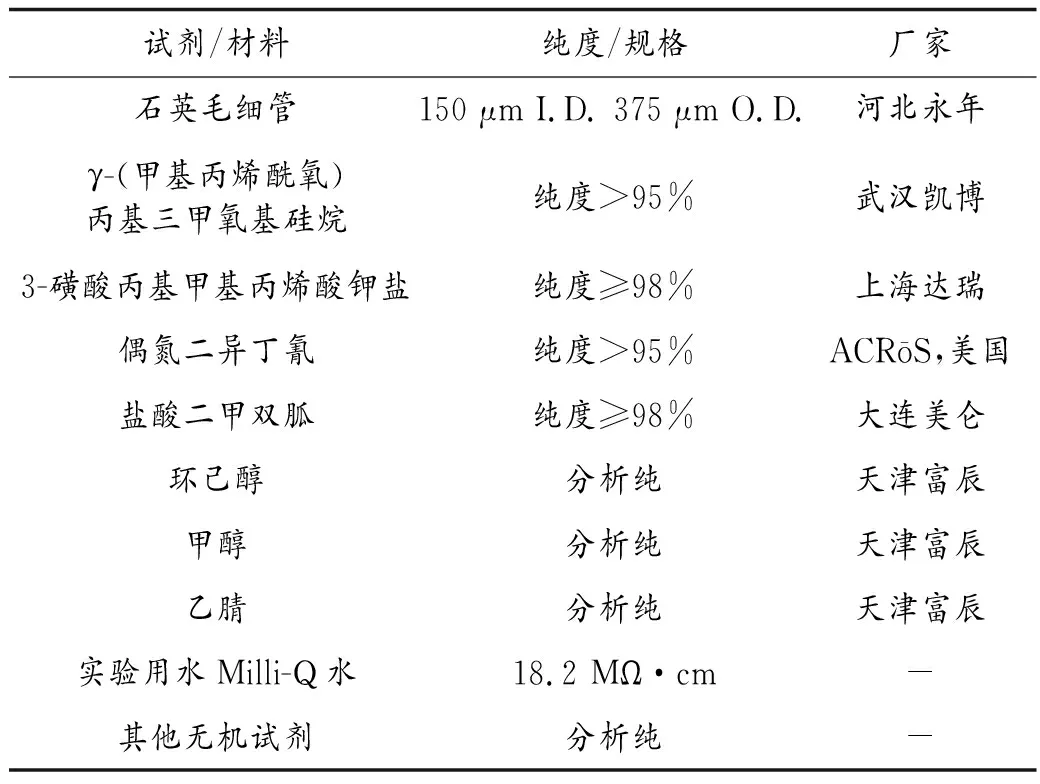
表2 试剂和材料
1.3 样品处理
1.3.1 血液样品处理
准确移取500 μL血浆,精密加入一定量的盐酸二甲双胍标准品至质量浓度为4 μg/L,加入15 μL 30%的高氯酸,超声波振荡2 min,6 000 r/min速度下离心5 min,取上层液,再加入15 μL 30%的高氯酸,超声波振荡2 min,6 000 r/min速度下离心5 min,转移上层清液,加入100 μL二氯甲烷,超声波振荡3 min,6 000 r/min速度下离心5 min。准确吸取上层清液过滤后作为MET血液待测样品备用[7]。
1.3.2 尿液样品处理
向1.5 mL离心管中准确加入尿液100 μL,精密加入一定量盐酸二甲双胍标准品至质量浓度为4 μg/L,加入流动相0.9 mL,振荡1 min混匀,16 000 r/min下离心3 min。用0.45 μm孔径滤膜过滤后为MET尿液待测样品备用[6]。
2 结果与讨论
2.1 二甲双胍血液分离
磺酸跟(SO3-)离子在pH值小于3时都可以维持带有负电荷的状态,所以用离子交换原理分离血浆基体中的盐酸二甲双胍主要考虑盐酸二甲双胍在基体中的电荷状态即可。盐酸二甲双胍pKa=12.4,所以在pH<12.4的时候会质子化带有正电荷,与固定相带有的磺酸跟产生静电作用,从而实现分离。但流动相pH值不同会使盐酸二甲双胍质子化程度不同,所以分别在pH为7.5、6.5、5.0时,考察pH对盐酸二甲双胍在血样基体中的分离的影响。实验条件为:紫外检测波长237 nm;有效柱长2.5 cm;流动相:30 mmol·L-1H3PO4-NaH2PO4缓冲溶液;流速:0.3 μL·min-1。由图1可知,随着流动相pH值的变小,盐酸二甲双胍的保留时间逐渐变大。
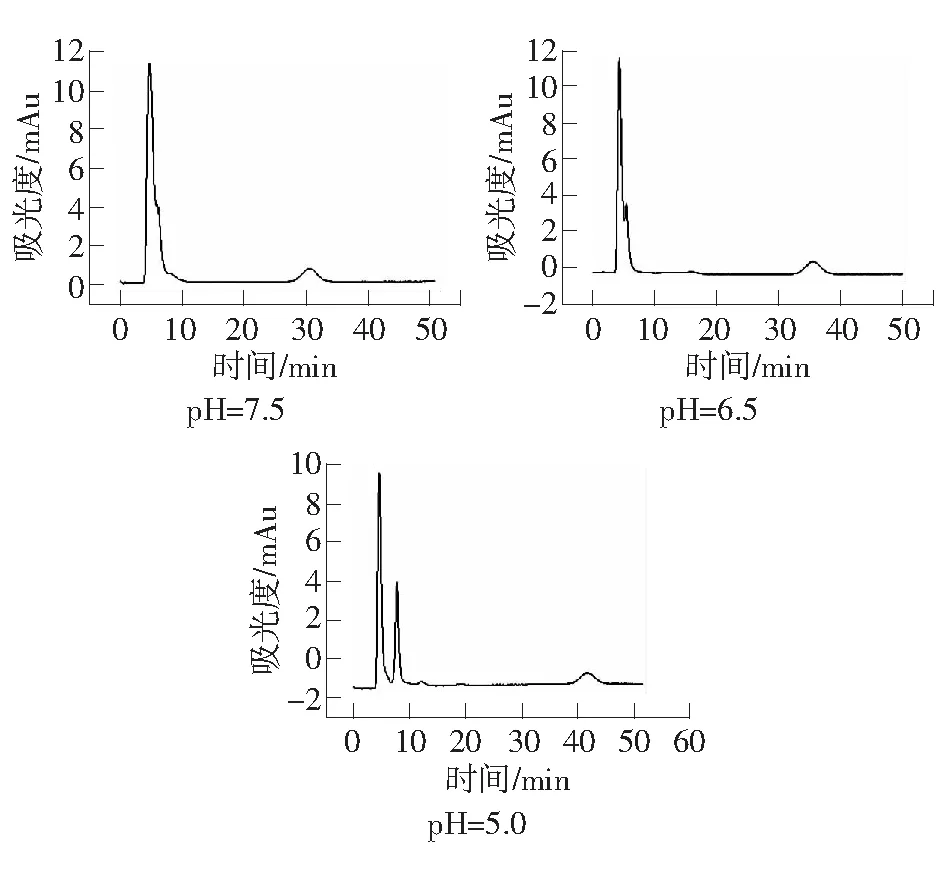
图1 流动相pH值对血液中盐酸二甲双胍保留时间的影响
当样品进入色谱柱后,样品离子便与流动相离子相互竞争固定相表面的电荷位置,并因竞争力的差异使样品组分得到分离。增加流动相的离子浓度,增强了离子的竞争性结合能力从而使得样品的解吸强度增大。以H3PO4-NaH2PO4为缓冲溶液并向其中加入NaCl增大竞争离子Na+的浓度,考察竞争离子浓度对血液中盐酸二甲双胍的分离的影响。实验条件为:紫外检测波长237 nm;有效柱长2.5 cm;流动相:30 mmol·L-1H3PO4-NaH2PO4缓冲溶液,30%ACN,pH=5.0;流速:0.3 μL·min-1。由图2可知,随着溶液中Na+浓度增大,盐酸二甲双胍的保留时间逐渐变小,最后能够在14.675 min时出峰,在较短的时间内完成分离。
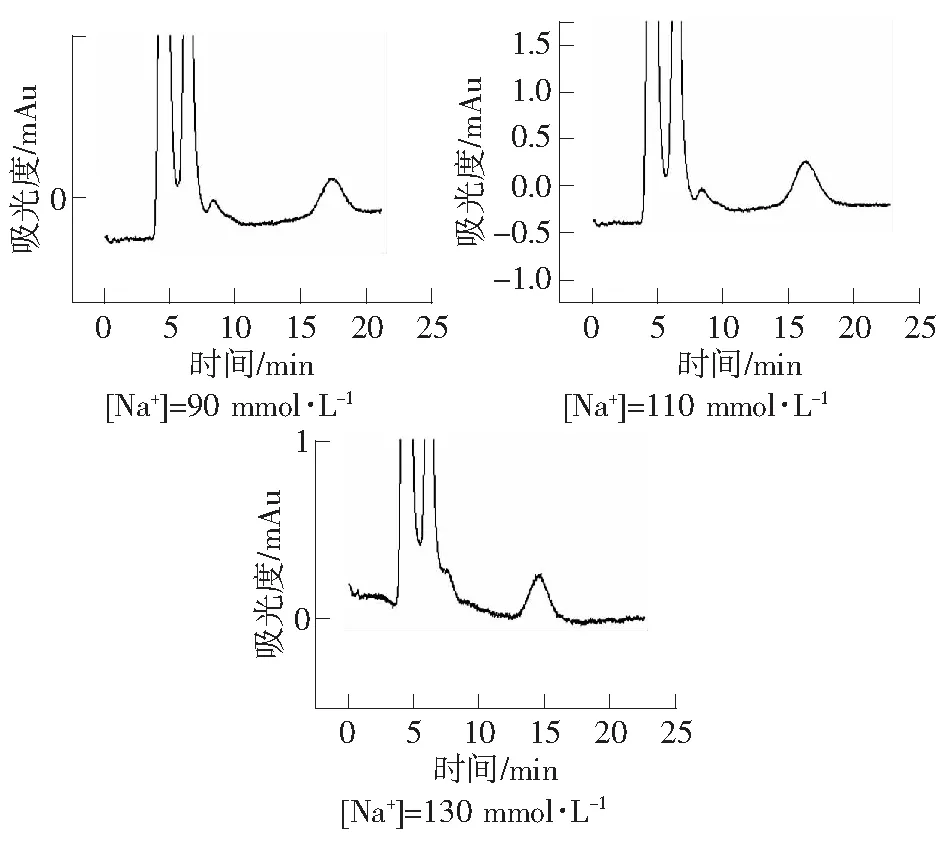
图2 流动相Na+浓度对血液中盐酸二甲双胍保留时间的影响
紫外检测波长237 nm;有效柱长2.5 cm;流动相中加入NaCl使得[Na+]=130 mmol·L-,30%ACN,pH=5.0;流速:0.3 μL·min-1时,空白血浆、盐酸二甲双胍对照品、加入盐酸二甲双胍的空白血浆经强阳离子交换液相微柱的色谱图如图3。盐酸二甲双胍的保留时间为14.675 min,血浆中的内源性物质不干扰盐酸二甲双胍的检测。
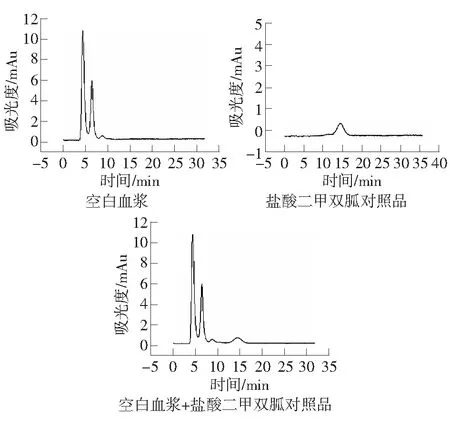
图3 盐酸二甲双胍血浆色谱分析图
2.2 二甲双胍尿液分离
流动相的pH值影响待测物的质子化程度,影响与固定相上带有相反电荷的基团之间静电作用大小,同时也会影响目标物解吸能力,从而影响待测物的分离。所以,改变流动相的pH值,会对盐酸二甲双胍在尿液体系的分离有影响。由图4可知,逐渐减小流动相pH值,尿液基体以及盐酸二甲双胍的保留时间都有所增大。实验条件为:紫外检测波长237 nm;有效柱长2.0 cm;流动相:30 mmol·L-1H3PO4-NaH2PO4缓冲溶液;流速:0.3 μL·min-1。
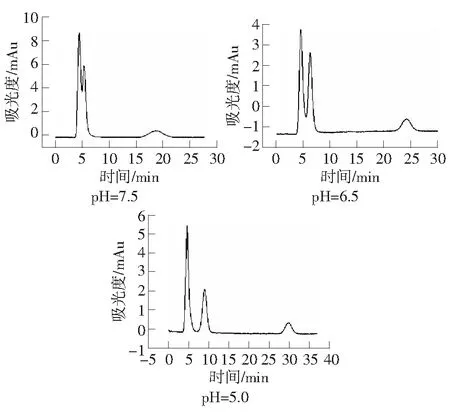
图4 流动相pH值对尿液中盐酸二甲双胍保留时间的影响
流动相中的竞争离子会与待测物离子竞争固定相上的交换位点,竞争离子的浓度,会影响待测物的保留时间。向30 mmol·L-1H3PO4-NaH2PO4缓冲溶液加入NaCl以增大竞争离子Na+的浓度,考察竞争离子浓度对尿液中盐酸二甲双胍的分离的影响。实验条件为:紫外检测波长237 nm;有效柱长2.0 cm;流动相:30 mmol·L-1H3PO4-NaH2PO4缓冲溶液,pH=4.0;流速:0.3 μL·min-1。由图5可知,随着溶液中的Na+浓度增大,盐酸二甲双胍的保留时间逐渐变小,在较短的时间内完成分离。
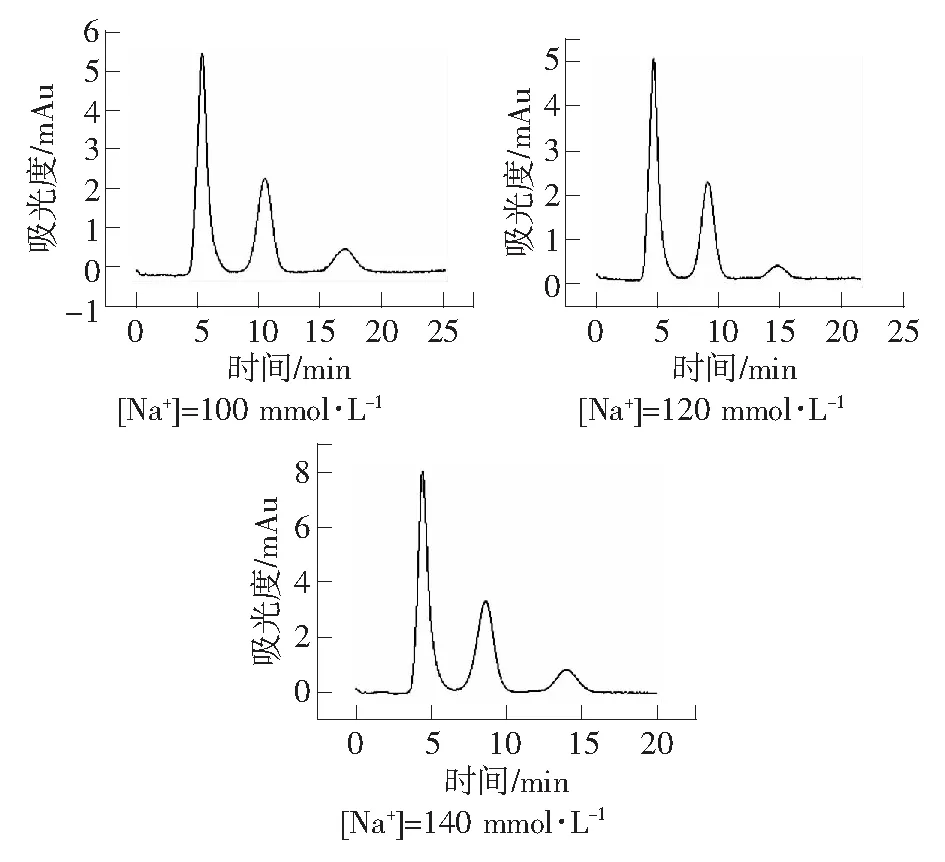
图5 流动相Na+浓度对尿液中盐酸二甲双胍保留时间的影响
紫外检测波长237 nm;有效柱长2.0 cm;30 mmol·L-1H3PO4-NaH2PO4缓冲溶液加入NaCl使得[Na+]=140 mmol·L-1,pH=4.0;流速:0.3 μL·min-1时,空白尿液、盐酸二甲双胍对照品、加入盐酸二甲双胍的空白尿液经强阳离子交换液相微柱的色谱图如图6。盐酸二甲双胍的保留时间为14.663 3 min,尿液中的内源性物质不干扰盐酸二甲双胍的检测。
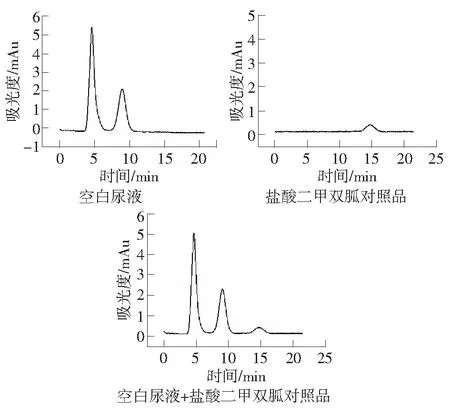
图6 盐酸二甲双胍尿液色谱分析图
3 结论
利用表面预活化的无机纳米硅胶颗粒作为交联剂,带有SO3-基团的3-磺酸丙基甲基丙烯酸钾盐作为有机功能单体,在内径150 μm毛细管里面通过原位聚合反应得到有机无机杂化强阳离子交换整体柱,并用这种整体柱完成了对血浆和尿液两种基体中盐酸二甲双胍的分离。实验证明,分离条件经过优化后,能够在较短时间内从血、尿两种基体中将盐酸二甲双胍完全分离。

