小麦钙调素基因TaCaM1分子特征及转化烟草植株对低磷胁迫的反应
王 卓,史美华,宋文腾,马自飞,路文静,肖 凯
(1.河北农业大学 生命科学学院, 河北 保定071001; 2.河北农业大学 农学院, 河北 保定071001)
植物生长发育过程中,细胞内部钙离子作为第二信使,通过细胞微管骨架调节,参与各种细胞内部和环境信号的传递、整合和倍增传导,启动信号途径中下游基因的转录[1]。研究表明,真核生物种属细胞内部的钙调素(CaM) 家族成员,具有感受生物及非生物逆境信号诱发的钙离子振荡能力[2],广泛参与各种生物和非生物逆境信号的转导过程,在介导植株抵御外界胁迫中发挥重要作用[3-5]。
干旱、盐害及养分缺乏等非生物胁迫诱发植物细胞膜渗透压提高,增高的膜渗透压进一步激活G蛋白和磷脂酶介导的磷酸化反应,参与钙离子通道活化、胞质内钙离子浓度增加和引发振荡钙信号过程[6-7]。研究发现,逆境诱发的钙信号振幅及时空表现特征与植株遭受的逆境及胁迫程度密切相关[8]。CaM作为细胞中重要Ca2+受体,与其他钙离子结合蛋白协同作用,引发特定的钙信号转导通路,参与植株生长发育的调节以及对逆境的响应和抵御过程[9]。近年来研究表明,矿质营养缺乏诱发细胞中Ca2+浓度变化及启动钙信号转导通路,在细胞和分子水平上诱导系列逆境应激反应,与CaM的介导具有紧密联系[10-11]。因此,深入阐明CaM家族成员与作物抵御非生物逆境之间的内在机理,对于作物抗逆遗传改良具有重要指导意义。
尽管迄今有关模式植物CaM家族成员分子特征及耐逆功能已有较多报道[12-14],但有关小麦钙调素介导植株发育和应答非生物逆境的研究仍相对较少。磷素是作物植株必需大量营养元素,提高小麦等重要农作物的磷素吸收和利用能力,对于促进我国的农业可持续发展具有重要实践意义[15]。基于此,本课题组以前期鉴定的1个对低磷逆境产生应答的小麦CaM家族成员TaCaM1为基础,对该基因分子特征、应答低磷逆境表达模式及介导植株抵御低磷胁迫的能力进行了较系统研究,旨在深入揭示钙调素调控小麦抵御养分胁迫分子机制,为今后小麦磷高效遗传改良提供依据。
1 材料与方法
1.1 TaCaM1核苷酸水平系统进化分析
作者前期利用RNA-seq进行小麦(cv.石新828)应答低磷胁迫的转录谱分析中,鉴定了1个对低磷逆境应答、归属于钙调素家族的基因,本文将其命名为TaCaM1(GenBank登录号AK456183)。以该基因cDNA序列为基础在NCBI网站上对其同源基因进行BLAST同源查找,获得与该基因序列同源的不同植物种属家族成员。利用MEGA7软件,构建TaCaM1与其植物种属同源基因的系统进化树,明确TaCaM1的系统进化特征。
1.2 TaCaM1蛋白特征分析
利用 ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)在线工具,获得TaCaM1编码氨基酸序列;利用NCBI蛋白分析工具鉴定TaCaM1蛋白的保守结构域。为明确供试基因编码蛋白的亚细胞定位特征,利用DNA重组技术,构建融合蛋白TaCaM1-GFP(绿色荧光蛋白)表达载体,扩增该基因的正向引物为5′-AAAGTCGACATATGGCGGA CCAGCTCACC-3′,反向引物为 5′-AAAGGTACC CTTGGCCATCATCACCTT-3′。将构建表达载体转化感受态农杆菌EHA105,铺平板后挑取阳性克隆摇菌,LB振荡培养后至OD值0.4,用注射器将菌液注射烟草表皮细胞,培养48 h后撕取转化叶片表皮细胞,置于激光共聚焦显微镜下观察荧光蛋白定位,进而明确供试基因编码蛋白的亚细胞定位特征。
1.3 TaCaM1应答低磷逆境表达特征
在生长室内,参照课题组建立的方法正常水培小麦(cv.石新828)至三叶期(溶液含磷1.2 mmol/L Pi)。然后,将幼苗转移至含磷量降低的低磷(10 μmol/L Pi)溶液内进行低磷处理。在低磷处理后1、3、9和27 h,收获根系样本。此外,为揭示供试基因对复磷响应特征,将部分低磷处理后27 h幼苗再度转移至正常含磷营养液内,复磷后1、3、9和27 h,收获根系样本。以低磷处理前正常幼苗根系(0 h)作对照。采用qRT-PCR鉴定不同供磷处理及测试时间点的TaCaM1转录本数量。扩增供试基因的正向引物为,5′-AGAACACTGTTGTAAGGCTCAAC-3′, 反 向引物为 5′-GAGCTTTACTGCCTCGAACATGG-3′。q-RTPCR具体操作过程参照Guo等[12]的方法进行。采用组成型小麦基因Tatubulin作为供试基因转录本均一化内参,扩增该内参基因正向引物为:5′-AGAACACTGTTGTAAGGCTCAAC-3′,反向引物为:5′-GAGCTTTACTGCCTCGAACATGG-3′。
1.4 不同供磷处理下TaCaM1转化株系植株形态和鲜干重测定
利用基因重组技术,构建融合TaCaM1基因正、反义序列的双元表达载体,采用农杆菌介导法,建立正义和反义表达供试基因的烟草转化株系,具体过程参照Sun等[16]的方法进行。其中,扩增TaCaM1正义序列的正向引物为,5′-AAAC CATGGAGTAGGTAGCTATGCTCC-3′, 反 向 引 物为 5′-AAAGGTTACCTAGCTTAGTATGGC-3′;扩增TaCaM1反义序列的正向引物为,5′-AAACCATGGCAGCTCACTTGGCC-3′,反向引物为 5′-AAAGGTAACCAGCTCACCGACGAC-3′。
以获得的正义株系Sen-1、反义株系Anti-1和未遗传转化的野生型(WT)为材料,采用含有丰磷(1.2 mmol/L Pi)和低磷(10 μmol/L Pi)的 MS 营养液培养供试材料。其中,每3 d更换1次营养液。处理后14 d,对不同磷处理下供试材料照相,记录植株生长情况。同时,选取不同供磷处理下各材料植株,测定根系和叶片鲜重。进一步将样本在烘箱内烘干,获得供试材料干重。
1.5 不同供磷处理下TaCaM1转化株系植株含磷量和磷累积量测定
以上述不同供磷处理后的转化株系(正义系Sen-1和反义系Anti-1)和野生型植株为材料,参照Guo等[12]采用的磷钼黄比色法,测定供试材料根系和叶片的含磷量。通过各供试材料根系和叶片含磷量与对应器官的干重乘积,获得不同供磷处理下的器官磷累积量。
1.6 不同供磷处理下TaCaM1转化株系植株细胞保护酶活性和丙二醛含量测定
同样,以上述不同供磷处理后的转化株系(正义系Sen-1和反义系Anti-1)和野生型植株为材料,参照Huang等[17]的方法,测定供试材料根叶超氧化物歧化酶(SOD)活性、过氧化氢(CAT)活性、过氧化物酶(POD)活性以及细胞膜质过氧化产物丙二醛(MDA)含量。
1.7 数据统计学分析
采用Microsoft Excel 2003和DPS 7.05软件进行数据处理和统计分析。各测定数据均源于3次测试重复结果。
2 结果与分析
2.1 TaCaM1基因分子特征
TaCaM1基因编码149个氨基酸,编码蛋白分子量16 831.67,等电点为4.11。系统进化分析表明,TaCaM1与已报道的小麦(T.aestivum)、水稻(O.sativa)、大豆(G.max)、甘蔗(S.officinarum)等种属的CaM家族基因在核苷酸水平高度同源(图1)。表明TaCaM1可能具有上述同源基因具有相似的进化途径和相近的生物学功能。
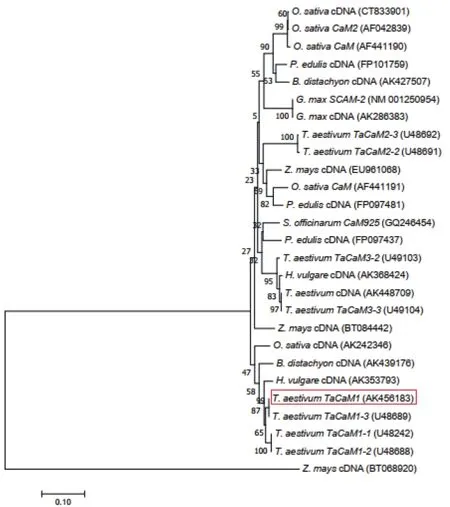
图1 TaCaM1的系统进化特征Fig.1 Phylogenetic characteristic of TaCaM1
蛋白保守域分析表明,TaCaM1基因编码蛋白含有与 EH、EFh superfamily、EF-hind 4 superfamily和EF-hand 7 superfamily家族相似的钙离子结合保守域EF-hand(图2A)。表明TaCaM1具有结合特定信号诱发的钙离子能力。亚细胞定位试验证实,经内质网分选后,TaCaM1编码蛋白定位在细胞质(图2B)。表明TaCaM1主要在细胞质中参与结合钙离子及信号的转导。

图2 TaCaM1的保守结构域及亚细胞定位特征Fig.2 Characterization of the conservative domains and subcellular localization of TaCaM1
2.2 TaCaM1基因应答低磷逆境表达模式
表达分析表明,低磷胁迫下,植株体内的TaCaM1转录本丰度降低,在27 h处理时间表现为随着处理进程,该基因的表达水平不断下降。将低磷处理27 h植株转入丰磷进行复磷处理后,该基因的转录本数量增多,且在27 h复磷处理下表现为随着处理进程表达水平不断增高的特征(图3)。上述结果表明,TaCaM1对低磷逆境呈依赖处理时间的下调表达模式,通过应答低磷逆境,参与介导植株抵御低磷逆境的过程。

图3 TaCaM1应答低磷胁迫的表达模式Fig.3 Expression patterns of TaCaM1 upon low-P stress conditions
2.3 低磷处理下TaCaM1转化株系生长特征
丰磷对照条件下,与野生型(WT)相比,转化株系Sen-1和Anti-1的植株长势、植株鲜重和植株干重没有明显差异(图4A-4C)。

图4 不同磷水平下TaCAM1转化株系表型和鲜干重Fig.4 Phenotypes, fresh weights, and dry weights of the transgenic lines of TaCaM1 under different P level treatments
低磷处理下,与WT相比,Sen-1株系的植株长势减弱,植株鲜干重显著降低;但Anti-1株系的植株长势明显增强,植株鲜干重显著增加(图4A-4C)。上述结果表明,TaCaM1在介导植株抵御低磷胁迫中发挥重要的负调控效应。
2.4 低磷处理下TaCaM1转化株系植株磷素吸收特征
对不同供磷处理下的转化株系研究表明,与WT相比,供试转化株系的根、叶含磷量和磷累积量在丰磷条件下无明显差异(图5)。但在低磷处理下,转化株系Sen-1的根、叶磷累积量较WT显著减少,Anti-1的根、叶磷累积量较WT显著增多(图5)。因此,低磷处理下转化株系中植株磷累积量受到TaCaM1的明显调节,进而改变的植株磷素吸收特性参与转化株系低磷处理下植株长势和干物质生产的调控。
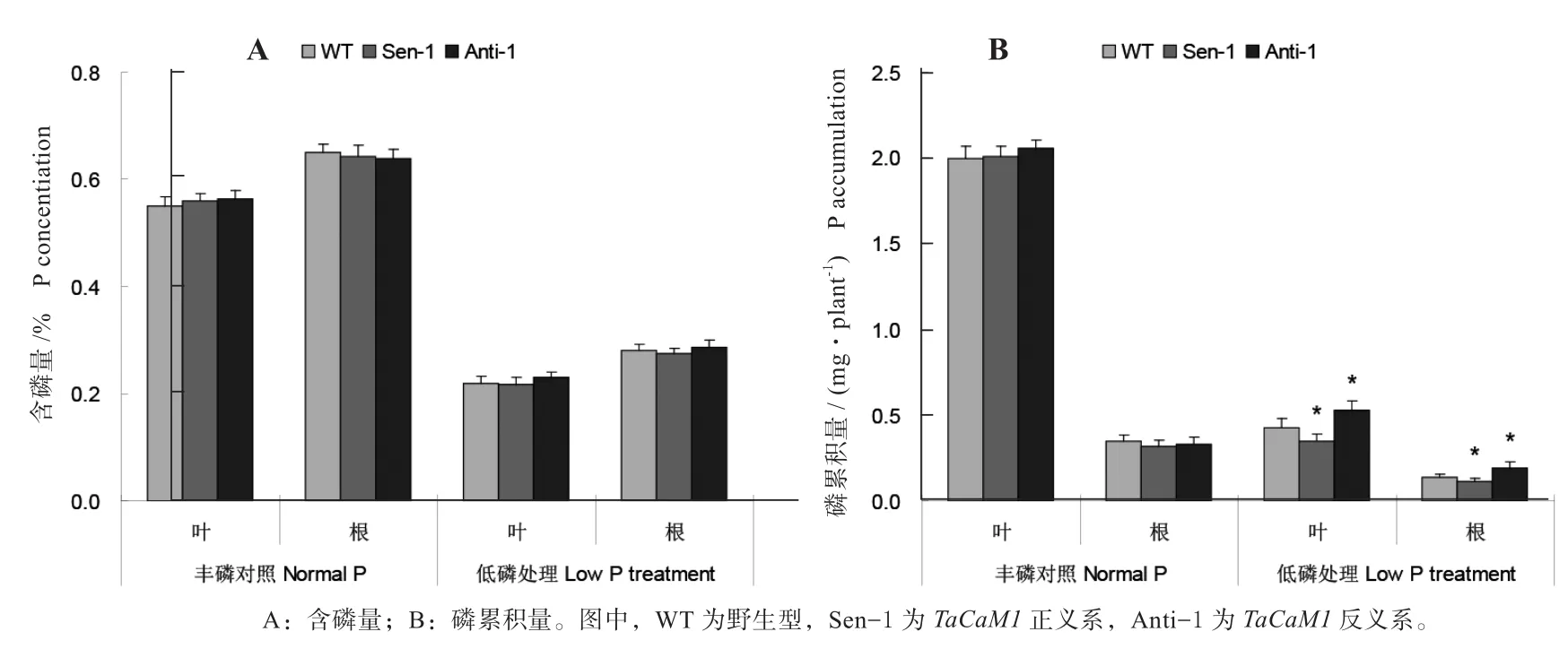
图5 不同磷水平下TaCaM1转化株系的含磷量和磷累积量Fig.5 P concentrations and P accumulative amounts of the transgenic lines of TaCaM1 under different P level treatments
2.5 低磷处理下TaCaM1转化株系植株细胞保护酶活性和丙二醛含量
增强细胞活性氧清除能力在改善植株抵御非生物逆境过程中发挥重要功能。为明确TaCaM1介导植株抵御低磷逆境与细胞活性氧代谢的关系,对不同供磷处理下转化株系的细胞保护酶活性和膜质过氧化产物数量进行了测定。结果表明,丰磷对照条件下,与WT相比,供试转化株系的SOD、CAT和POD活性及MDA含量表现相近(图6)。低磷处理下,转化株系Sen-1的SOD和CAT活性较WT显著降低(图6A-B),MDA含量增多(图6D);Anti-1的SOD和CAT活性则较WT显著增强(图6A-B),MDA含量减少(图6D)。上述结果表明,TaCaM1通过调控低磷逆境下的细胞活性氧清除能力,参与该基因介导的植株低磷胁迫抵御过程。

图6 不同磷水平下TaCaM1转化株系的细胞保护酶活性和丙二醛含量Fig.6 Antioxidant enzyme activities and MDA contents of the transgenic lines of TaCaM1 under different P level treatments
3 讨论与结论
钙调素(CaM)是一类重要钙离子信号感受器,与Ca2+相互作用后,CaM发生构象改变,参与植株体内特定激酶和磷酸酶活性的调节,介导钙信号通路的信号传递[3]。本研究对小麦TaCaM1分子特征研究表明,该基因与植株种属部分CaM家族成员在核苷酸水平上高度同源,且其编码蛋白具有结合钙离子的保守结构域EF-hand。因此,该基因是小麦种属中的CaM家族基因,通过特异结合特定信号启动的震荡钙离子,参与植株生长发育和逆境应答及抵御过程。
通过在转录水平上应答特定逆境,细胞信号转导通路中信号分子编码基因在调控植株对逆境的适应过程中发挥重要生物学功能[18]。本研究表明,TaCaM1呈典型的低磷下调表达模式,在表达上表现为随着低磷处理进程,基因转录本不断减少;将低磷处理后植株转入丰磷进行复磷处理后,该基因的表达水平不断得到恢复。表明TaCaM1通过在转录水平上对低磷逆境应答,参与植株抵御低磷逆境的生物学过程。进一步揭示TaCaM1应答低磷的转录调控机制,将有助于阐明重要信号分子响应低磷胁迫的分子机理。
目前,前人已对拟南芥、水稻、大豆等植物种属中已有部分对CaM家族成员抵御各种非生物逆境功能进行了研究。热激作用下,拟南芥AtCaM3显著增强植株的抗热能力[12];水稻CaM家族基因OsCaM1-1在增强植株抵御渗透胁迫和盐分胁迫中发挥重要功能[13];大豆GmCaM4通过诱导转录,明显改善植株的抗病性和耐盐能力[14]。对CaM家族成员耐逆分子机制研究发现,拟南芥AtCaM介导的植株抗旱能力增强,其与钙离子组建Ca2+/CaM复合体、进而作为三螺旋转录开关启动响应渗透胁迫和气孔关闭相关基因转录、降低水分散失、进而提高植物水分利用效率有关[19]。本研究通过转化株系,对TaCaM1介导植株抵御低磷逆境的功能进行了研究,结果表明,该基因通过调控细胞保护酶活性,影响低磷逆境下的细胞膜质过氧化程度,进而参与植株磷素吸收和干物质生产能力的调控。与野生型对照相比,反义表达TaCaM1的株系低磷逆境下细胞保护酶SOD和CAT活性增强,丙二醛含量降低,磷累积量显著增多,植株干物质生产能力明显改善。因此,TaCaM1作为植株低磷响应负调控因子,在介导植株抵御低磷逆境过程中发挥重要生物学功能。该基因在今后小麦磷效率评价及磷高效遗传改良中具有重要的应用价值。

