TOAST分型联合Lp-PLA2在前循环短暂性脑缺血发作及轻型卒中早期复发缺血性脑血管病中的预测价值
马晨晨,耿子旸,朱士光,李海亮,陈雨洁,王 心,董瑞国
短暂性脑缺血发作(transient ischemic attack,TIA)和轻型卒中是我国最常见的缺血性脑血管病,因二者在临床表现、预后、流行病学特征等方面的相似性而被提出可进行统一诊疗[1]。相比于致残性卒中,TIA和轻型卒中临床症状轻微,但其早期复发缺血性脑血管病的风险显著高于致残性卒中[2,3],因此,对TIA和轻型卒中进行早期卒中风险预测,识别高危患者,采取有效的治疗措施,可减少致残性卒中的发生。目前,病因分型和脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)对TIA和轻型卒中后卒中风险的预测价值受到日益关注[4,5]。本研究通过测定前循环TIA及轻型卒中患者血清中Lp-PLA2的水平,探究TOAST分型(Trial of Org 10172 in Acute Stroke Treatment) 中的大动脉粥样硬化性脑梗死(large-artery atherosclerotic stroke,LAA)和Lp-PLA2对前循环TIA及轻型卒中后早期复发缺血性脑血管病的预测价值。
1 资料和方法
1.1 研究对象 收集2018年8月~2019年7月徐州医科大学附属医院神经内科收治的前循环TIA及轻型卒中患者。纳入标准:(1)临床诊断为TIA或轻型卒中。TIA诊断标准符合2011年短暂性脑缺血发作的中国专家共识更新版的规定[6]。脑梗死的诊断标准符合2014年中国急性缺血性脑卒中诊治指南[7]。轻型卒中的诊断标准是脑梗死患者入院后首次美国国立卫生研究院卒中量表(NIHSS)≤3分。(2)临床表现符合前循环血管受累的缺血症状或弥散加权成像证实梗死位置位于前循环供血区。(3)发病48 h内入院。(4)年龄大于18岁。(5)签署知情同意书。排除标准:(1)头部CT或MRI证实为颅内出血、占位等。(2)后循环TIA及轻型卒中。(3)进行静脉溶栓或血管内治疗。(4)入院前改良Rankin评分(mRS)≥3分。(5)合并感染、恶性肿瘤、严重的心功能不全、肝肾疾病、自身免疫性疾病、昏迷或意识障碍等。(6)资料不全者。本研究通过徐州医科大学伦理委员会批准(批准号:XYFY2019-KL042-01)。
1.2 临床资料采集 收集患者的基本信息(年龄、性别、联系方式)、脑血管病的危险因素(高血压、糖尿病、高脂血症、缺血性心脏病、既往TIA或脑梗死史、吸烟史)。危险因素的定义如下:高血压的诊断标准参照2010年中国高血压防治指南;糖尿病的诊断标准参照2013年中国2型糖尿病防治指南;高脂血症的诊断标准参照2016年中国成人血脂异常防治指南;缺血性心脏病的定义为既往诊断为冠心病、心绞痛、心肌梗死,或冠状动脉支架植入术后、冠状动脉搭桥术后者。吸烟定义为一生连续或累计吸烟6 m及以上者。
1.3 辅助检查 所有患者于入院2 d空腹时抽取肘静脉血,进行血常规、生化、凝血功能、Lp-PLA2等指标检测。Lp-PLA2由我院检验科采用免疫比浊法统一检测。Lp-PLA2<100 ng/ml因低于检测下限而被排除。所有患者入院后3 d内完成心电图、心脏彩超、颈部血管彩色多普勒超声、头颈部CTA、头颅MRI检查。根据头颈部CTA判断颈动脉和前循环颅内大动脉狭窄程度。前循环颅内大动脉包括颈内动脉岩段及以上、大脑前动脉A1段、大脑中动脉M1段、大脑中动脉M2段。狭窄程度的判定采用北美症状性颈动脉内膜切除术试验(NASCET)协作组提出的评估标准:狭窄率(%)=(1-动脉最窄处血流宽度/狭窄病变远端正常动脉内径)×100%;分为轻度狭窄(<50%),中度狭窄(50%~69%),重度狭窄(70%~99%)和完全闭塞。
1.4 病因判断及分组 经典TOAST分型[8]将缺血性卒中分为5个类型,包括大动脉粥样硬化性脑梗死、心源性栓塞、小动脉闭塞性梗死、其他原因所致的脑梗死、不明原因的脑梗死。根据患者临床特点、影像学和实验室检查,将前循环TIA及轻型卒中患者分为LAA组和非LAA组。LAA判断标准:头颈部CTA提示颈动脉或上述前循环颅内大动脉狭窄≥50%且临床表现或DWI责任病灶在同一供血区,同时排除其他病因的可能性。不能纳入LAA组的患者被纳入非LAA组。
1.5 终点事件评估及分组 对前循环TIA及轻型卒中患者进行电话或门诊随访,以患者住院治疗后第30 d为终点事件观察时间点,统计30 d内复发前循环TIA或脑梗死的情况,根据患者的临床转归分为阳性事件组和阴性事件组。轻型卒中早期疾病进展(NHISS评分恶化≥2分)[9]归类为阳性事件组。
2 结 果
2.1 前循环TIA及轻型卒中患者的一般临床资料 2018年8月~2019年7月共纳入的前循环TIA及轻型卒中患者285例,因Lp-PLA2<100 ng/ml、静脉溶栓、血管内治疗、伴有感染或其他严重疾病、资料不全、失访等原因共排除95例患者(33.33%),最终纳入190例前循环TIA及轻型卒中患者,其中男性123例(64.73%),平均年龄(63.17±11.45)岁,LAA组99例(52.10%)(见表1)。

表1 前循环TIA及轻型卒中患者的一般临床资料
注:LAA:大动脉粥样硬化性脑梗死
2.2 阳性事件组和阴性事件组的比较 对纳入的190例前循环TIA及轻型卒中患者随访30 d后,阳性事件组为31例,阴性事件组为159例,阳性率为16.32%。经卡方检验、两独立样本t检验或U检验发现,阳性事件组的年龄、既往TIA或脑梗死史比例、LAA比例、Lp-PLA2水平显著高于阴性事件组,差异具有统计学意义(P<0.05)(见表2)。我们采用ROC曲线确定了Lp-PLA2预测前循环TIA及轻型卒中30 d内复发缺血性脑血管病的最佳截断值为304.50 ng/ml,其敏感性和特异性分别为0.645和0.711。
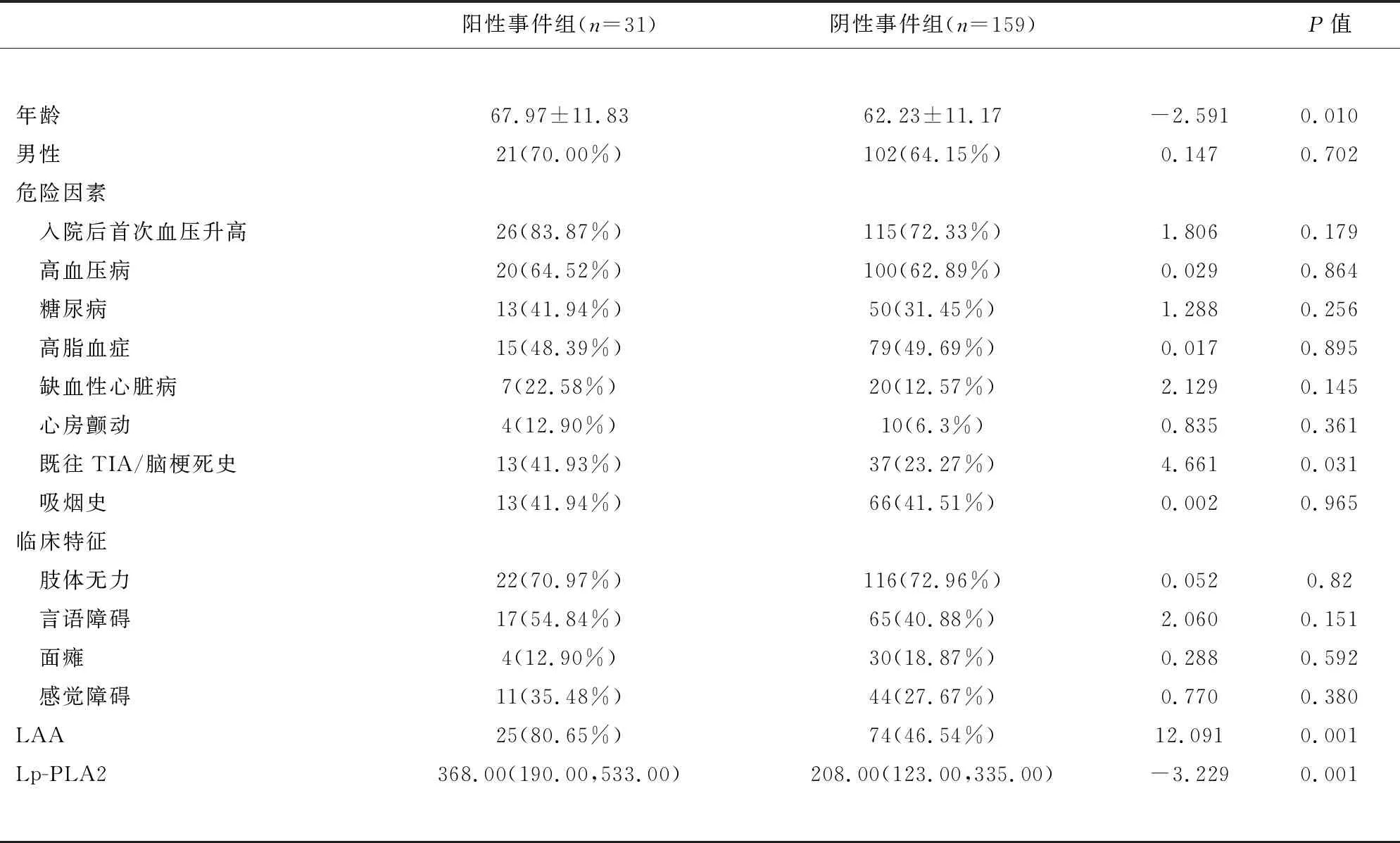
表2 前循环TIA及轻型卒中后30 d复发缺血性脑血管病的单因素分析
注:LAA:大动脉粥样硬化性脑梗死;Lp-PLA2:脂蛋白相关磷脂酶A2
以前循环TIA及轻型卒中后30 d内是否复发缺血性脑血管病为因变量,以单因素分析中P<0.2的变量(包括年龄、入院后首次血压升高、缺血性心脏病、既往TIA/脑梗死病史、言语障碍、LAA)以及Lp-PLA2≥304.50 ng/ml作为自变量,进行多因素Logistic回归分析,结果显示:LAA和Lp-PLA2≥304.50 ng/ml是前循环TIA及轻型卒中后30 d内复发缺血性脑血管病的独立危险因素(见表3)。

表3 前循环TIA及轻型卒中30 d内复发缺血性脑血管病危险因素的多因素Logistic 回归分析
注:LAA:大动脉粥样硬化性脑梗死;Lp-PLA2:脂蛋白相关磷脂酶A2
2.3 LAA和Lp-PLA2≥304.50 ng/ml单独及联合对前循环TIA及轻型卒中30 d内复发缺血性脑血管病的预测价值比较 LAA和Lp-PLA2≥304.50 ng/ml单独及联合预测前循环TIA及轻型卒中30 d内复发缺血性脑血管病的ROC曲线见图1。LAA和Lp-PLA2≥304.50 ng/ml单独及联合预测前循环TIA及轻型卒中30 d内复发缺血性脑血管病AUC分别为0.671(95%CI0.573~0.768,P=0.003)、0.678(95%CI0.572~0.784,P=0.002)、0.729(95%CI0.635~0.824,P<0.001),三种方法AUC与参考线下面积0.5比较均有统计学差异,且LAA联合Lp-PLA2≥304.50 ng/ml的AUC最大。
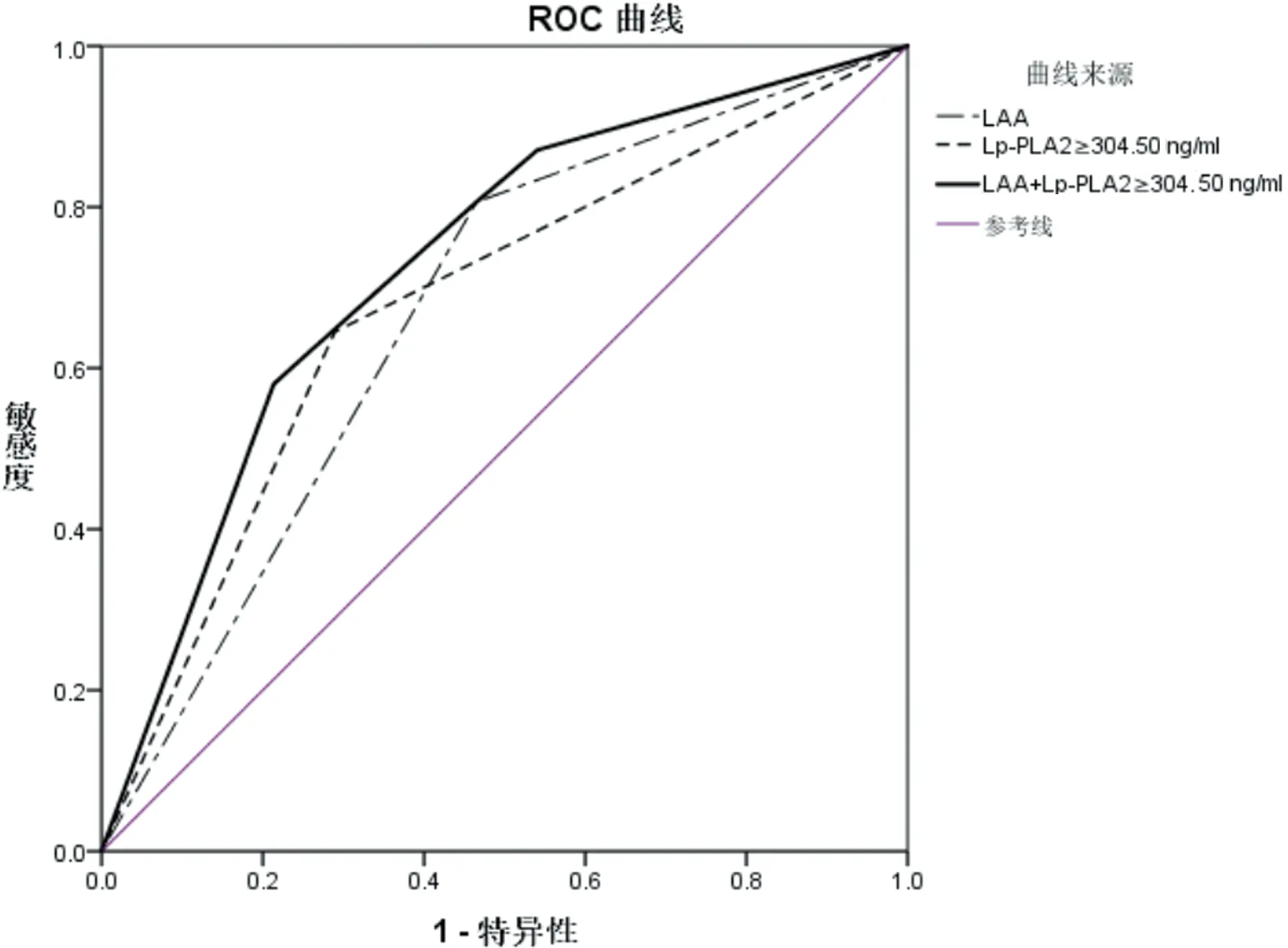
注:LAA:大动脉粥样硬化性脑梗死;Lp-PLA2:脂蛋白相关磷脂酶A2
图1 LAA和Lp-PLA2≥304.50 ng/ml单独及联合预测前循环TIA及轻型卒中30 d内复发缺血性脑血管病的ROC曲线
3 讨 论
TIA和轻型卒中早期复发风险高,既往研究报道,TIA和轻型卒中30 d内脑梗死的发生率为10%~15%[10],且有12%~30%的脑梗死患者在脑梗死前发生过TIA[11]。随着CHANCE等大型临床试验的实施,在对TIA和轻型卒中给予更积极的干预与管理后,其复发风险显著降低[2]。全脑血管可以分为前循环和后循环两个系统,其中,前循环脑梗死的比例和早期复发的风险都高于后循环[12]。本研究中前循环TIA及轻型卒中30 d内复发缺血性脑血管病的风险为16.32%,较相关文献报道偏高,可能与以下两点有关:一是纳入的患者为前循环TIA及轻型卒中,提高了整体的复发风险;二是研究样本量较少可能导致复发风险的偏倚。虽然和大样本、多中心的临床研究存在一定差别,但本研究仍可以提示前循环TIA及轻型卒中早期复发风险较高,临床医师应对前循环TIA及轻型卒中患者进行全面评估,评价相关危险因素,以减少卒中的发生。本次研究中,经单因素和多因素分析后发现,LAA和Lp-PLA2≥304.50 ng/ml是前循环TIA及轻型卒中后30 d内复发缺血性脑血管病的独立危险因素。
在对TIA及脑梗死后复发卒中风险预测的研究中,病因分型因与TIA或脑梗死的发病机制直接相关而受到越来越多的关注。研究表明,将病因学如大动脉粥样硬化、心房颤动纳入TIA后卒中风险预测模型中能显著提高预测准确性[13]。Ay等[14]提出REE-90模型以预测脑梗死后90 d内复发脑梗死的风险,病因分型为该模型的重要指标。REE-90模型提出后,研究者将其用于预测DWI阳性TIA患者早期复发脑梗死风险时发现,相比于ABCD2评分,REE-90预测DWI阳性TIA患者7 d和90 d内脑梗死风险的准确性更高[15,16]。在经典的病因分型TOAST分型中,大动脉粥样硬化性脑梗死(LAA)是缺血性脑卒中的常见类型。据相关文献报道,大动脉粥样硬化是TIA患者早期复发卒中的独立危险因素[5]。本次研究中,我们根据TOAST分型标准将前循环TIA及轻型卒中分成LAA组和非LAA组,发现阳性事件组LAA的比例显著高于阴性事件组,LAA性脑梗死是前循环TIA及轻型卒中30 d内复发缺血性脑血管病的独立危险因素,再一次验证了病因分型对脑梗死复发风险的预测价值。
根据经典TOAST分型的诊断标准,确诊LAA性脑梗死的重点在于确定血管狭窄程度。但是,因为早期影像学的限制往往不能快速判断有无大血管狭窄。血清生物学标志物因其获取方便快速,可弥补影像学的不足,在急诊评估中具有明显优势。Lp-PLA2由粥样斑块内的巨噬细胞和淋巴细胞合成和分泌,参与动脉粥样硬化斑块的形成、发展和破裂[17]。同时,Lp-PLA2具有高度血管特异性[18],参与血管炎症反应和斑块失稳定,被认为是缺血性卒中风险预测和评估的重要标志物[19]。本次研究中,阳性事件组的Lp-PLA2显著高于阴性事件组,我们采用ROC曲线确定Lp-PLA2预测阳性事件的最佳cut-off值为304.50 ng/ml,分析发现,Lp-PLA2≥304.50 ng/ml是前循环TIA及轻型卒中后30 d内复发缺血性脑血管病的独立危险因素。可见,炎症反应和斑块不稳定在前循环TIA及轻型卒中早期复发过程中发挥重要作用。
本研究结果显示,LAA和Lp-PLA2≥304.50 ng/ml预测前循环TIA及轻型卒中30 d内复发缺血性脑血管病AUC分别为0.671和0.678,表明病因分型LAA和血管炎性因子Lp-PLA2对前循环TIA及轻型卒中早期复发缺血性脑血管病均有预测价值,且诊断价值相当。进一步研究结果显示,两者联合诊断的AUC为0.729,优于单独Lp-PLA2及LAA的评估,说明两者联合检测对前循环TIA及轻型卒中早期复发缺血性脑血管病的预测价值更高。
综上所述,前循环TIA及轻型卒中早期复发缺血性脑血管病的风险较高。TOAST分型中的LAA联合Lp-PLA2≥304.50 ng/ml能较好地预测前循环TIA及轻型卒中早期复发缺血性脑血管病的风险,可帮助临床医师判断患者的预后,从而制定更加个体化的二级预防方案。

