microRNA-193b和microRNA-141在脓毒血症休克小鼠基因启动子区的甲基化状态
吴思思, 李 雪, 李如利, 蒋 维,3, 汪香秀, 汪潇潇
(1. 四川大学华西医院 公共实验技术中心, 成都 610041; 2. 四川大学 生物治疗国家重点实验室, 成都 610041; 3. 四川大学华西医院 分子医学研究中心, 成都 610041; 4. 重庆大学附属肿瘤医院 重庆市肿瘤研究所 重庆市肿瘤医院 肿瘤转移与个体化诊治转化研究重庆市重点实验室, 重庆 400030)
脓毒血症(sepsis)是机体在感染或创伤时诱发剧烈的全身性炎症反应(Systemic inflammatory response syndrome, SIRS)[1]。其临床发生率高、可以由任何部位的感染引起、包括肺炎、泌尿系统感染、血流感染、腹膜炎等,常常发生于有严重疾病的患者中,如烧伤、外科手术后和严重创伤等,临床表现通常有发热、心率加快、呼吸急促和炎症指标升高(外周血白细胞、C反应蛋白和降钙素原增加),而出现严重的脓毒血症休克时,患者通常出现急性循环衰竭状态,表现为低血压、尿量减少、高乳酸血症等。脓毒血症的发生机制非常复杂,包括免疫功能紊乱、凝血功能紊乱、肠道菌群移位等,有研究报道认为其发生发展的重要机制之一是与炎症反应调节的动态平衡被破坏相关,感染因素刺激炎症反应细胞释放大量炎症反应介质所致。然而,如何维持感染或创伤时机体炎症因子与抗炎因子的平衡以及其具体的调节机制目前尚不清楚[2]。因此,探索脓毒血症的病理生理过程,找到新的预防、诊断和治疗手段具有重要意义[2]。
微小RNA(miRNA)是一种非编码单链小分子RNA,机体基因约1/3受其调控,通过靶向一个或多个mRNA,抑制mRNA的剪切和翻译,抑制靶蛋白的合成,调节细胞活动,参与机体炎症反应调节、免疫应答等病理生理过程[3]。已有的研究报道证实,microRNA-193b和microRNA-141参与肿瘤、心血管疾病和感染等疾病过程的调控[4-5]。作者在以往的研究中,观察到脓毒血症时microRNA-193b和microRNA-141在受累器官中的表达发生异常变化[13],且相关研究表明,miRNA在疾病过程中的异常表达与基因启动子区碱基的非正常甲基化密切相关[6]。因此本研究在小鼠脓毒血症模型上检测microRNA-193b和microRNA-141的基因启动子区甲基化水平,探讨在脓毒血症休克中microRNA-193b和microRNA-141的甲基化状态及其调节作用,寻找感染性休克的血清标志物,继而为感染性休克疾病的早期预防、诊断和治疗提供新的策略。
1 材料和方法
1.1 材料
1.1.1 主要试剂与仪器
DNA甲基化修饰试剂和DNA聚合酶购自美国ZYMO公司;甲基化与非甲基化特异性PCR引物(M-MSP/ U-MSP)由上海生工贸易有限公司合成;罗氏COBAS INTEGRA 800 全自动生化分析仪;美国iWorx公司多导生理记录仪。
1.1.2 实验动物
雄性C57BL/6小鼠20只,鼠龄为8周,由四川大学实验动物中心提供,饲养于符合标准的洁净的层流动物房内。
1.2方法
1.2.1 小鼠盲肠结扎穿孔(CLP)模型的建立及处理[1,13]
术前小鼠禁食12 h,用戊巴比妥钠(2%)腹腔麻醉小鼠,将腹部正中切开大约2 cm,在盲肠回盲部下方使用4号缝合丝线结扎,随后用无菌针头进行单孔穿刺。完成后将盲肠还纳腹腔,缝合腹壁切口。对照组小鼠跟手术组小鼠一样暴露盲肠,但不进行结扎和穿孔。术后给两组小鼠补液,分别于皮下注射1 mL生理盐水,禁食不禁水。24 h后对小鼠进行颈总动脉插管后连接多导生理记录仪监测小鼠的收缩压、舒张压、平均动脉压、心率,监测完毕后经腹主动脉取血,检测小鼠血糖和血乳酸水平,随后取小鼠心脏、肝脏、肺和小肠组织,用于检测microRNA-193b和microRNA-141 CpG岛甲基化情况。
1.2.2 硫酸氢盐测序(BSP)法检测microRNA-193b和microRNA-141 CpG岛甲基化
按说明书使用试剂盒提取组织样品DNA,超微量核酸测定仪测定DNA浓度,将亚硫酸氢盐处理后的DNA进行扩增,引物见表1。于95 ℃变性30 s,58 ℃退火40 s,72 ℃延伸30 s,共40个循环;72 ℃再修复延伸7 min。产物行琼脂糖电泳,回收扩增产物连接TA克隆载体,连接产物转化,菌液PCR鉴定阳性克隆,进行测序,检测其甲基化状态。
1.2.3 统计
所有数据采用prism5软件进行统计学分析,以均值±标准误表示。P<0.05为有统计学差异。
2 结果与分析
2.1 小鼠的心功能指标和血压
在小鼠盲肠结扎穿孔模型实验中, 24 h后观察小鼠状态为休克晚期表现,可见小鼠活动明显减少、精神萎靡状,血乳酸水平则显著增加393.0%、收缩压(SBP)、舒张压(DBP)、平均动脉压(MABP)、心率(Heart rate)、血糖水平与对照小鼠相比分别下降37.5%(P<0.05)、27.3% (P<0.05)、33.5% (P<0.05) 、20.0% (P<0.05)和62.5%(P<0.01),具体见表2。

表1 microRNA-193b和microRNA-141 基因引物序列

表 2 对照和休克晚期小鼠的收缩压、舒张压、平均动脉压、 心率、血糖、乳酸浓度组)Table 2 Blood pressure, plasma glucose, lactate contents and Heart rate in mice without or with cecal ligation and puncture (CLP)
*:P<0.05;**:P<0.01。 SBP: 收缩压; DBP: 舒张压; MABP: 平均动脉压
2.2 microRNA-193b和microRNA-141 CpG岛甲基化状态
利用生物信息学软件CpG island searcher分析miR-193b-3p启动子区CpG岛,选取miR-193b-3p基因上游4461 bp作为研究对象,发现miR-193b-3p启动子区含有一个长度为1972 bp(1972~3504区域)的CpG岛,提示miR-193b-3p基因很可能受到甲基化的调控。在1972~3504区域进行测序PCR引物设计,发现第6个CG位点有甲基化的出现,microRNA-193b基因克隆测序结果显示,休克晚期小鼠心脏组织的CpG岛的甲基化程度明显升高,甲基化频率为23.9%,高于正常组1.9%(P<0.05),具体见图1和表3。
利用生物信息学软件CpG island searcher分析miR-141-3p启动子区CpG岛,选取miR-141-3p基因上游3743 bp作为研究对象,发现miR-141-3p启动子区含有一个长度为518 bp(77~594区域)的CpG岛,提示miR-141-3p基因很可能受到甲基化的调控。在77~594区域进行测序PCR引物设计,发现第3个CG位点有甲基化的出现,microRNA-141基因BSP扩增片段包括1个CpG岛,microRNA-141基因克隆测序结果显示,休克晚期小鼠肺、小肠组织的CpG岛的甲基化程度明显升高,甲基化频率分别为31.2%和36.9%,高于正常组织3.4%和4.6%(P<0.01),具体见图2和表3。

图1 CpG island searcher软件分析miR-193b-3p启动子区CpG岛Figure 1 CpG islands in miR-193b-3p gene promoter region analyzed by CpG island searcher

图2 CpG island searcher软件分析miR-141-3p启动子区CpG岛Figure 2 CpG islands in miR-141-3p gene promoter region analyzed by CpG island searcher
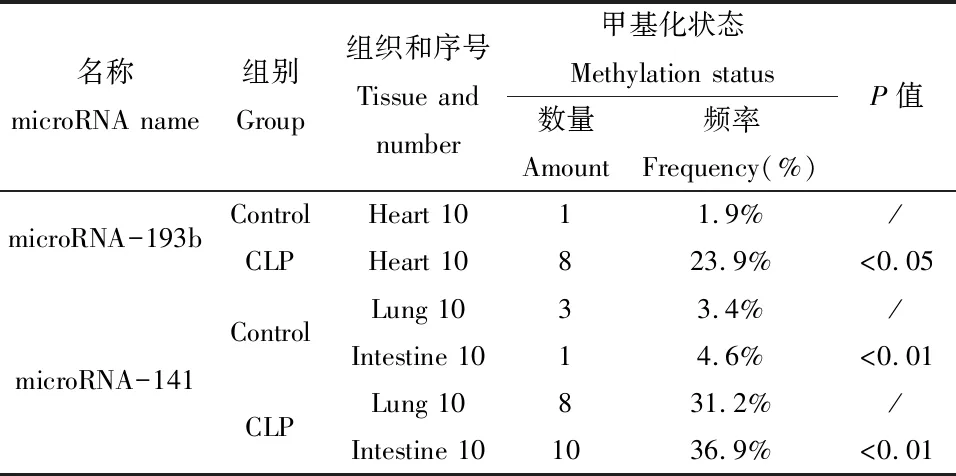
名称microRNA name组别Group组织和序号Tissue and number甲基化状态Methylation status数量Amount频率Frequency(%)P值microRNA-193bControlHeart 1011.9%/CLPHeart 10823.9%<0.05microRNA-141ControlLung 1033.4%/Intestine 1014.6%<0.01CLPLung 10831.2%/Intestine 101036.9%<0.01
3 讨论
盲肠结扎穿孔(CLP)模型广泛应用于探讨脓毒血症过程中的机制及病理生理学的改变。本文利用该模型观察到小鼠在术后24 h状态为休克晚期表现,有创的颈总动脉检测小鼠血压和心率相比于对照组均显著下降(表 2)。且血液检测发现相比于对照组,手术组小鼠的血糖降低、血乳酸水平增加,代谢紊乱,这些结果提示小鼠脓毒血症模型构建成功,在术后出现心功能障碍,机体组织以无氧酵解为主。这也与感染性休克晚期发生时机体产生的各种内源性介质和细胞因子,影响机体各种器官、系统的灌注,导致机体代谢紊乱、缺血缺氧,进而多器官功能衰竭一致[7,14]。感染性休克晚期时,机体过度释放促炎因子,如IL-1、IL-2和IL-6等[4],使得抗炎细胞因子和促炎细胞因子的失衡是其发病的重要机制。因此,目前探索脓毒血症早期发生的机制,寻找早期的预警、诊断和治疗靶点极其重要[4,9]。
microRNA在细胞内发挥多种重要的调节作用,通常可以调节多个靶基因。在脓毒血症导致的全身失衡的炎症反应过程中,研究报道证实多个microRNA参与炎症的调控[3,10]。microRNA-155在动脉粥样硬化免疫炎症反应中可被激活,表达水平增加,调节机体的免疫反应,改善动脉粥样硬化[11]。另外,microRNA-155也参与细菌刺激时机体的免疫调控[11]。在LPS诱导的炎症中microRNA-146a表达升高,推测其与炎症反应的调控相关,同时研究者也证实microRNA-146a在脓毒血症发生时发挥着调控免疫的重要作用[12]。这些研究表明在机体发生炎症刺激时,机体炎症反应的状态和水平可能通过microRNA表达水平的变化呈现,microRNA可作为感染性休克时的血清标志物,可作为其预警、诊断和治疗的新依据。
炎症发生时,脂肪细胞中过表达microRNA-193b可促进可抗炎的脂联素的分泌,并可抑制促炎脂肪因子的分泌[8],并且microRNA-193b是通过抑制趋化因子-2(chemokine ligand-2)和肿瘤坏死因子(tumor necrosis factor-α,TNF-α)的表达发挥抗炎作用。microRNA-141是miRNA 200家族成员之一,microRNA-141在卵巢癌中通过P38通路调节氧化应激,并且参与不同肿瘤的调节。且已有的研究中观察到,CLP小鼠模型中microRNA-193b和microRNA-141在受累器官的表达水平发生显著变化[13],且不同组织的表达变化不同,表明不同组织对感染性休克的反应不同,其靶蛋白的表达不同,这表明microRNA-193b和microRNA-141参与脓毒血症的调节,但目前仍不清楚它们的调节机制[8]。而microRNA可通过调控基因启动子区的甲基化水平进而影响自身的表达[6]。本研究观察到microRNA-193b在休克晚期心脏组织其CpG岛的甲基化水平升高,而microRNA-141在肺和小肠组织其CpG岛的甲基化水平升高[13](表 3)。结合以往的研究和本研究的结果表明,在感染性休克晚期小鼠中,microRNA-193b和microRNA-141在不同组织的表达水平和甲基化水平均发生变化,初步证实它们表达水平的变化与其CpG岛的甲基化水平的增高密切相关。因此,分析microRNA-193b和microRNA-141参与脓毒血症的调节可能的机制是microRNA-193b和microRNA-141的CpG岛的甲基化水平变化后影响其表达,继而在转录后水平影响相关调节炎症的靶蛋白的表达,维持炎症反应平衡,但具体机制有待进一步研究。该研究结果提示microRNA-193b和microRNA-141可能参与脓毒血症受累器官的功能调节,其表达水平和CpG岛的甲基化水平的变化是感染性休克的重要机制,为感染性休克早期预警、诊断和防治的潜在新靶点。

