生物质炭对水稻土团聚体微生物多样性的影响
朱孟涛,刘秀霞,王佳盟,刘志伟,郑聚锋,卞荣军,王艮梅,张旭辉,李恋卿,潘根兴
1 南京农业大学农业资源与生态环境研究所, 南京 210095 2 南京林业大学林学院, 南京 210037 3 江苏省有机固体废弃物资源化协同创新中心, 南京 210095
生物质炭是生物质在限氧条件下经过热裂解产生的高度芳香化的有机物质,具有比表面积大、吸附能力强、稳定性高等特点[1],其农业应用被认为是有效增加土壤碳固定与减缓气候变化的重要途径[2- 3]。研究表明,生物质炭在土壤中施用有多重效应,如改善土壤理化性质、增加土壤有机碳含量、提升保水性能、减少温室气体排放、降低养分淋失和提升作物产量等作用[4- 6]。此外,生物质炭施用还能显著影响土壤微生物群落结构和活性[7- 8],由于土壤中的诸多物质转化过程(如温室气体产生)大多依赖于土壤微生物的调节,因此,研究生物质炭施用对土壤微生物群落结构的影响对于深刻认识土壤的微观过程机制具有重要意义[9]。
目前,已有大量研究开始采用不同分子生物学技术(如PLFA、高通量测序等)探索生物质炭施用下土壤微生物群落结构变化及其与温室气体排放的关系,如Feng等[10]发现施用不同温度制备的生物质 炭(300,400,500℃)显著降低土壤甲烷的排放,进一步通过高通量测序表明甲烷氧化菌和产甲烷菌相对变化是CH4排放降低的主要原因;Sheng和Zhu[11]研究发现,生物质炭在酸性土壤中施用会导致富营养型微生物(拟杆菌门、芽单孢菌门等)丰度增加,而在碱性土壤中会使贫养型微生物(酸杆菌门)增加;Chen等[12]发现在旱地土壤中施用小麦秸秆(350—550℃)生物质炭(0,20,40 t/hm2)三年后,40 t/hm2生物质炭处理中放线菌门、γ-变形菌纲、厚壁菌门和子囊菌门的丰度显著降低,同时显著降低土壤呼吸对温度的敏感性。另外,有研究指出,生物质炭施用显著增加革兰氏阳性菌与革兰氏阴性菌比例(G+/G-)的同时降低了真菌与细菌的比例[13]。这些结果表明微生物群落结构或活性在生物质炭不同施用时间尺度下均发生了改变,但由于生物质炭原料、制备工艺、生产条件以及土壤类型存在较大差异,生物质炭施用对微生物的影响程度存在不同结果。除此以外,生物质炭施入土壤后与土壤颗粒相互作用形成的“生物质炭-土壤颗粒”微系统可改变土壤微生物的生境,这可能对土壤微生物群落结构及分布产生影响。然而到目前为止,这方面的研究还相对缺乏。
土壤团聚体是土壤结构的基本单元,对保持土壤水分和养分、协调土壤环境与微生物活性、维持土壤结构稳定具有重要意义[14]。不同农田管理措施(施肥、灌溉、耕作等)能不同程度的影响团聚体稳定性[15-16],同时伴随着土壤养分、微生物群落结构及酶活性变化[17-18]。随着生物质炭在土壤应用中研究的深入,生物质炭施用对土壤团聚体的组成、分布以及稳定性的影响已有报道[19],而且,不同团聚体中有机碳组分及结构也随生物质炭施用而发生变化[20-21]。尽管目前生物质炭应用对土壤微生物影响的研究已开展了大量工作,但主要集中在全土范畴[22- 23]。作为微生物在微观尺度上的载体,土壤团聚体粒组的分布在土壤施用生物质炭条件下发生改变,这可能伴随微域环境中有机物组成、孔隙、水分等生态因子的重组,从而导致微生物群落在不同粒组中的重新分配,进而影响微域环境中的物质和元素循环。然而,团聚体尺度上土壤微生物群落结构如何响应于生物质炭,不同团聚体粒组中微生物对其响应是否一致,目前都还少有报道。
为此,本试验选择太湖地区施用生物质炭两年后的水稻土为研究对象,采集表层(0—15 cm)原状土壤,采用湿筛法[24]进行团聚体分组,并通过Illumina Miseq平台对土壤微生物进行高通量测序,以期在团聚体尺度上揭示生物质炭施用对稻田土壤微生物群落和多样性的影响。
1 材料方法
1.1 试验地概况与试验设计
田间试验开始于2016年5月,地点位于江苏省宜兴市徐舍镇 (31°41′N, 119°73′E)。该地属于亚热带季风气候,年均温为15.7℃,年均降水量为1246.3 mm。土壤类型是太湖地区第四纪湖积物发育的典型脱潜型水稻土-乌泥土,种植制度为夏水稻-冬小麦轮作。试验设置两个处理,未施生物质炭(C0)和生物质炭处理(C15),小区面积为30 m2(5 m×6 m),每个处理设3次重复,完全随机区组设计。所施入的玉米秸秆生物质炭在450℃下限氧烧制,于2016年5月水稻种植前按15 t/hm2的用量一次性施入土壤表层,通过翻耕使其与土壤均匀混合(0—15 cm)。生物质炭基础理化性质为:有机碳含量431.00 g/kg,全氮含量为7.97 g/kg,C/N为51.82,速效磷含量为2.36 mg/kg,pH为8.79。土壤的基础性质见表1。

表1 供试土壤的基础性质
C0, 未施用生物质炭处理 Soil without biochar amendment;C15,生物质炭施用量为15 t/hm2的处理 Soil with biochar amendment at the rate of 15 t/hm2
1.2 土壤样品采集与处理
土壤样品于2018年4月采集,按照S形路线使用不锈钢半圆柱专用采样铲采集表层土壤(0—15 cm),每个小区采集6个土壤样品。将采集的原状土置于不锈钢收集罐后立即带回实验室,按照自然裂隙掰成约1 cm3大小土块并混合均匀。由于微生物对外界环境反应迅速,因此,在样品取回实验室24 h内完成团聚体样品的分离。另一部分混合样品风干处理,剔除植物残体及侵入体,以备土壤基础性质测定。
1.3 团聚体分组
(1)土壤团聚体分组根据Six等[24]的方法略加修改。简单来说,称取一定量新鲜土样(相当于50 g风干土重)置于孔径为2000 μm筛中,在室温下(20±2)℃浸没于无菌水中30 min,使水分充满土壤孔隙。上下震荡筛子,振幅在3 cm左右,频率为每分钟50次,震荡3 min,使土壤全部过筛。将过筛后的土壤悬浊液置于250 μm筛中,按上述操作继续震荡3分钟,然后将滞留于筛上的土壤颗粒用水清洗并转移至离心管中,在4000 rpm的条件下离心30 min。将得到的团聚体迅速置于-80℃冰箱冷藏。此步骤得到2000—250 μm土壤粒组(大团聚体),以Mac表示。按上述步骤,进一步可以得到250—53 μm土壤粒组(微团聚体),以Mic表示,<53 μm的土壤粒组(粉、黏粒组分),以SC表示。并通过平均质量直径(MWD)和大于250 μm团聚体的质量比例(R0.25)两个指标表示团聚体稳定性。
团聚体稳定性评价指标:
(2)平均质量直径(MWD)
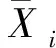
(3)大于250 μm团聚体的质量比例(R0.25)
式中,MR0.25表示大于250 μm团聚体的质量;MT表示团聚体总质量。
1.4 微生物高通量测序
使用PowerSoilR DNA 提取试剂盒 (Mo Bio Laboratories Inc., CA) 按说明书提供的步骤对土壤样品进行细菌和真菌的 DNA提取,并利用1%琼脂糖凝胶电泳检测提取的DNA质量。之后对细菌16S rRNA中的V3—V4高变区进行PCR扩增,引物序列为 F338(ACTCCTACGGGAGGCAGCAG)和R158(ATTACCGCGGCTGCTGG);对真菌18S rRNA的ITS1基因进行PCR扩增,引物为 1737F(CTTGGTCATTTAGAGGAAGTAA)和 2043R(TGCGTTCTTCATCGATGC)。扩增后,用2%琼脂糖凝胶电泳检测扩增产物,之后切胶、回收、建立文库并使用Illμmina Miseq 平台进行测序。对测得的数据进行过滤,去除嵌合体、短序列后得到优质序列。用usearch方法按照97%相似度对序列进行OTU聚类(不含单序列)。通过Chao1指数评估群落中OTU数目,Shannon指数估算样品中微生物多样性。通过与细菌silva128数据库和真菌Unite数据库比对,使用Qiime平台的Ribosomal Database Project (RDP) Classifier算法(70%置信度)生成不同分类水平的微生物丰度表,以此评估各团聚体粒组中门、纲、目、科、属、种(phylum, class, order, family, genus, species)水平细菌和真菌物种组成及相对丰度。
1.5 数据处理
试验所得数据使用 Microsoft Excel 2016 进行处理,SPSS 20.0软件进行方差分析,采用Duncan法进行显著性差异比较(P< 0.05),最后用 OriginPro 2015进行图形绘制。利用Mothur软件对每个样品做α-多样性指数(Chao1, Shannon)分析。在β-多样性指数中,使用UniFrac软件对PCA结果进行分析以明确不同处理及团聚体间微生物群落是否存在差异。
2 结果与分析
2.1 土壤团聚体
由表2可知,C0和C15处理的质量回收率分别为95.6%和97.7%。从团聚体的分布来看,粉、黏粒组分在两个处理中均比例最高,达到75.85%—80.49%;而大团聚体和微团聚体所占比例都在10%左右。与C0处理相比,生物质炭施用下大团聚体显著增加42.00%,而粉、黏粒组分降低5.76%,同时MWD和R0.25分别显著增加35.92%和21.05%。
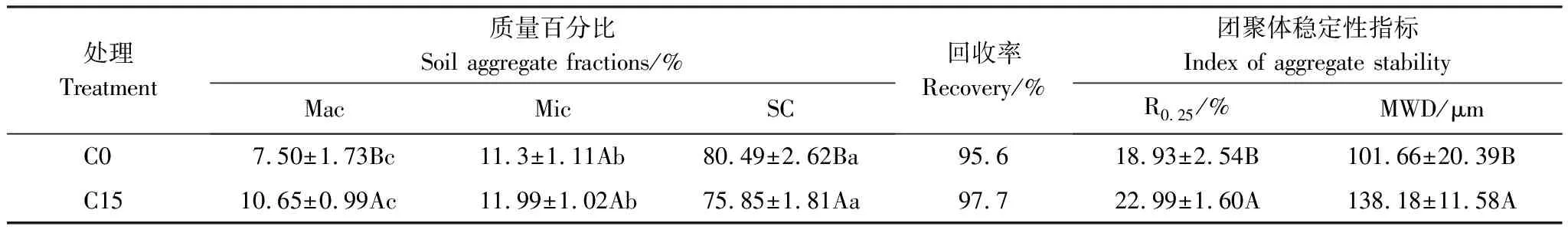
表2 团聚体分布和稳定性指标
Mac, 大团聚体 macro-aggregates;Mic, 微团聚体 micro-aggregates;SC, 粉、黏粒组分 silt-clay fraction;R0.25, 粒径大于250 μm的团聚体的质量比例 ;MWD,平均质量直径 Mean weight diameter;表中不同小写字母表示同一个处理内部不同粒径团聚体间存在显著差异,不同大写字母表示同一粒径的团聚体在不同处理间存在显著差异(P<0.05);图中数据为平均值±标准差(n=3)
2.2 OTU及α-多样性
与C0处理相比,C15处理全土中细菌的OTU和Chao1指数分别升高12.39%,13.89%;真菌的OTU、Chao1和Shannon指数分别明显升高27.60%,15.47%和12.32%。显然施炭增加了全土微生物OTU和α-多样性(表3)。就同一个处理内不同粒径团聚体间而言,无论是C0还是C15处理,细菌的OUT、Chao1和Shannon指数均无明显差异。而真菌在C15处理大团聚体中的OTU明显低于其他组分,同时微团聚体的Shannon指数明显低于粉、黏粒组分。从不同处理的同一团聚体粒径中的微生物来看,生物质炭施用显著提高了各粒径团聚体中细菌OTU数目和α-多样性,但对真菌无显著影响。
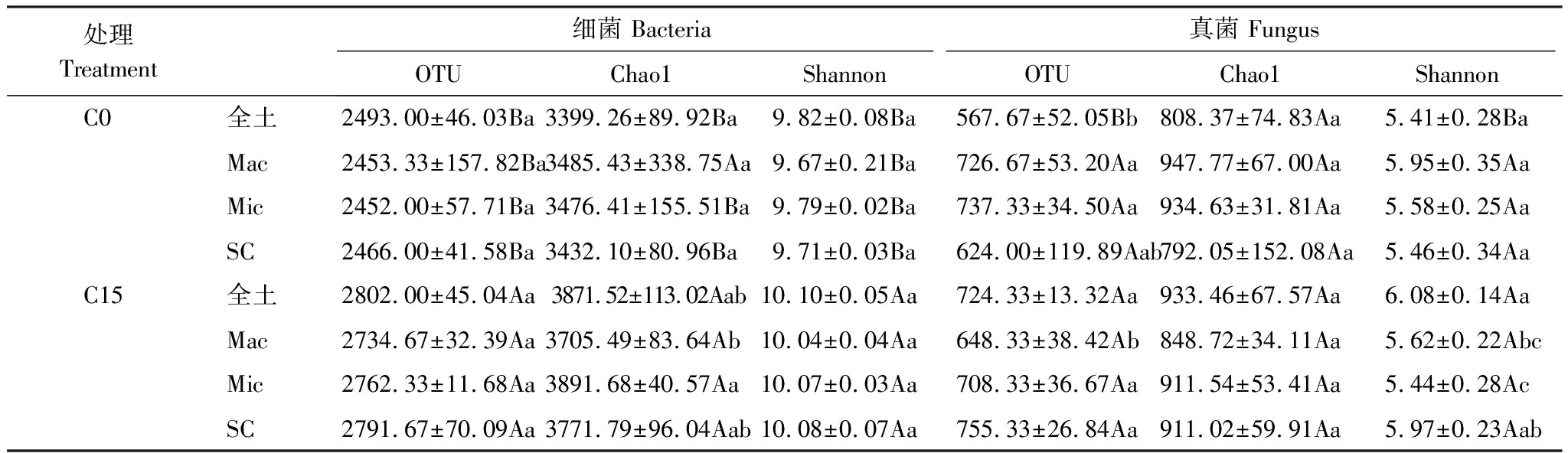
表3 不同处理下全土及团聚体中微生物OTU及α-多样性指数
OTU,操作分类单元 operational taxonomic unit;Chao1,丰富度估计量Chao1 richness estimator;Shannon,香农多样性指数 Shannon diversity index;表中不同小写字母表示同一个处理间不同粒径团聚体中的OTU及α-多样性指数的显著差异,不同大写字母表示不同处理间相同粒径团聚体中OTU及α-多样性指数的显著差异(P<0.05);图中数据为平均值±标准差(n=3)
2.3 细菌和真菌多样性
通过主成分分析(PCA)可以清晰的看出(图1),两处理间及团聚体间微生物群落结构存在明显差异。细菌和真菌的前两个主要成分分别能够解释总变异度的55.86%和54.58%。在第一主成分上(PC1),C0和C15处理间的微生物均能显著分开,这表明生物质炭施用导致微生物的群落结构产生变化。在第二主成分上,对细菌而言,无论是C0还是C15处理,大团聚体和微团聚体间的距离较近,且与粉、黏粒组分显著分开,这表明细菌在大团聚体和微团聚体中的群落相似,而与粉、黏粒组分存在较大差异。与细菌的变化有所不同,对真菌而言,C0处理中的大团聚体与<250 μm组分(微团聚体+粉、黏粒组分)的群落结构在第二主成分上明显分开。而在C15处理中,微团聚体中的群落结构有向大团聚体群落结构靠近的趋势。这表明,生物质炭的施用会使微团聚体中的真菌群落结构向着大团聚体中群落结构方向发展。
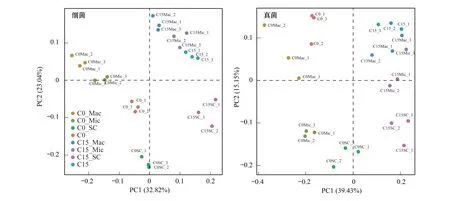
图1 细菌、真菌群落结构主成分分析(PCA)Fig.1 Principal component analysis of bacteria and fungusC0_Mac,C0处理中的大团聚体组分样本 The macro-aggregates fraction in C0 treatment;C0_Mic,C0处理中的微团聚体组分样本 The micro-aggregates fraction in C0 treatment;C0_SC,C0处理中的粉、黏粒组分样本 The silt-clay fraction in C0 treatment;C0,C0处理的全土样本 The bulk soil in C0 treatment;C15_Mac,C15处理中的大团聚体组分样本 The macro-aggregates fraction in C15 treatment;C15_Mic,C15处理中的微团聚体组分样本 The micro-aggregates fraction in C15 treatment;C15_SC,C15处理中的粉、黏粒组分样本 The silt-clay fraction in C15 treatment;C15,C15处理的全土样本 The bulk soil in C15 treatment
图2为两处理主要细菌门和目水平的相对丰度。本研究中共发现43个门,主要包括变形菌门(Proteobacteria),酸杆菌门(Acidobacteria),绿弯菌门(Chloroflexi),芽单胞菌门(Gemmatimonadetes),放线菌门(Actinobacteria),硝化螺旋菌门(Nitrospirae)和拟杆菌门(Bacteroidetes)等。共发现263个目,主要包括β-变形杆菌目(Betaproteobacteriales),SBR1031,粘球菌目(Myococcales),厌氧绳菌目(Anaerolineales),根瘤菌目(Rhizobiales),溶菌目(Solibacterales)和芽单胞菌目(Gemmatimonadales)等。同一个处理中不同粒组团聚体的微生物相对丰度存在差异。对C0处理而言,随着团聚体粒径的增大,门水平的变形菌门、芽单胞菌门和硝化螺旋杆菌门以及目水平的β-变形杆菌目、芽单胞菌目的相对丰度逐渐降低,而酸杆菌门、粘球菌目、厌氧绳菌目、溶菌目的相对丰度逐渐升高。C15处理中,随着团聚体粒径的增大,变形菌门、SBR1031、根瘤菌目的相对丰度升高,而硝化螺旋杆菌门、Patescibacteria、疣孢菌门(Verrucomicrobia)的相对丰度逐渐降低。施用生物质炭显著改变了土壤微生物的相对丰度。从全土来看,C15处理的酸杆菌门和芽单胞菌门的相对丰度比C0处理分别下降36.93%和16.44%,而变形菌门、硝化螺旋杆菌门和拟杆菌门的相对丰度分别增加23.38%,71.28%和31.31%。在目水平上,施炭导致厌氧绳菌目相对丰度下降32.86%,而β-变形杆菌目和根瘤菌目的相对丰度分别升高42.28%和22.89%。从不同粒组团聚体中微生物的相对丰度来看,与C0处理相比,随着团聚体的粒径增加,C15处理中的变形菌门相对丰度变化分别为-4.19%、7.05%和14.37%,变形菌门中的β-变形杆菌目的变化趋势相似,分别为-3.92%,12.96%,33.82%;酸杆菌门分别下降0.40%,17.31%和20.15%,溶菌目分别降低25.85%,19.04%,19.59%;芽单胞菌门由降低34.50%和26.40%至无显著变化(2.82%),相似的,芽单胞菌目的变化分别为-33.28%,-25.63%,7.02%。
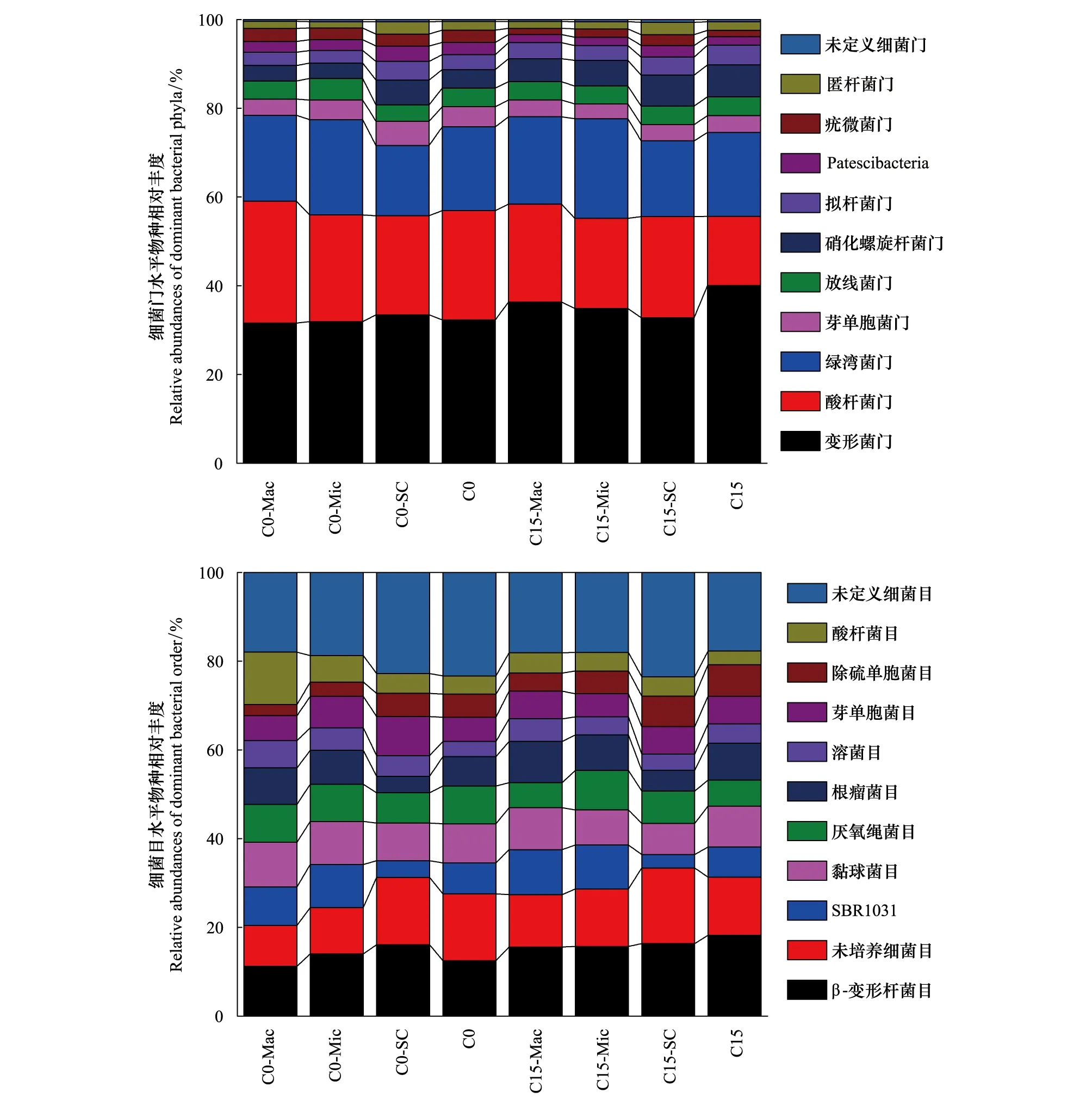
图2 细菌门、目水平相对丰度Fig.2 Relative abundances of the dominant bacterial phyla and order under different treatments
图3为两处理主要真菌门和目水平的相对丰度。本试验样本中共发现17个真菌门,主要包括子囊菌门(Ascomycota),鞭毛菌门(Mortierellomycota),担子菌门(Basidiomycota)和球囊菌门(Glomeromycota)。共发现114个真菌目,主要包括被孢霉目(Mortierellales)、竹盖菌目(Hypocreales)、粪壳菌目(Sordariales)、座囊菌目(Dothideomycetes)、格孢腔菌目(Pleosporales)和佩齐亚目(Pezizales)等。与细菌相似,同一个处理不同粒径团聚体间的真菌相对丰度存在差异,并且随着团聚体粒径的增大,两处理中均呈现出子囊菌门、罗茨菌门、格孢腔菌目相对丰度逐渐减少和担子菌门、球囊菌门、类球囊霉目相对丰度增加的趋势。从全土角度来看,C15处理中担子菌门、球囊菌门的相对丰度比C0处理分别增加139.97%和18.88%,而子囊菌门相对丰度降低20.16%,其中,子囊菌门中的粪壳菌目和佩齐亚目的相对丰度分别显著降低25.06%和81.88%。从土壤团聚体角度来看,与C0处理相比,随着团聚体粒径的增加(从粉、黏粒组分到大团聚体粒组),C15处理中子囊菌门相对丰度的变化表现为-12.15%、19.93%和25.94%。竹盖菌目相对丰度变化为-29.28%、-6.17%和35.52%。粪壳菌目在3个团聚体粒组中都出现下降(-34.04%,-29.37%,-43.42%)。担子菌门的相对丰度在粉、黏粒组和微团聚体中分别显著增加90.52%和38.14%,而在大团聚体粒组中无显著变化。
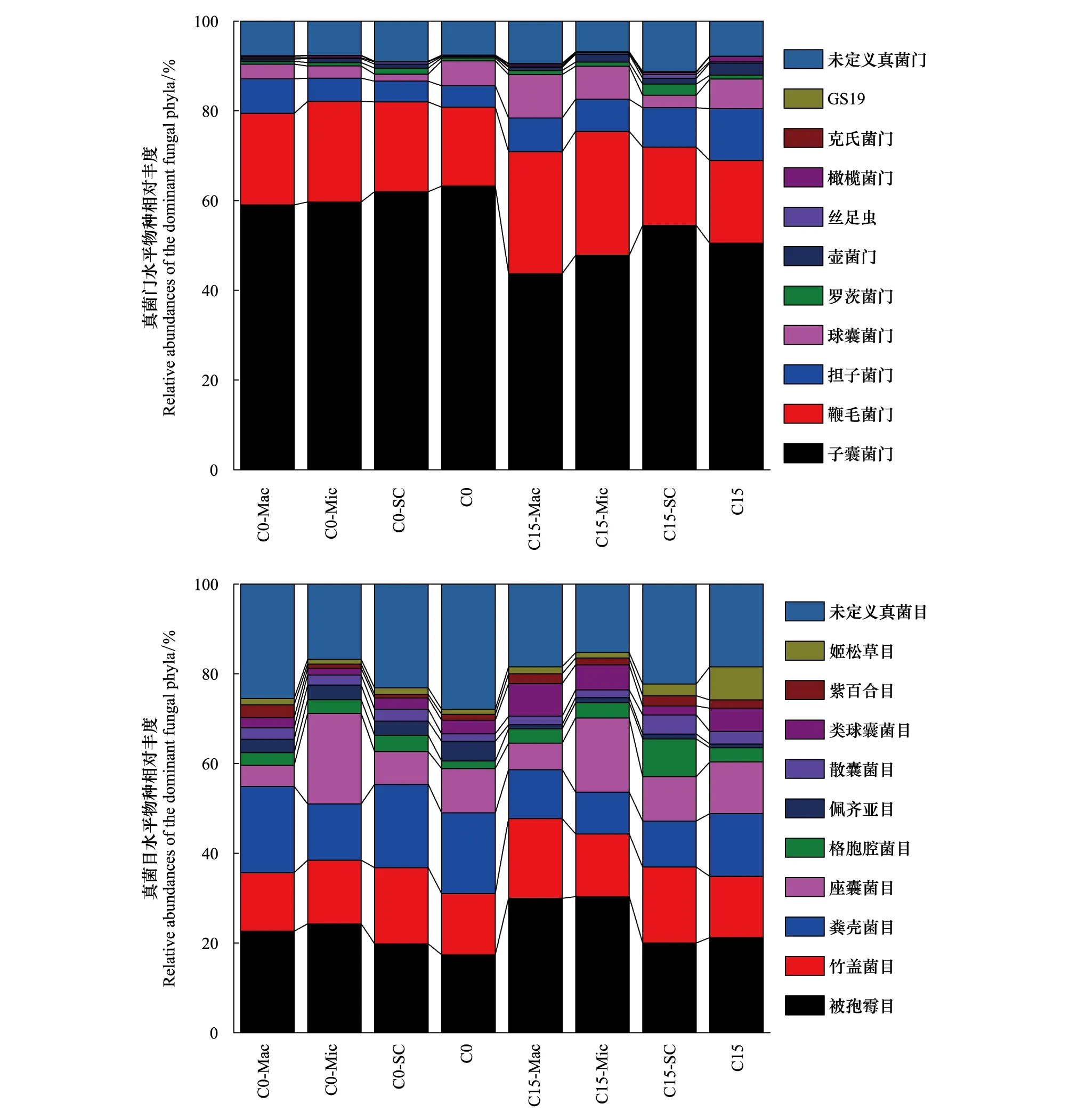
图3 真菌门、目水平相对丰度Fig.3 Relative abundances of the dominant fungal phyla and order under different treatments
3 讨论
3.1 生物质炭对土壤团聚体分布的影响
土壤团聚体组成与分布受农田管理措施显著影响,生物质炭施用可显著改变其存在状态。部分试验表明生物质炭施用能显著促进团聚体的形成[25],Yoo等[26]通过向种植水稻和牧草的土壤中分别添加5%的玉米秸秆及其制备的生物质炭(450℃),培养18周后发现,生物质炭添加使微团聚体(250—53 μm)增加超过200%;Liu等[25]以油菜-土豆轮作系统为对象,在中国亚热带山地红壤中施用350—550℃小麦秸秆生物质炭(0,2,5,10,20,30,40 t/hm2)后发现,施炭显著增加表层土壤中大团聚体数量并且提高团聚体MWD的28.02%。本研究结果发现,相对于未施生物质炭处理,施用生物质炭两年后大团聚体显著增加42.00%,而且土壤团聚体的MWD和R0.25分别显著增加35.92%和21.05%(表2)。这表明生物质炭在不同土壤类型中,无论短期还是长期作用下均可促进团聚体的形成和团聚体稳定性的增加。生物质炭农田应用对土壤团聚体分布的改变与生物质炭本身的粒径大小和结构有很大关系[27],由于生物质炭巨大的比表面积和各类官能团,使其具有较强的吸附性能[28- 29],从而在土壤中充当了胶结剂的作用,增加对粉、黏粒组分的团聚作用[30]。其次,生物质炭包含从纳米到厘米级的颗粒,在田间大量施用后,小颗粒生物质炭可以进入团聚体内部或与矿物结合态有机物结合[31],增加其胶结性。而游离的大尺寸生物质炭颗粒则对土壤颗粒或微团聚体进行吸附,可进一步促进了土壤颗粒的团聚过程。另外,生物质炭在土壤中可以刺激真菌菌丝的生长,增加土壤颗粒的胶结作用,从而促进其向大团聚体的演变。通过对团聚体进行扫描电镜(SEM)观察发现游离的大颗粒生物质炭表面附着大量土壤颗粒(图4),这也成为生物质炭促进土壤颗粒团聚化的直观证据。再者,由于生物质炭自身极强的抗分解能力,使得以生物质炭为核心的团聚体的稳定性远高于以植物凋落物为核心的团聚体,这会大大降低由微生物对活性有机组分利用而导致团聚体结构毁坏的可能性[32]。
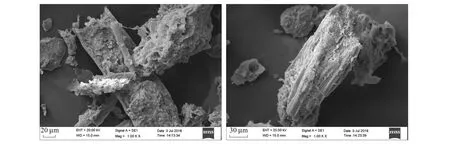
图4 生物质炭在土壤团聚体中的扫描电子显微镜图Fig.4 Scanning electron microscope (SEM) image of biochar in soil aggregates
3.2 生物质炭对土壤微生物丰度和多样性的影响
土壤微生物多样性和丰度的增加对增强水稻土生态功能的稳定和健康具有重要意义[9]。研究表明生物质炭施用对土壤细菌和真菌群落结构的影响不尽相同,如Zheng等[9]在中国西南部酸性水稻土中施用350—550℃的小麦秸秆生物质炭(0,20,40 t/hm2)发现,生物质炭施用4年后明显增加了细菌α-多样性,同时降低了真菌的丰度。在本研究中,生物质炭处理两年后同时提高了土壤中细菌和真菌的α-多样性。这表明,生物质炭短期添加和长期存在对微生物产生的影响可能存在差异。一些室内短期培养试验表明生物质炭本身的性质,如pH、孔隙结构和化学组成特性等,是影响微生物丰度和多样性的重要原因[11,33]。而在一些中长期田间试验中,土壤理化性质的改善(降低土壤容重、增加土壤通气性、提升土壤保水性等)被认为是提高微生物丰度和多样性的重要因素[34- 35]。如最近一些研究发现,田间施用生物质炭缓解了作物与微生物对营养元素的竞争,这一方面是因为生物质炭本身携带的活性物质为微生物提供了丰富的养分和能源,另一方面,由于生物质炭施用对作物生长的促进作用,间接增加了光合产物由根系向土壤中的输入[36- 37],从而促进了土壤微生物的生长与繁殖。
微生物群落结构的改变直接影响土壤养分循环[38]。本研究发现生物质炭施用两年后的土壤中主要的微生物门水平(变形菌门、酸杆菌门、子囊菌门、担子菌门)以及目水平(β-变形杆菌目、粘球菌目、被孢霉目、竹盖菌目)的相对丰度均发生明显变化,这会进一步影响其在土壤中的功能。就富营养型微生物的变形菌门以及对简单碳水化合物利用效率较高的被孢霉目而言,二者通常被认为与土壤中活性碳组分的含量呈正相关关系[39],而贫养型微生物的酸杆菌门与可溶性有机碳(DOC)含量存在负相关关系[40]。研究表明施用生物质炭不仅增加土壤中的惰性碳组分,同时也会提高土壤中DOC等活性碳库的含量[41],这可能是本试验中变形菌门和被孢霉目相对丰度的升高的重要原因。不同土壤利用类型及生物质炭原料对酸杆菌门的影响可能存在差异,如Chen等[12]在旱地土壤中施用350—550℃小麦秸秆生物质炭(0,20,40 t/hm2)三年后发现,施炭后酸杆菌门的相对丰度有所升高;而Li等[42]在中国紫土中施入玉米秸秆生物质炭(500℃)后却导致酸杆菌门相对丰度的降低。酸杆菌门主要对木质素,纤维素和半纤维素等有机物的分解起关键作用[43]。因此,在本试验中酸杆菌门相对丰度的降低表明施用生物质炭有利于植物残体在土壤中的积累。真菌对于稳定性较高的碳组分的取食能力以及在高C/N条件下的生存能力高于细菌[44]。生物质炭的施用显著提升土壤碳氮比的同时改善土壤通气状况,这有利于担子菌门的生长。研究表明,担子菌门与高稳定性有机组分(木质素,纤维素等)的含量呈正相关关系[45]。而生物质炭含有的大量芳香性稳定有机物可能会促进担子菌门相对丰度的升高。在本研究中占据主导地位的子囊菌门是高稳定性有机物降解的主要参与者[42],其相对丰度显著降低可能促进土壤有机碳的积累。
3.3 生物质炭施用对水稻土团聚体中微生物群落分布的影响
土壤团聚体包含大小不同的孔隙和土壤颗粒,能为土壤微生物提供多样的栖息环境,从而影响土壤微生物在微域环境的分布[46]。研究表明,真菌与细菌的比例在>1.0 mm的团聚体中明显高于<1.0 mm团聚体,且土壤微生物生物量和群落结构受0.05—5.0 mm团聚体含量的显著影响[47]。本次试验的PCA分析表明,无论是对细菌还是真菌,微生物在不同粒组团聚体中的分布存在显著差异。大团聚体的酸杆菌门和担子菌门,SBR1031和根瘤菌目的相对丰度明显高于粉、黏粒组分,而粉、黏粒组分中的硝化螺旋杆菌门、子囊菌门、格孢腔菌目和散囊菌目(Eurotiales)的相对丰度则高于大团聚体。这些差异与土壤团聚体形成的微环境的差异有密切关系,如不同粒径团聚体中的有机物化学组成、C/N、孔隙组成、水分状况和氧气含量等生态因子的多样化使微生物分布出现明显异质性[48-49]。而生物质炭处理相比无炭土壤,变形菌门、鞭毛菌门、β变形杆菌目、被孢霉目的相对丰度在大团聚体中明显增加,酸杆菌门、粪壳菌目、厌氧绳菌目的的相对丰度在微团聚体明显降低。这些结果表明,生物质炭施用在微域环境中使土壤微生物产生了分异,这些变化可能与以下因素有关。首先,生物质炭通过胶结或包裹作用或真菌的菌丝作用增加了土壤的团聚作用,改变了原始土壤颗粒的组合方式,从而在空间分布上使微生物群落发生重新组合和分配;其次,由于生物质炭对土壤的改善作用(如改善通气性、保水性等),在土壤颗粒重新组合后,相应的在土壤微环境中的营养物质和生态因子也随之改变,在此情况下,微生物在新环境中重新适应,进而影响微生物的生长繁殖并改变其结构和组成。由于各粒组微环境的变化程度并不一致,因而导致在不同团聚体粒组中敏感微生物的变异不尽相同。反过来,这些敏感微生物群落的改变又可能影响所在生境中养分转化和循环[30],然而,它们之间的相互作用机制还有待于进一步研究。
4 结论
(1)水稻土施用生物质炭显著改变了土壤团聚体的分布及稳定性,主要表现为大团聚体含量的增加与稳定性的提高。
(2)施用生物质炭显著改变了土壤微生物群落结构和多样性。与对照相比,生物质炭施用下全土中细菌和真菌的多样性显著增加。在门水平上,变形菌门、硝化螺旋杆菌门和担子菌门的相对丰度明显升高,而子囊菌门、酸杆菌门和芽单胞菌门的相对丰度明显下降;在目水平上,β-变形杆菌目、竹盖菌目和被孢霉目的相对丰度明显升高,而粪壳菌目、厌氧绳菌目和溶菌目的相对丰度明显下降。
(3)不同粒径团聚体中微生物群落结构存在明显差异。大团聚体中酸杆菌门、担子菌门、根瘤菌目的相对丰度明显高于其他粒组,而硝化螺旋杆菌门、子囊菌门、β-变形杆菌目呈相反趋势。施用生物质炭显著改变了不同粒组中微生物群落分布。与未施用生物质炭相比,生物质炭施用显著增加了大团聚体中变形菌门、鞭毛菌门、竹盖菌目、β-变形杆菌目以及粉、黏粒组中的担子菌门、球囊菌门、格孢腔菌目的相对丰度,降低了微团聚体中酸杆菌门、放线菌门、子囊菌门、粪壳菌目以及粉、黏粒组分中芽单胞菌门、子囊菌门和厌氧绳菌目的相对丰度。

