模拟降雨对黄土高原典型草原土壤化学计量及微生物多样性的影响
王誉陶,李建平,2,*,井 乐,张 翼,张 娟
1 宁夏大学农学院, 银川 750021 2 西北退化生态系统恢复与重建国家重点实验室培育基地, 银川 750021
随着全球气候变暖,全球降水分布格局也相应发生了一系列变化[1- 2],在干旱半干旱地区,水分是影响草地生态系统中植被生长的主要限制因素[3],降水格局变迁导致植物及微生物生境发生变化,进而导致土壤微生物多样性及土壤化学元素发生相应改变[4- 5]。黄土高原半干旱区作为全球气候变化的敏感区,研究该区土壤及微生物特征对降雨变化的响应机制,对于该区植被应对气候变化具有重要的科学意义。
碳、氮、磷是生物有机体所必须的营养元素[6],同时也是草地生态系统的关键限制元素,且元素之间的相互平衡及作用机制,对于揭示生态系统稳态转化机制具有重要的理论和实践意义[7- 8]。气候变化对土壤营养元素的影响已有大量报道,如模拟增温、增雨提高内蒙古锡林浩特旱区草原土壤酶活性[9]、二氧化碳浓度升高对大豆根际微生物群落结构的影响[10],草地生态化学计量特征对于降雨变化的响应极为敏感[11],休眠期增温对黄土高原天然草地植被生产力提升明显[12]。也有研究表明海拔梯度[13-14]、火烧干扰[15]、放牧措施[16]等对土壤生态化学计量特征影响显著。
微生物是养分元素循环的“转换器”[17]、环境污染的“净化器”[18]、陆地生态系统稳定的“调节器”[19],时刻影响着人类的生存、生活与发展。土壤微生物多样性与土壤养分储存之间存在密切关系,是天然草地中最活跃的组分[20],也是评价土壤养分含量变化的有效指标之一[21-22]。土壤微生物多样性对于气候变化反馈明显,研究表明,在气候变化大背景下,青藏高原大多数地区在未来几十年土壤微生物多样性将呈增加趋势,气候变化对地下微生物的影响不仅在当代而且在未来[23],大气氮沉降增加贝加尔针茅草原和中亚热带杉木人工林土壤微生物多样性[24-25],增温、增雨及交互作用影响土壤微生物多样性与土壤温湿度之间的关系,并未表现出特异性规律[26];相反,二氧化碳浓度和温度升高,土壤细菌和真菌丰度没有显著变化[27],增温和降水变化对青藏高原高寒草甸土壤 nirK(可溶性含铜酶)、nirS(细胞色素酶)、nosZ(氧化亚氮还原酶) 反硝化菌群落多样性没有明显的影响,不同采样时间对多样性也没有明显影响[28]。
总结已有研究看来,气候变化对土壤化学计量及土壤微生物研究及二者之间的相关性研究报道较少。因此,本试验以黄土高原宁夏云雾山自然保护区天然草地为研究对象,采用人工遮雨/补雨装置,实现不同降雨梯度,深入研究降雨变化对不同深度土壤微生物、土壤化学计量及二者之间的关系,研究工作可为气候变化背景下草地生态系统可持续发展提供一定的科学依据。
1 材料与方法
1.1 研究区概况
试验区地处黄土高原腹地的宁夏固原云雾山自然保护区(106°21′—106°27′ E,36°10′—36°17′ N),海拔1700—2148 m,属于温带半干旱气候区,年平均气温7 ℃,年均降水量为425 mm(1980—2014年平均值),且多集中在夏季,年蒸发量1300—1640 mm,年日照时数可达 2500 h,≥0 ℃积温 2370—2882 ℃,无霜期112—140 d,土壤为山地灰褐土和黑垆土,植被类型为典型草原,长芒草(Stipabungeana)、铁杆蒿(Artemisiagmelinii)、冰草(Agropyronmichnoi)、大针茅(S.grandis)、冷蒿(A.frigida)、星毛委菜(Potentillaacaulis)等是主要的优势植物[29-30]。
1.2 试验设计与方法
1.2.1试验设计
本研究以黄土高原宁夏固原云雾山封育19年天然草地为研究对象(106°22′53.1″ E,36°15′07.3″ N,海拔2077 m,半阳坡,坡度7—10°),采用单因素完全随机试验,水分梯度分别为正常降雨的150%、50%、100%,分别记为A、B、C(对照区),每个降雨梯度设置3个6 m × 6 m水分控制重复,为防止水分扩散,在每个水分控制小区四周利用1.2 m宽塑料板进行水分隔离,塑料板的地下埋藏深度为1.1 m,地上漏出10 cm阻止地表径流。小区上采用钢架结构与V形透明塑料板对50%雨水进行收集形成减雨区B,采用滴管将收集雨水滴灌至A形成150%增雨区(灌管设置高于植被平均高度,形成冠层降水),正常降雨为C。土层采样深度分别为0—10 cm,10—20 cm,20—30 cm,分别记为X、Y、Z。重复样品分别对应为D、E、F。水分控制试验示意图见图1,水分控制试验时间为2017年5月—2018年5月,期间正常降雨量为512 mm。
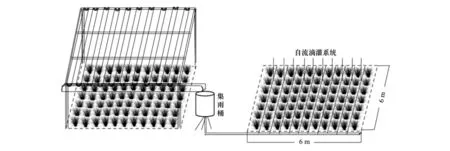
图1 水分控制装置Fig.1 Water control device
1.2.2样品采集
2018年5月,在A、B、C区各随机选择3个重复,用直径6 cm原状土—土钻取样,以10 cm为取样间隔,取0—30 cm土层土样(0—10 cm,10—20 cm,20—30 cm),每个重复随机取土样3次,将每个重复样点内 3个取样点同一土层土壤混和组成1个土壤样品,去除残留的枯落物及混杂物后装入无菌密封袋,立即带回实验室放入4℃冰箱供土壤理化性质和微生物多样性分析,共计采集土壤样品27个。为了便于微生物多样性的分析,对样品进行编号(表1),如A-D-X代表150%降雨梯度下第1个重复0—10 cm土层深度样品。

表1 样品编号对应表
TA:水分梯度分别为正常降雨的150% A;TB:水分梯度分别为正常降雨的50% B;TC:水分梯度分别为正常降雨的100% C;D:每个水分处理下第1个重复样品 D;E:每个水分处理下第2个重复样品 E;F:每个水分处理下第3个重复样品 F;X:0—10 cm土层深度土壤 X;Y:10—20 cm土层深度土壤 Y;Z:20—30 cm土层深度土壤 Z
1.3 样品分析方法
土壤SOC采用重铬酸钾容量法-外加热法测定,土壤TN采用半微量凯氏蒸馏法测定[31-32],土壤TP采用高氯酸-浓硫酸(HCLO4-H2SO4)消煮后流动注射仪测定(型号Skalar-SAN++);土壤微生物多样性是基于 Illumina HiSeq 测序平台,利用双末端测序(Paired-End)的方法,构建小片段文库进行测序,通过对 Reads 拼接过滤,OTUs(Operational Taxonomic Units)聚类,并进行物种注释及丰度分析,揭示样品的物种构成,进一步进行α多样性分析(Alpha Diversity)、β多样性分析(Beta Diversity)和显著物种差异分析等等,挖掘样品之间的差异。细菌主要是基于16S区,真菌主要基于18S区或ITS区(内转录间区)(北京百迈克云科技有限公司)。
1.4 数据分析
采用Excel 2010软件进行数据记录及整理,Origin 8.0进行图表绘制,采用SPSS软件对不同水分管理和不同土层深度数据进行单因素Anova统计分析,并在不同处理下对土壤碳氮磷含量、化学计量比和微生物多样性进行Pearson相关性分析,使用Mothur (version v.1.30) 软件,对样品丰富度估计指数Chao1、ACE指数和样品多样性指数Shannon、Simpson指数进行评估。
2 结果与分析
2.1 土壤碳氮磷含量变化
在0—20 cm土层中,不同水分梯度下,土壤SOC、TN、TP均无显著性差异;在20—30 cm,100%和150% 降雨处理土壤TN显著高于50% 降雨处理,SOC和TP无显著变化,表明増雨或减雨对草地各层土壤碳氮磷含量影响较小(图2)。
同一降雨梯度下不同土层深度间土壤的碳、氮、磷含量进行差异性分析表明,在3个降雨梯度中,0—10 cm土壤SOC含量显著高于10—20 cm、20—30 cm(P<0.05),在100%降水处理下,10—20 cm土壤SOC含量显著高于20—30 cm(P<0.05),而在50%和150%水分处理下,10—20 cm土层与20—30 cm土层SOC含量差异不显著。各水分处理下0—10 cm、10—20 cm、20—30 cm土壤SOC含量平均值分别为7.935、6.735、6.469 g/kg,表现为随着土层的加深逐渐递减,即表层土壤的SOC含量最高(图2)。
在3个降雨梯度中,0—10 cm土壤TN含量显著高于10—20 cm、20—30 cm(P<0.05),50%降雨处理下,10—20 cm土壤TN含量显著高于20—30 cm(P<0.05),100%和150% 降雨梯度下,10—20 cm和20—30 cm土壤TN含量无显著差异。各水分处理下,0—10 cm、10—20 cm、20—30 cm土壤TN含量平均值分别为2.314、2.068、2.014 g/kg,表现为随着土层的加深逐渐递减,即表层土壤TN含量最高(图2)。
各降雨处理及其土层深度间,土壤TP含量无差异,3个降雨梯度下土壤TP含量分别为:0.712、0.723、0.714 g/kg(图2)。
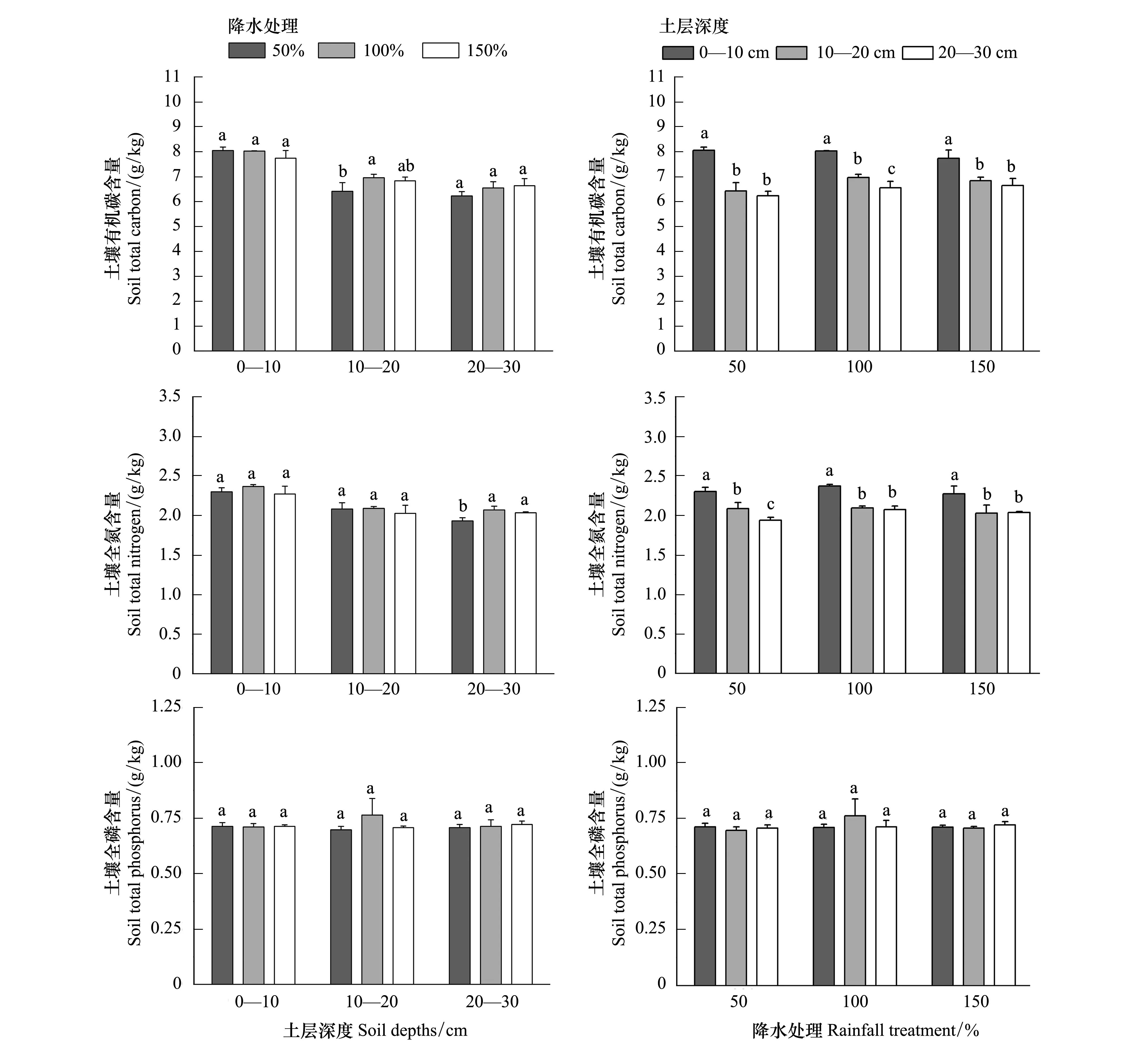
图2 不同降雨梯度土壤碳氮磷含量Fig.2 Soil carbon, nitrogen and phosphorus content under different treatment
2.2 土壤碳氮磷化学计量比变化
在三种降雨梯度下各土层,土壤C/N、C/P、N/P均无显著差异,除了20—30 cm土层,N/P值在100%降雨样地显著高于50%降雨样地(P<0.05)。各水分处理样地C/N 平均值变化范围为3.27—3.35,C/P平均值变化范围为9.77—9.90,N/P平均值变化范围为2.96—3.00。0—30 cm土层C/N、C/P、N/P平均值呈现降雨梯度100% > 50% > 150%的变化趋势(图3)。
同一降水处理不同土层深度下土壤C/N变化规律分析显示,在50%和100%降水处理下,0—10cm土层深度的C/N显著高于10—20 cm和20—30 cm(P<0.05),150%降水处理则无明显差异,在50%、100%、150%降水处理下,土壤各层C/N平均值均呈现0—10 cm > 10—20 cm >20—30 cm的变化趋势(图3)。
同一降水处理下不同土层深度土壤C/P变化,在3个降水处理下,0—10 cm土层深度的C/P显著高于10—20 cm和20—30 cm(P<0.05),10—20 cm土层略高于20—30 cm土层,但变化不显著,C/P平均值范围在50%、100%、150%降水处理下分别为:8.80—11.31、9.19—11.29、9.18—10.86,且各降水处理下土壤各层C/P平均值也呈现出随土层加深而减小的变化规律(图3)。
同一降水处理下不同土层深度土壤N/P变化,50%水分处理各土层间差异显著,表现为0—10 cm > 10—20 cm > 20—30 cm(P<0.05),100%和150%水分处理下0—10 cm土层深度N/P显著高于10—20 cm、20—30 cm(P<0.05),10—20 cm与20—30 cm土层间N/P无明显差异,50%降水各土层N/P平均值分别为3.23、2.99、2.74,N/P随土层加深而减小,表层最高,20—30 cm最低(图3)。
2.3 不同处理对细菌多样性的影响
2.3.1细菌菌群OTUs及多样性分析
所有土壤样品经过16S r DNA 测序共获得3691743 条原始序列,优化后共获得3290324条有效序列,平均优化率为90.66%。为比较样品间的多样性指数,分析时将样品所含序列数进行标准化,在97%相似度水平下,各样品所获得的序列覆盖了土壤中99.94%微生物。同一土层不同水分处理样品在0.03距离下,各Alpha多样性指数均无显著差异,说明不同水分处理对土壤中细菌多样性影响不大(表2)。
同一水分不同土层深度样品在0.03距离下Alpha丰富程度见表3,OTUs(Operational taxonomic units)个数、ACE指数、Chao1指数大小顺序为Y> Z> X,表明10—20 cm土层深度细菌丰度显著高于其他土层(P<0.05);辛普森指数(Simpson)大小顺序为Z> Y> X;0—10 cm、10—20 cm、20—30 cm土层深度香农指数(Shannon)依次为6.325、6.246、6.162,说明表层土壤细菌多样性显著高于其他土层(10—30 cm)(P<0.01)。
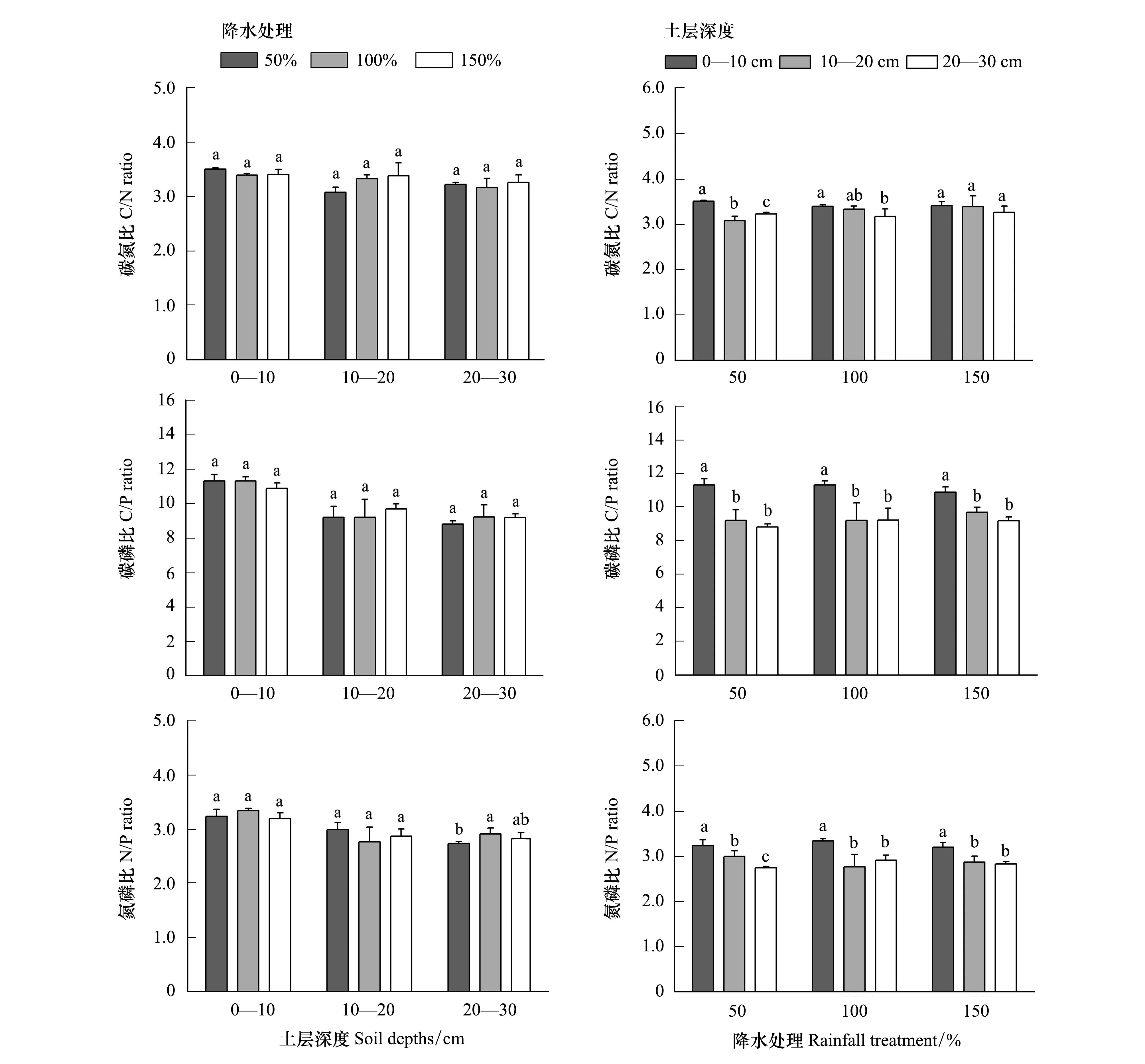
图3 不同处理下土壤化学计量比变化Fig.3 Changes of soil chemical metering ratio under different treatment
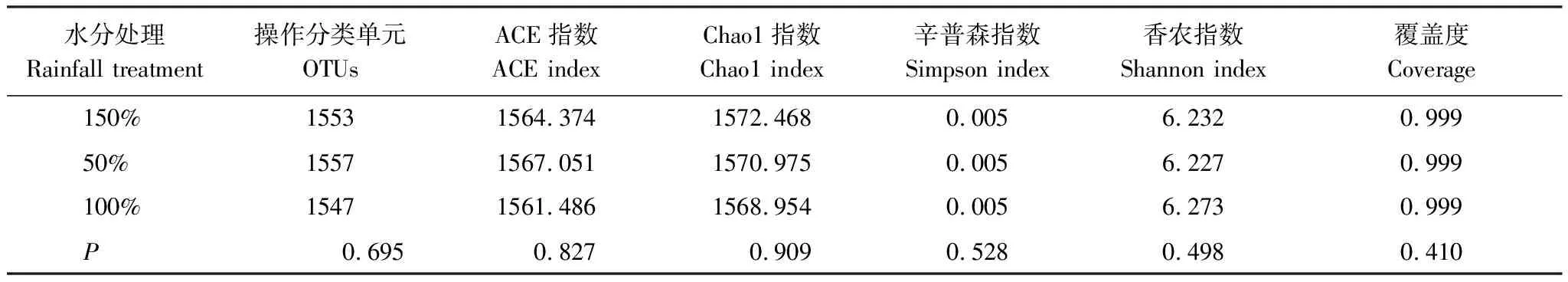
表2 不同水分处理下样品在0.03距离下的Alpha丰富程度表
2.3.2土壤微生物结构差异
基于各处理OTUs维恩图(97%相似性)显示(图4),不同水分处理共有的OTUs数为1588个,不同土层深度共有的OTUs数为1588个,两种处理下单独出现的细菌几乎没有,样品间差异不显著。不同降雨和不同土层深度基于Shannon 指数的细菌系数曲线如图5所示,随测序深度不断加深,曲线逐渐趋于平稳达到平台期,各样品达到饱和状态,说明测序深度能够基本覆盖到样品中的所有物种。
OTUs:操作分类单元 Operational taxonomic units
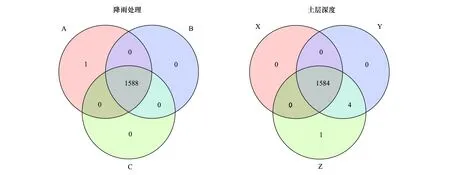
图4 细菌菌群基因OTUs分布Fig.4 Bacterial flora gene outs distribution
图5 细菌菌群基因Shannon指数Fig.5 Bacterial Flora Gene Shannon Index样品对应处理及其编码见表1
2.3.3土壤细菌Beta多样性分析
不同处理下土壤细菌PCoA分析中(图6),两个主成分分别解释变量方差的76.01%(第1主成分)和11.51%(第2主成分),累计贡献率达到87.52%。在不同水分管理下,土壤各样品图上距离近、样品间分布密集且无明显分界,样品间差异不明显,说明土壤细菌对水分处理的响应较小;而在不同土层深度,0—10 cm与10—20 cm、20—30 cm土层深度之间被坐标轴明显分开,0—10 cm位于第一主成分的正端,10—20 cm 、20—30 cm位于第一主成分的负端,反映了表层土壤与10—30 cm深度土壤细菌群落的差异状况,且10—20 cm 和20—30 cm土层深度之间也被明显界线分割(PC1轴数值为-5),说明不同土层深度对土壤细菌群落结构有较大差异,且表层土壤与深层土壤间差异较大。
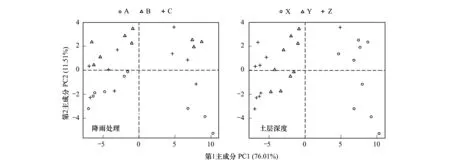
图6 细菌菌群基因Beta多样性Fig.6 Bacterial flora gene Beta diversity
2.3.4细菌群落结构在门水平上的组分分析
图7是细菌群落结构丰度水平前十的物种组分情况,色块长度表示物种所占相对丰度比例,其他物种合并为 Others,Unclassified 代表未得到分类学注释的物种。通过高通量测序检测到的主要门有:放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、匿杆菌门(Latescibacteria)。放线菌门、绿弯菌门、变形菌门、浮霉菌门、酸杆菌门约占所有微生物总数的80—89%以上。
降雨梯度对细菌菌群的影响不大,各菌群基本表现为同步变化趋势;在0—10 cm、10—20 cm、20—30 cm土层深度下,Actinobacteria丰度平均值依次为24.80%、30.47%、31.10%,Gemmatimonadetes丰度平均值依次7.67%、10.92%、11.67%,Chloroflexi丰度平均值依次6.71%、7.23%、8.08%,Actinobacteria、Gemmatimonadetes、Chloroflexi丰度随土层深度加深显著增加(P<0.05);随土层加深Acidobacteria丰度平均值依次为32.85%、27.45%、 25.42%,Proteobacteria丰度平均值分别为18.94%、14.93%、14.56%,Verrucomicrobia丰度平均值依次为2.84%、2.33%、2.23%,丰度随土层加深则表现出逐渐递减的变化趋势(P<0.05)。Actinobacteria、Acidobacteria、Proteobacteria三种细菌在样品群落结构中占有重要组分,约占总数的75.26%,且在不同土层深度下,菌群优势种发生了一定的变化。
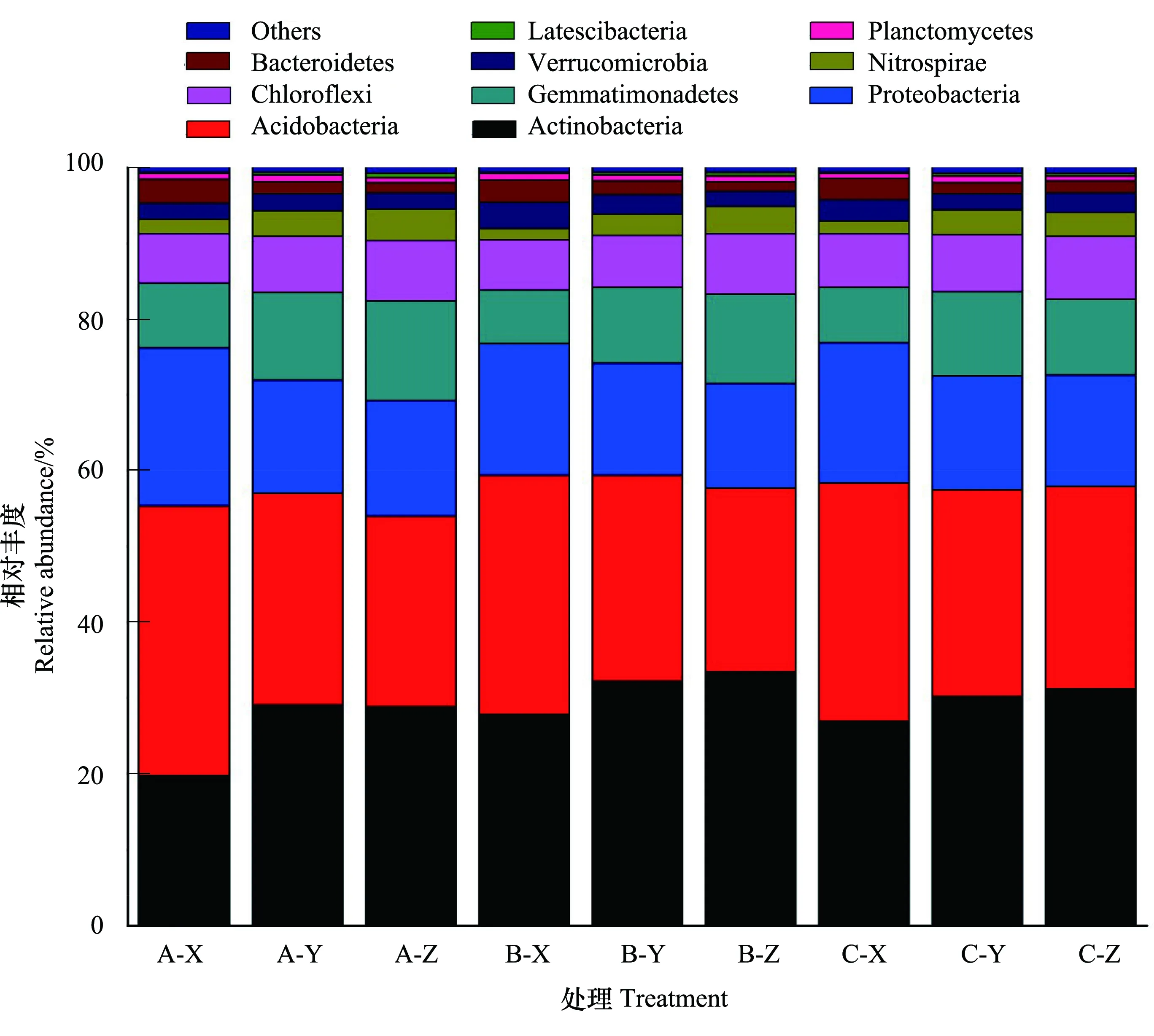
图7 不同处理门水平上的细菌菌群结构Fig.7 Bacterial flora structure at different treatment gate levelsOthers:其他物种合并为Others; Latescibacteria: Latescibacteria门(待鉴定菌); Planctomycetes: 浮霉菌门; Bacteroidetes: 拟杆菌门; Verrucomicrobia: 疣微菌门; Nitrospirae: 硝化螺旋菌门; Chloroflexi: 绿弯菌门; Gemmatimonadetes: 芽单胞菌门; Proteobacteria: 变形菌门; Acidobacteria: 酸杆菌门; Actinobacteria: 放线菌门
2.4 不同处理对真菌多样性的影响
2.4.1真菌菌群OTUs及多样性分析
真菌经过18S r DNA或ITS区测序共获得1952744条原始序列,优化后共获得1861685条有效序列,平均优化率为95.26%。为比较样品间的多样性指数,分析时将样品所含序列数进行标准化,在97%相似度水平下,各样品所获得的序列覆盖了土壤中99.93%微生物。如表4所示,同一土层不同降雨处理样品在0.03距离下,各Alpha多样性指数同细菌一样,均无显著差异,说明不同水分处理对土壤微生物多样性影响不显著。但OTUs、Chao1指数、ACE指数和Shannon指数都表现为A > B > C,说明增减雨能够增加土壤中真菌多样性。
表5为同一降雨下不同土层深度样品在0.03距离下Alpha丰富程度表,ACE指数、Chao1指数大小顺序为X >Y > Z,表明0—10 cm土层深度真菌多样性与其他土层相比差异显著(P<0.05);Shannon指数大小顺序与ACE指数、Chao1指数具有一致性;Simpson指数大小顺序为Z > Y > X;Shannon指数值越大,Simpson指数值越小,说明样品的物种多样性越高,即表层土壤真菌多样性最高,10—20 cm次之,20—30 cm最低。
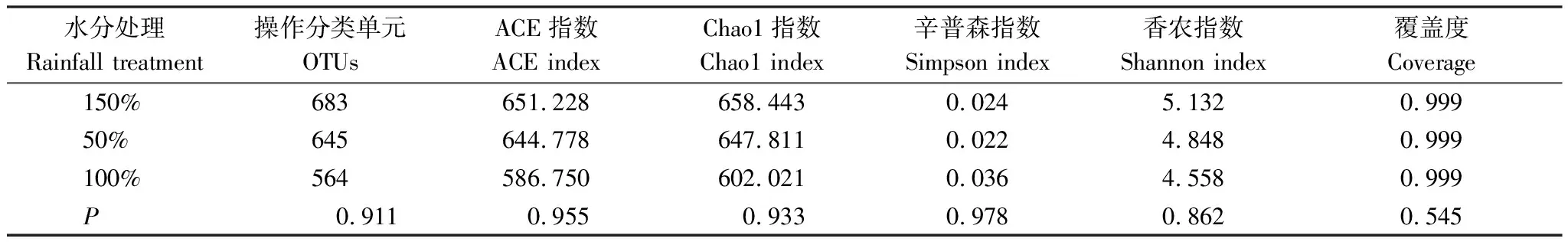
表4 不同水分处理下样品在0.03距离的Alpha丰富程度表
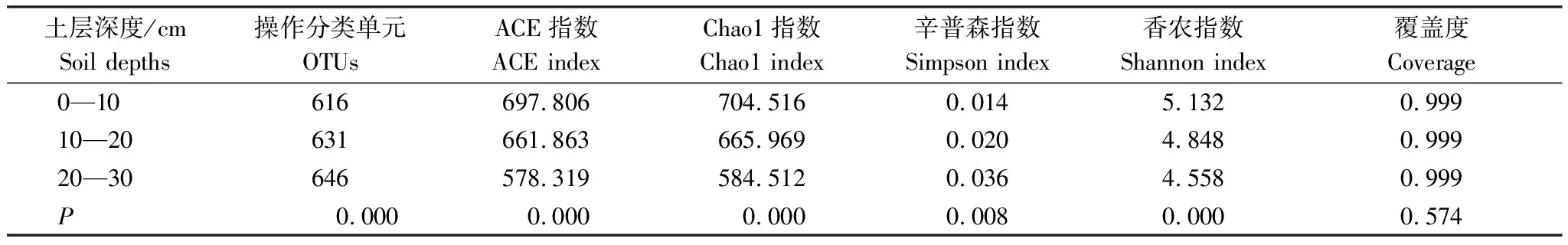
表5 不同土层深度处理下样品在0.03距离的Alpha丰富程度表
2.4.2土壤微生物结构差异
基于各处理OTUs的维恩图(97%相似性)显示(图8),3种水分管理共有的OTUs数为915个,占所有OTUs的31.02%,且A(150%)和B(50%)单独出现的OTUs的数量相等,C(100%)单独出现的 OTUs 数量为29,明显多于増雨和减雨处理样地;3个不同土层深度下共有OTUs数为914个,占所有OTUs数的30.67%,X、Y、Z单独出现的OTUs数量分别为9个、2个、5个。
不同水分和不同土层深度处理下基于Shannon 指数的真菌系数曲线(图9)可以看出,随测序深度不断加深,曲线逐渐趋于平稳达到平台期,各样品达到饱和状态,说明测序深度能够基本覆盖到样品中的所有物种。
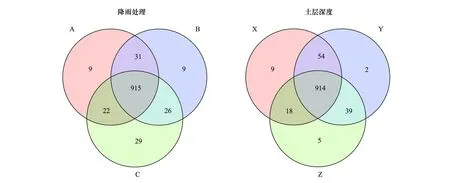
图8 真菌菌群基因OUTs分布Fig.8 Gene outs distribution of fungal flora
图9 真菌菌群基因Shannon指数Fig.9 Fungal Flora Gene Shannon Index
2.4.3土壤真菌Beta多样性分析
对土壤真菌进行PCoA分析可看出(图10),与土壤真菌群落有关的第1主成分解释变量方差的37.25%,第2主成分解释变量方差的8.75%。不同水分处理下,各样品混杂图中,没有明确的界线分开,说明了水分处理对真菌多样性影响小;但在不同土层深度间有显著界线分割,对第1主成分起主要作用的0—10 cm土壤位于PC1轴的正端,其数值大于20,10—20 cm 、20—30 cm处于PC1轴的负端,反映了0—10 cm土壤与10—30 cm深度土壤真菌群落有显著差异,且10—20 cm 和20—30 cm土层深度之间也被显著分割开,表明不同土层深度下土壤真菌的群落结构存在显著差异。
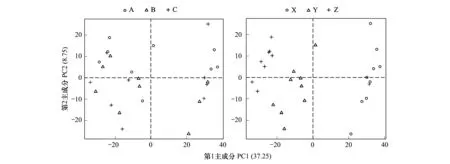
图10 真菌菌群基因Beta多样性Fig.10 Fungal flora gene beta diversity
2.4.4真菌群落结构在门水平的结构分析
真菌群落结构在门水平的相对丰度比例分析见图11,图中只显示了丰度水平较高的物种,Unclassified代表未得到分类学注释的物种。通过高通量测序检测到的主要门有:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉菌(Mortierellomycota)、球囊菌门(Glomeromycota)、梳霉亚门(Kickxellomycota)、壶菌门(Chytridiomycota)、毛霉亚门(Mucoromycota)、丝足虫类(Cercozoa)。子囊菌门、担子菌门是土壤中占主导地位的真菌,约占到了所有真菌总数的80%—93%以上[33]。
在门水平下,同一水分管理对真菌菌群结构无显著影响(P<0.05),Ascomycota在150%、50%、100%水分下丰度平均值分别为48.67%、48.25%、47.35%,占所有真菌群落的48.09%,丰度最高,其次为Basidiomycota,占14.25%。
在0—10 cm、10—20 cm、20—30 cm土层深度下,Ascomycota为主要优势种,其丰度平均值依次为43.79%、48.80%、51.68%,即随土层加深丰度增高,Kickxellomycota和Chytridiomycota变化规律与之相同;Basidiomycota丰度平均值依次为14.50%、12.25%、16.01%,表现为20—30 cm 深层土壤丰度最高;Mortierellomycota、Glomeromycota的丰度比例X >Z >Y,则表层土壤的丰度达到最高,因此不同的真菌类型在不同土层深度下表现出不同的变化规律。
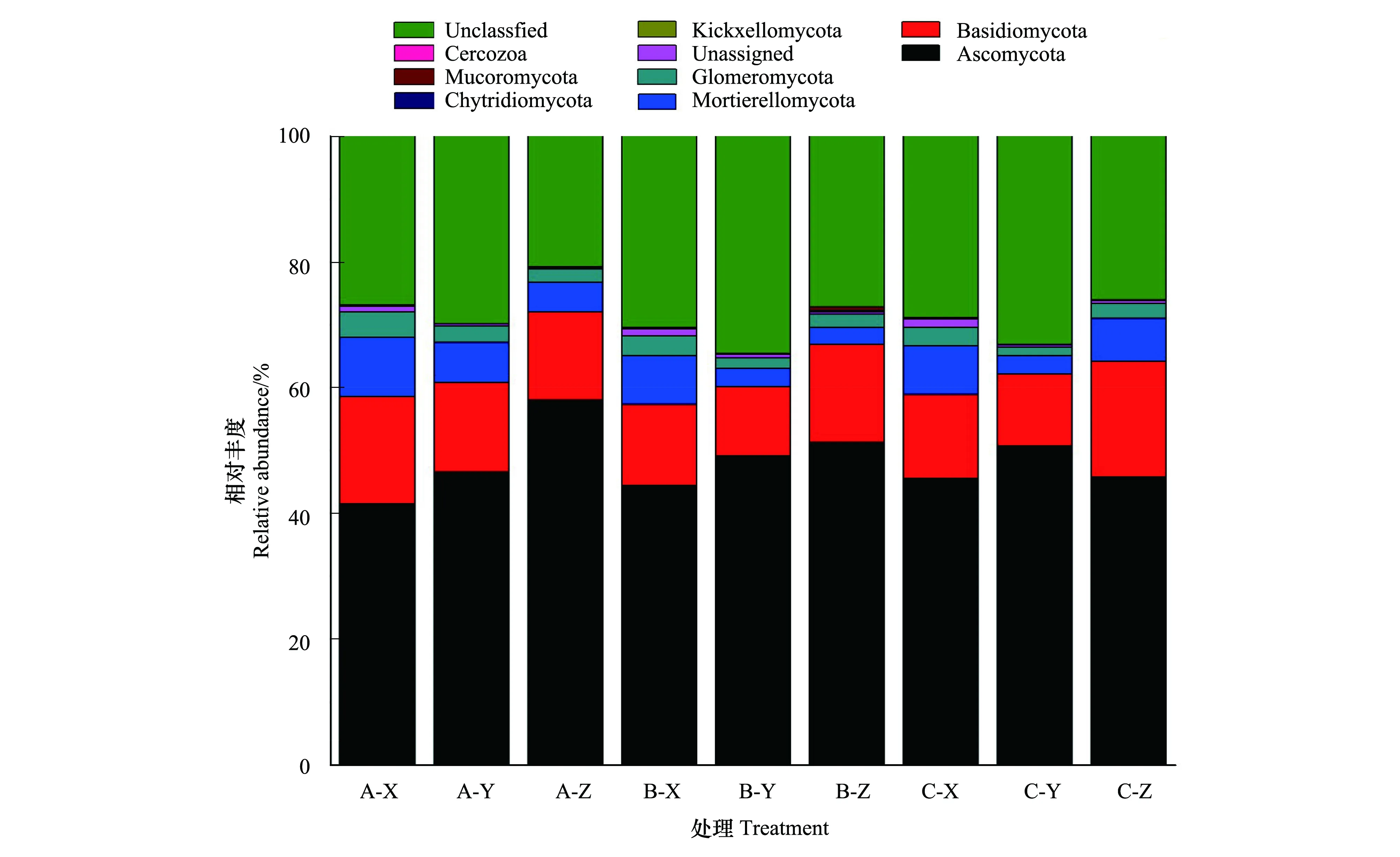
图11 不同处理门水平上的真菌菌群结构Fig.11 Fungal flora structure at different treatment gate levelsUnclassified:未得到分类学注释的物种;Cercozoa:丝足虫类;Mucoromycota:毛霉亚门; Chytridiomycota:壶菌门;Kickxellomycota:梳霉亚门;Unassigned:未定义的菌群;Glomeromycota:球囊菌门;Mortierellomycota:被孢霉菌;Basidiomycota:担子菌门;Ascomycota:子囊菌门
2.5 土壤碳氮磷与土壤微生物的相关性分析
由表6可以看出,在不同水分处理下土壤TN和SOC之间存在极显著正相关关系(P<0.01),土壤C/N和C/P之间、C/P和N/P之间存在极显著正相关关系(P<0.01),C/P、N/P与细菌之间存在显著负相关关系(P<0.05),而与真菌之间存在极显著正相关关系(P<0.01),土壤TN、SOC、TP含量与细菌、真菌之间无相关性。
在不同土层深度(表7),土壤TN、SOC、TP三者之间无相关性,全氮与C/P、N/P之间极显著正相关(P<0.01),SOC与C/N之间存在极显著正相关(P<0.01),TP与N/P为显著负相关(P<0.05),C/N与C/P之间、C/P与 N/P之间存在极显著正相关(P<0.01),SOC、TP、C/N与细菌、真菌之间无相关性,TN、C/P、N/P与细菌为显著负相关(P<0.05),与真菌之间存在极显著正相关关系(P<0.01)。
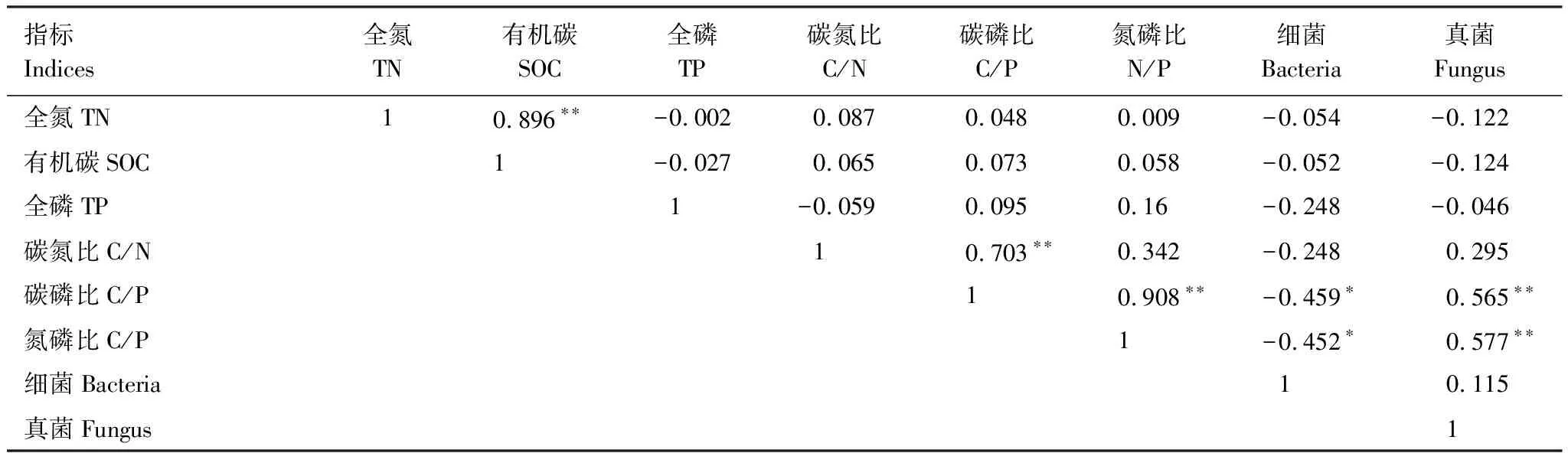
表6 不同水分处理土壤碳氮磷与土壤微生物的相关性分析
3 讨论
3.1 不同降水处理对土壤SOC、TN、TP含量及其化学计量比的影响
本试验结果表明:同一土层土壤在50%、100%、150%降雨处理下,土壤SOC、TN、TP、C/N、C/P、N/P均无显著变化,但在正常降水处理下,其平均值均高于増雨和减雨处理。姚庭玉等人在对南亚热带季风气候区常绿阔叶林土壤的研究结果也得出相似的显著分析[34],可能原因是短期(1年)降水差异对土壤化学计量的影响相对较为微弱,试验区蒸发量远高于降雨,降雨梯度对植被及土壤养分影响未达到显著差异。相反,刘海威研究表明[11],土壤碳随着降水量增加呈波动变化趋势,降水量持续两年增加80%,对草本叶片碳、钾和根系碳、氮影响达到显著性水平,对土壤碳有极显著性影响,短期减少降水对土壤化学养分的积累更为有利[34]。
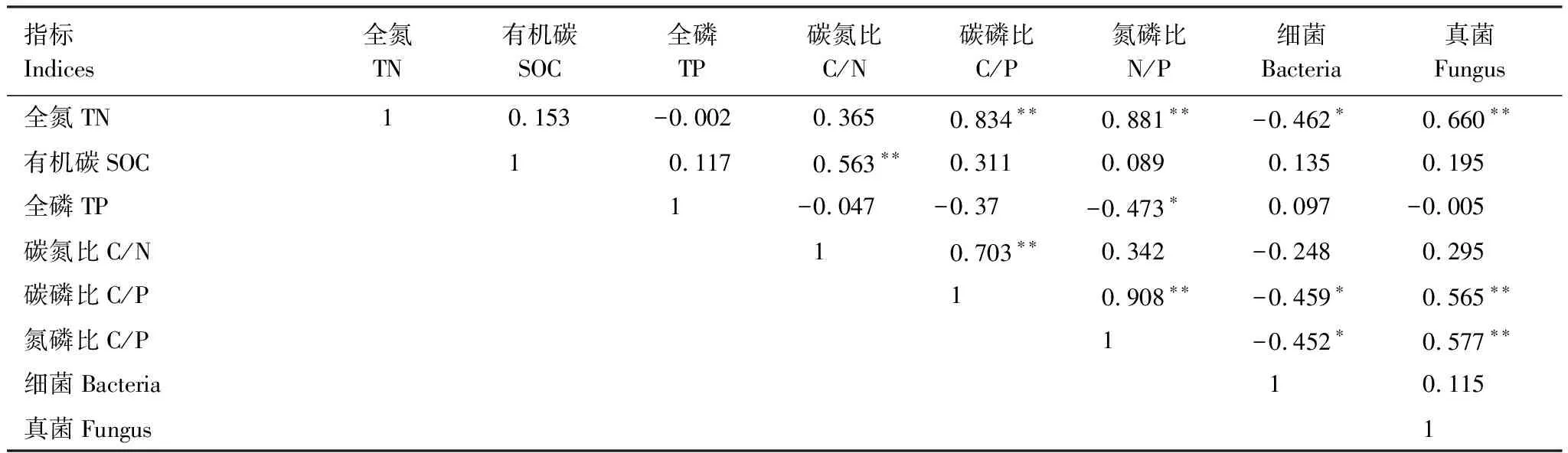
表7 不同土层深度处理下土壤碳氮磷与土壤微生物的相关性分析
在0—30 cm土层深度下土壤SOC、TN含量有显著差异, 表层土壤含量高于底层,有“表聚”现象,土壤TP含量垂直差异不显著[35],这是由于土壤碳、氮、磷的来源不同所造成的,碳、氮主要是来源于地表植物的枯枝落叶、动物和微生物残体在分解和转化过程中逐渐聚集而后向下迁移积累,因此表层含量高于深层,磷主要是在成土母质漫长的风化沉积过程中形成的,变化缓慢且差异较小[36-38]。在化学计量比方面,不同土层深度土壤C/N、C/P、N/P差异显著,且均在表层土壤中含量最高,钟春柳等人也得出了相似的结论[39]。C/N是反映土壤有机质分解速度的指标之一,其比值与土壤有机质的分解速度成反比,土壤C/P能够反映出土壤中磷的有效性,土壤N/P可以衡量土壤养分在植物生长过程中的供应情况[40],随着土层深度的加深,土壤SOC、TN含量减少,TP含量变化微弱,因此C/P、N/P也具有相同的变化趋势,且N/P与TP有显著负相关关系、而与TN有极显著正相关关系,SOC与C/N具有极显著正相关关系,因此其变化符合生态化学计量特征。
3.2 不同降水处理对土壤微生物多样性的影响
本研究中细菌OTUs 显著高于真菌OTUs,这与前人研究结果一致[41-42]。此外,不同水分处理对土壤中细菌多样性的影响不大;但増雨和减雨处理都会增大真菌均匀度指数和丰富度指数,降水变化还使土壤微生物的菌群结构组分比例发生相应的变化[43],优势种所占的比例降低,这与王楠楠等人的结论相一致[44]。其原因可能是真菌对降水处理的响应与细菌相比更为敏感,在不同的降水处理下,土壤中的微生物能够使菌群结构发生改变以应对外界环境的变化,且0—30 cm土层深度相对较浅,细菌局部生存环境相对稳定,地表腐殖质层和根际有机物都能够产生大量有机质,适宜多种细菌的繁衍和生存。在同一降水处理不同土层深度下,土壤微生物多样性与土层的深度之间呈负相关关系,菌群结构也发生了变化。在现有的研究结论中,土层深度与微生物多样性呈负相关[45]和先降低后升高等[46]关系,其原因可能是试验区地处干旱半干旱地区,表层土壤中植被覆盖度较高,有机质含量、土壤水分等相对于深层土壤较高,微生物活性高,物种多样性也最高。
3.3 化学计量与微生物多样性的相关性分析
土壤微生物是陆地生态系统中土壤有机质分解、转化的主要组分,土壤微生物为了满足自身生存、发育、繁衍增殖而从土壤中获取化学能量和营养物质[47],而研究表明土壤碳氮磷及其化学计量比能够很好地反映能量和养分的含量[48]。本试验土壤SOC、TP、C/N与微生物多样性无关,C/P、N/P与细菌多样性呈显著负相关关系,与真菌多样性呈极显著正相关关系,这一结论与黄菊莹等人[49]研究结果相似。在降水处理下,増雨和减雨均未使土壤碳、氮、磷发生显著的变化,可能是短期控雨条件下研究区草地生态系统相对稳定,土壤碳、氮、磷化学计量也处于相对稳定状态,且气候条件、地形地貌条件等是土壤养分来源以及含量高低的决定性因素,微生物仅起到推动作用[50],这也可能是土壤碳、氮、磷与微生物多样性之间无显著相关性的原因之一。土壤C/P、N/P作为反映土壤质量和养分的重要指标,能够很好的指示土壤对微生物新陈代谢和发育繁衍所需要养分的供应情况,这也说明了微生物对土壤养分有较高的依赖性[49]。
4 结论
模拟降雨对黄土高原典型草原土壤生态化学计量及微生物多样性的研究表明:短期(一年)不同降雨处理下土壤SOC、TN、TP及微生物多样性无显著性变化;同一降水处理,表层土壤养分含量显著高于深层土壤,且不同土层间微生物多样性差异明显;微生物多样性与土壤养分关系密切,土壤C/P、N/P均与微生物多样性呈显著性相关,研究结果为模拟长期降雨处理下草地生态系统土壤养分和微生物变化提供参考。

