杆菌七肽抗菌谱和溶血性的研究
张 江,李火明,蔡文通,周晓容
(1.安杰利(重庆)生物科技有限公司,重庆402460;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨 150069;3.重庆市畜牧科学院,重庆402460)
在饲料中应用抗生素可明显提高动物生长性能、降低死亡率,提高生产效益,但也存在一定弊端和潜在危害,如降低动物免疫力、增加细菌耐药性以及影响食品安全。根据农业农村部公告第194 号,自2020 年1 月1日起,除中药外的所有促生长类药物饲料添加剂禁止使用,标志着饲用抗生素作为促生长剂将停止在饲料中使用,因此抗菌肽、微生物制剂、植物提取物以及酸化剂等抗生素替代品逐渐受到关注而成为研究热点。抗菌肽(Antimicrobial Peptides,AMP)是生物体产生的一种与宿主防御相关的具有先天性免疫作用的小分子活性多肽。抗菌肽的主要作用机理是破坏微生物的细胞膜而使细菌裂解死亡,其抑菌杀菌机理区别于传统的抗生素,故不易产生耐药性[1-2]。大量试验研究结果显示,抗菌肽(如肠杆菌肽、天蚕素等)可替代抗生素在畜禽饲料上使用,能明显降低动物腹泻和提高生产性能[3-5]。杆菌七肽(又名腺苷七肽,Microcin 七肽)是20 世纪90 年末发现的肠杆菌属(Enterobacter)、乳杆菌属(Lactobacillus)等微生物分泌的小分子抗菌肽,其能抑制多种微生物,包括大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella)、肺炎克雷伯菌(Klebsiella pneumoniae)等革兰氏阴性细菌和部分革兰氏阳性细菌[6-7]。杆菌七肽包含7 个氨基酸残基(序列为MATGNAD),其C 端氨基酸残基的羧基与单磷酸腺苷(AMP)的磷酸键通过共价键结合形成核酸肽;其主要通过破坏细胞膜结构和干扰微生物蛋白翻译过程实现抑菌作用[8-9]。杆菌七肽可以通过微生物发酵和化学合成法生成,是一种潜在的抗生素替代品,但在国内产业化研究刚起步[10]。本研究采用不同动物来源的病原菌和益生菌作为指示菌,研究杆菌七肽的抗菌谱以及溶血性,为饲用抗生素替代品的研发和体外评估提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌制剂与样品 各菌株、来源及培养条件见表1。杆菌七肽产品中杆菌七肽含量为10%,载体为玉米芯粉和麦芽糊精,由安杰利(重庆)生物科技有限公司提供。
1.1.2 主要试剂和仪器 MH(A)、MH(B)、营养肉汤、营养琼脂、MRS 肉汤、MRS 琼脂、BHI、BHI(A)、TCBS 琼脂、YPD、TSA 等微生物培养基购自北京奥博星生物。小鼠红细胞(南京森贝伽生物科技有限公司),胃蛋白酶(MERCK)、胰蛋白酶(MERCK)。超净工作台(苏州净化设备有限公司)、灭菌锅(日立(中国)有限公司)、培养箱(苏州培英实验设备有限公司)、厌氧罐(包括厌氧产期袋)(日本三菱化学株式会社)、摇床(苏州培英实验设备有限公司)等。
1.2 试剂配制及样品处理
1.2.1 试剂的配制 培养基的配制按照各培养基标签要求进行称取和配制。人工胃液按照《中华人民共和国药典》(2015 年版Ⅳ部)配制:取稀盐酸16.4 mL,加水约800 mL 与胃蛋白酶10 g,摇匀后,加水稀释成1 000 mL[12]。人工肠液按照《中华人民共和国药典》(2015 年版Ⅳ部)配制:取磷酸二氢钾6.8 g,加水500 mL 使溶解,用0.1 mol/L 氢氧化钠溶液调节pH 至6.8;另取胰酶10 g,加水适量使溶解,将两液混合后,加水稀释至1 000 mL[12]。
1.2.2 指示菌菌悬液的准备 细菌复苏:各指示菌菌种均平板划线培养20 h(布氏杆菌培养5 d);挑取单菌落相应的增菌培养基,继续培养12~14 h(布氏杆菌培养3 d),待用。指示菌稀释:用生理盐水将菌液稀释至OD600吸光值为0.1(细菌约108CFU/mL,酵母菌约106CFU/mL),备用。
1.2.3 待测样品处理 先配制抗菌肽产品原液,称取1.28 g样品定容于10 mL 容量瓶中,制成128 000 μg/mL 的样品液,震荡混合均匀,超声波处理10 min。吸取适量上述溶液于具塞灭菌离心管中,5 000 r/min 离心2 min,取上清液于0.45 μm 滤膜过滤,取过滤液,将前面过滤的1 mL 左右液体弃去,收集后面过滤的液体,然后用无菌水进行倍比梯度稀释,其杆菌七肽浓度为6 400、3 200、1 600、800、400、200、100、50、25 μg/mL。
1.3 抑菌试验 ①于超净工作台内,向每个灭菌培养皿中倾注10 mL 的高压灭菌过的水琼脂(1.2%~1.5%琼脂)进行铺底,每个培养皿厚度均一,待水琼脂冷却凝固后,将灭菌后的牛津杯(7.9 mm)置于琼脂之上,每个平皿可等距离放置3~7 个牛津杯。②吸取150 μL 指示菌菌液(1.2.2 准备的菌悬液)加入到恒温至(50±5)℃的相应的琼脂培养基中,轻轻摇匀,避免起泡,此时菌在培养基的含量为106CFU/mL。 ③将上述加过菌液的琼脂培养基倒入放有牛津杯的凝固的琼脂培养皿中,每个平皿倒15~20 mL,待其冷却凝固。用镊子取出牛津杯,吸取150 μL 的待检样品注入到相应的孔内,设立灭菌水为空白对照,同时在培养皿上做好标记,将培养皿放入2~8℃冰箱内放置1~2 h 进行样品的扩散。④将培养皿移入37℃培养箱培养8~10 h 后(布氏杆菌培养时间约为5 d),观察平板中的抑菌圈直径,并用直尺或游标卡尺进行测量抑菌圈直径,同时用无菌水作为对照。布氏杆菌在中国农业科学院哈尔滨兽医研究所P3 实验室操作,其他病原菌在P2 及实验室操作。
1.4 温度对杆菌七肽抗菌活性的影响 取抗菌肽样品12.8 g,定溶于100 mL 去离子水,分成4 份为1~4 号样,每份25 mL,1~3 号样分别与 70、80、90℃水浴处理 10 min,4 号样为对照室温放置。以大肠杆菌CGMCC44102 为指示菌进行抑菌试验,抑菌试验同1.3。每个试验2 个重复。
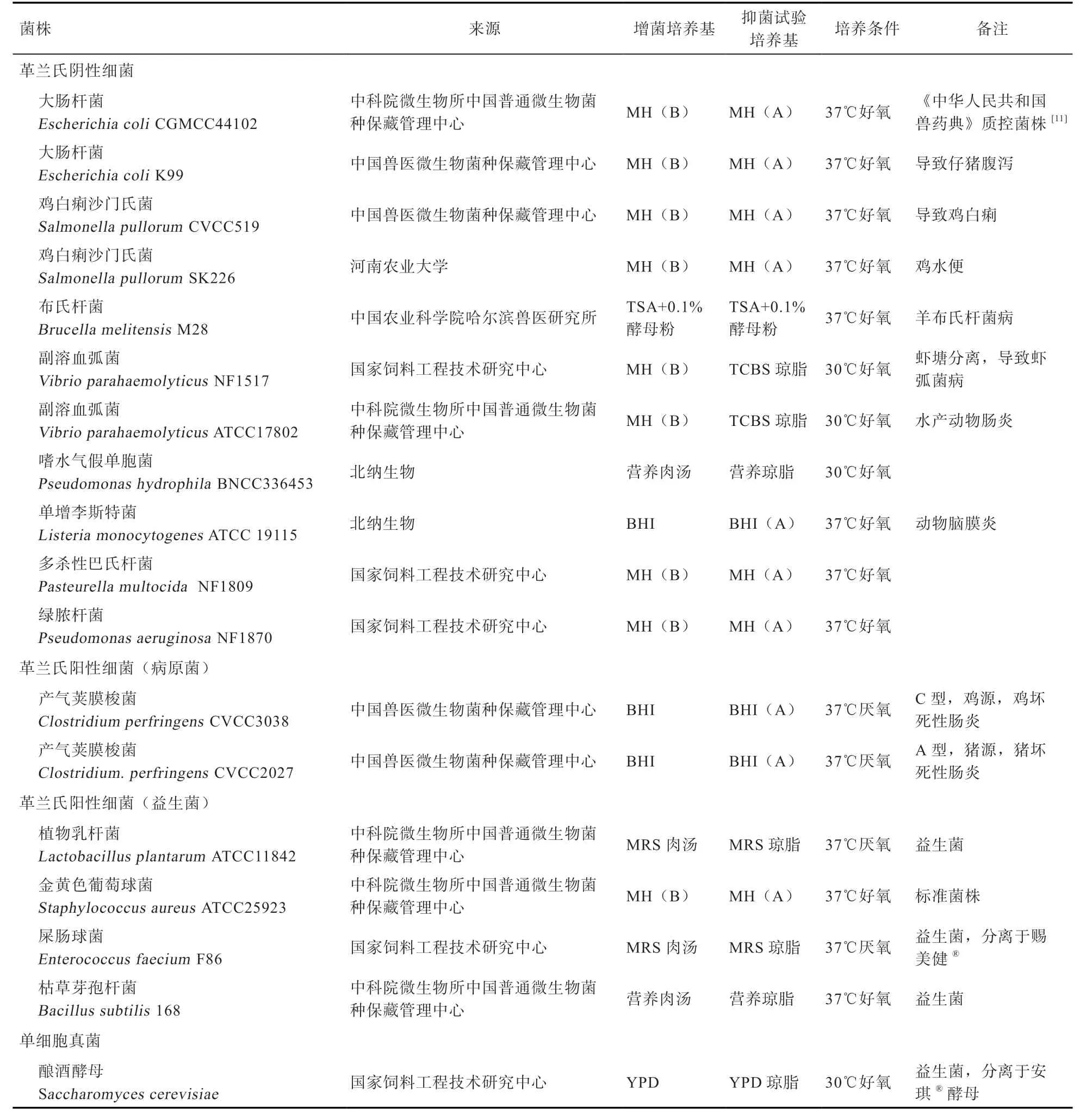
表1 菌株来源及培养条件
1.5 体外消化对杆菌七肽抗菌活性的影响 取抗菌肽样品1.28 g,定溶于10 mL 人工胃液中,开始计时,分别在30、60、120 min 不同时间点取样加NaOH 中和pH为7,85℃处理5 min 灭活蛋白酶,然后梯度稀释,以CGMCC44102 指示菌进行抑菌试验,抑菌试验同1.3。每个试验2 个重复。
取抗菌肽样品1.28 g,定溶于10 mL 人工肠液中,开始计时,分别在30、60、120 min 不同时间点,85 ℃处理5 min 灭活蛋白酶然后梯度稀释,以CGMCC44102 指示菌进行抑菌试验,抑菌试验同1.3。每个试验2 个重复。
1.6 溶血性试验 试验方法参考[13]:用PBS 调整小鼠红细胞浓度为1%;在试管中用PBS 将杆菌七肽产品浓度调整为 2 000、1 000、500、250 μg/mL,加入等体积的红细胞悬液,则浓度为1 000、500、250、125 μg/mL(对应杆菌七肽为 100、50、25、12.5 μg/mL),以 PBS为阴性对照,以1% Tritonx-100 为阳性对照,37℃感作1 h,观察试管浑浊度;1 000×g 离心5 min;将上清液依次加入96 孔板,测定OD540值。溶血率=(检测孔OD540-阴性孔OD540)/(阳性孔OD540-阴性孔OD540)×100%。
1.7 统计分析 抑菌圈直径、溶血率采用Excel 表格进行统计计算平均值±标准差表示。
2 结 果
2.1 杆菌七肽对不同微生物的抑制作用 通过对18 株不同微生物(10 株革兰氏阴性菌,7 株革兰氏阳性菌,1 株真菌)的抑制作用(表2)发现,杆菌七肽对10 株革兰氏阴性菌都有抑制作用,如大肠杆菌、沙门氏菌、巴氏杆菌、绿脓杆菌、副溶血弧菌、嗜水气假单胞菌以及布氏杆菌,而只对2 株革兰氏阳性菌具有抑制作用,即产期荚膜梭菌(又名魏氏梭菌)。同时发现,杆菌七肽对同种菌不同株或不同血清型的抑制效果也不尽相同,抗菌肽稀释到50 μg/mL 对大肠杆菌和沙门氏菌有一定的抑制作用。抗菌肽稀释到50 μg/mL 对副溶血弧菌NF1517 仍然有抑制作用,而抗菌肽稀释到800 μg/mL 对副溶血弧菌ATCC17802 的抑菌圈消失,没有抑制作用。杆菌七肽稀释到50 μg/mL 对产气荚膜梭菌CVCC3038仍然有抑菌圈,而杆菌七肽释到200 μg/mL 对产气荚膜梭菌CVCC2027 没有发现抑菌作用。同时,在本试验条件下,杆菌七肽对李斯特菌、金黄色葡萄球菌、植物乳杆菌、屎肠球菌、枯草芽孢杆菌和酿酒酵母菌均没有抑制作用。
2.2 温度对杆菌七肽抑菌活性的影响 由表3 可见,不同温度(70、80、90℃)处理抗菌肽10 min 后稀释成不同浓度,与对照(室温放置)比较,杆菌七肽抑菌圈的直径没有发生明显变化。
2.3 人工胃液、肠液对杆菌七肽抑菌活性的影响 由表4 可见,用人工肠液处理抗菌肽后稀释成不同浓度,与未处理比较,60 min 之前,其抑菌圈直径未发生明显变化,90 min 时,抑菌圈减少0.5~1 mm,说明其抗菌肽活性稍微下降。表5 显示,人工胃液处理抗菌肽后,稀释成不同浓度与对照(0 min)比较,30 min 时其抑菌圈直径轻微减小,但随后(30~90 min)其抑菌圈的直径没有明显变化,说明抗菌肽活性没发生明显变化。2.4 杆菌七肽溶血性试验 如表6 所示,不同浓度(12.5~100 μg/mL)杆菌七肽产品处理红细胞,其溶血率均小于5%。
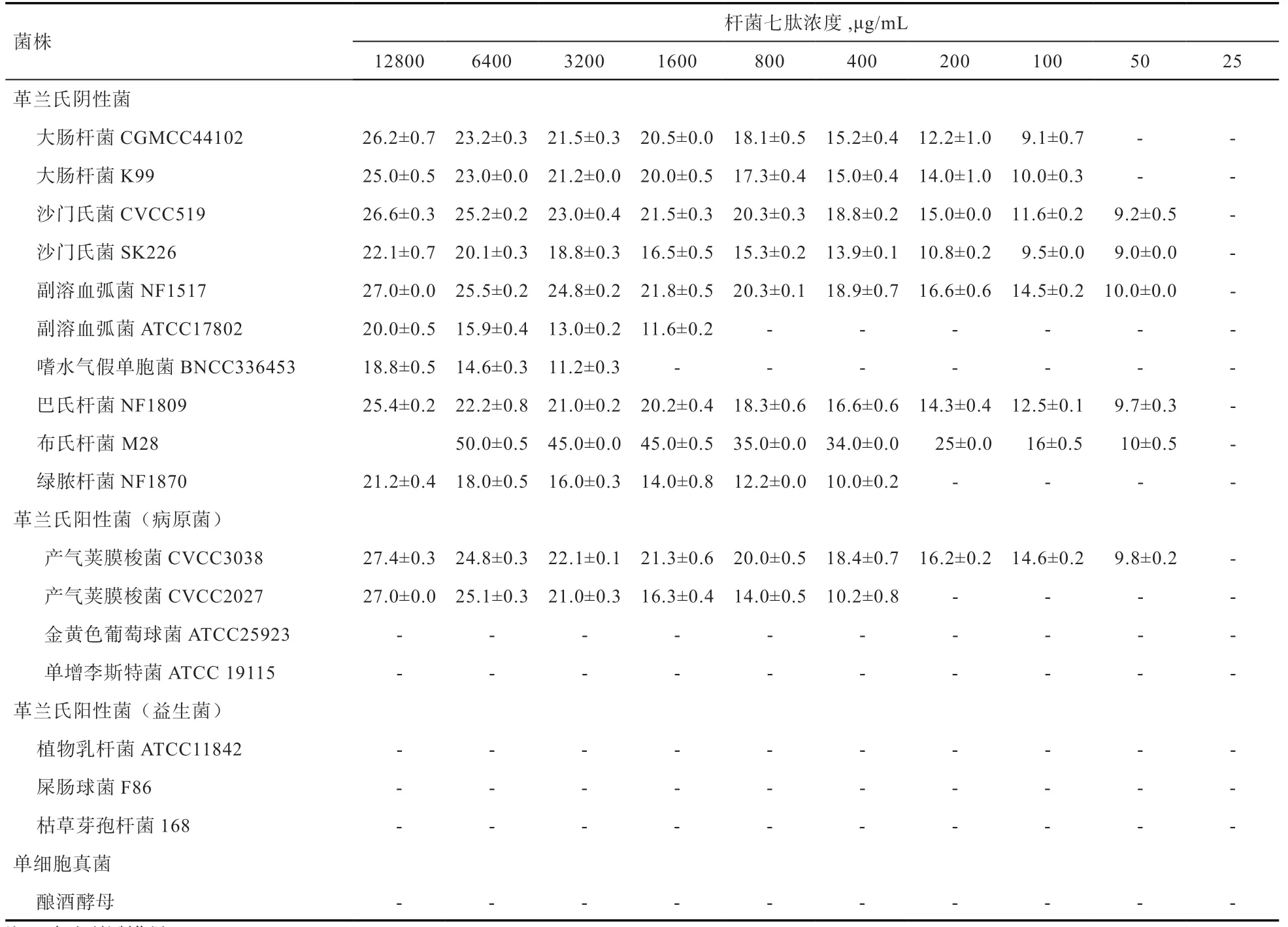
表2 杆菌七肽对不同菌株的抑菌效果(抑菌圈直径) mm
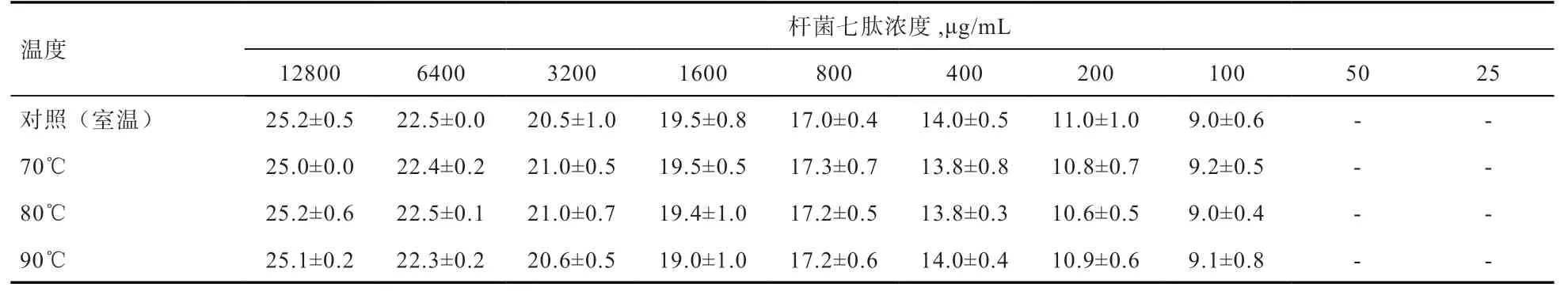
表3 不同温度处理抗菌肽后的抑菌效果(抑菌圈直径) mm
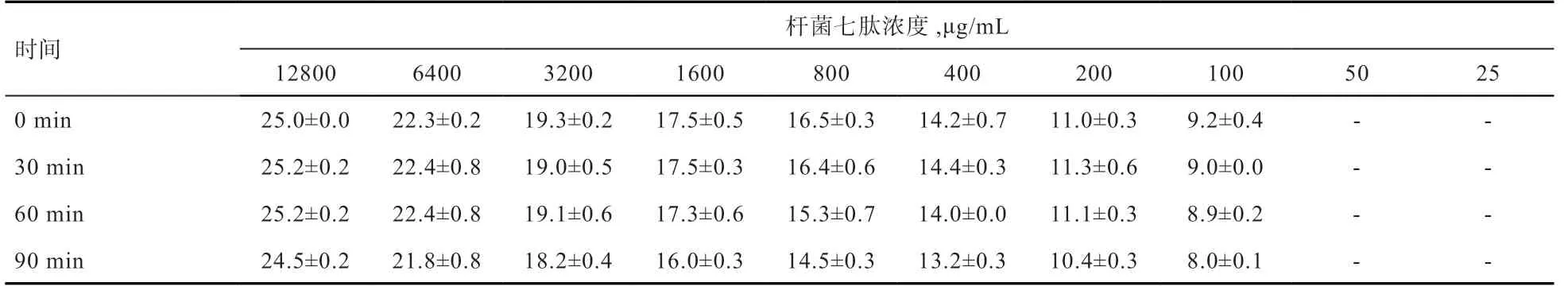
表4 人工肠液处理抗菌肽后的抑菌效果(抑菌圈直径) mm

表5 人工胃液处理抗菌肽后的抑菌效果(抑菌圈直径) mm

表6 不同浓度抗菌肽产品对红细胞溶血率 %
3 讨 论
抑制肠道有害微生物生长被认为是饲用抗生素促进动物生长的重要作用机理之一,故对病原菌的抑制效果可作为饲用抗生素替代品的研究和评价的重要指标[11]。管碟法能够直观看到抗菌药物对指示菌的抑菌作用所形成的抑菌圈,因此被广泛应用在抗菌谱和抗菌活性测定的实验中,该方法简单、快捷、成为抗菌物质评价的重要方法[12]。对于同种抗菌剂,药物浓度(或效价)与抑菌圈面积呈正比或直径(diameter)的平方(D2)呈正比[13-15],故抑菌圈直径是评价指示菌对抗菌剂的敏感程度的重要指标。抗菌谱是抗菌剂所能抑制和杀灭微生物的属和种的集合,是抗菌肽的重要特性[16]。通过抑菌试验发现,杆菌七肽对受试的10 株革兰氏阴性细菌都有抑菌作用,而只对7 株中的2 株革兰氏阳性细菌有抑制作用,对革兰氏阳性益生菌植物乳杆菌、屎肠球菌、枯草芽孢杆菌也没有抑制作用,说明杆菌七肽的抗菌谱主要为革兰氏阴性细菌。
高温制粒是饲料常用的加工方式,其可以减少饲料中的病原微生物、减少动物采食过程中的浪费、提高饲料消化率。本试验通过高温水浴处理模拟饲料高温过程,发现杆菌七肽对大肠杆菌的抑制效果没有发生变化,这表明杆菌七肽对于高温具有很好的稳定性,其活性可以耐受饲料的高温制粒过程。抗菌肽通过口服形式饲喂动物后在肠道起作用,必须具备耐受胃肠道的各种苛刻条件,而通过人工模拟肠胃液来体外评价是一种快速有效的方式。通过人工肠液和胃液处理杆菌七肽发现,杆菌七肽对大肠杆菌的抑菌圈直径基本不受影响或影响很小,说明杆菌七肽在体外人工胃液和肠液中活性稳定。溶血现象是指红细胞被破坏后血红蛋白被释放出来,其反映了某种物质对红细胞细胞膜有破坏作用,从而反映了药物的安全性。一些抗菌肽对动物细胞存在溶血性而无法临床应用[17-18],故溶血性是评价抗菌肽安全性的重要指标,溶血性通过测定溶血率来评价,溶血率小于5%,就认为测试药物没有溶血性[18]。本研究通过溶血性试验发现,不同浓度的杆菌七肽对红细胞溶血率均小于5%,说明其红细胞溶血率低,具有较好的安全性。以上结果表明,杆菌七肽对细菌具有明显的抑制作用,其稳定性和安全性较高,体外试验的抑制效果能否在体内肠道中体现,同时能否在生产中实现其促进生长的作用,需要通过动物饲喂试验和对生产性能、肠道微生物以及其免疫指标的测定而得出替代某种或者某类饲用抗生素的结论。
4 结 论
本研究结果表明,杆菌七肽是一种抗菌谱主要为革兰氏阴性细菌的抗菌肽,对蛋白酶和热处理具有很好的耐受性,红细胞溶血率低,具有良好的开发应用前景,能否有效替代饲用抗生素,需要体外试验进一步研究,而具体的替代饲用抗生素可行性和方案,有待于结合动物试验进一步验证。

