赖氨酸影响犊牛生长性能及其机制的研究进展
孔凡林,刁其玉,屠 焰
(中国农业科学院饲料研究所,反刍动物及其幼畜营养代谢中美联合研究中心,奶牛营养学北京市重点实验室,北京 100081)
犊牛通常是指从出生到6 月龄的牛,以是否饲喂液体饲粮为节点又可以分为从出生到2 月龄左右的断奶前犊牛和3~6 月龄的断奶后犊牛。犊牛在出生后消化系统发育不成熟,免疫系统功能不完善,极易受到外界环境的影响和刺激[1]。因此,犊牛阶段的氨基酸供给需要根据生理结构的变化进行给予。赖氨酸(Lys)被称为“生长氨基酸”,已经被证明是猪[2]、鼠[3]、熊猫[4]和断奶前犊牛[5]等动物的第一或第二限制性氨基酸,也通常作为哺乳动物生长阶段的第一限制性氨基酸。近10 年随着生物质谱技术和组学技术的升级,研究人员陆续在模型动物上发现Lys 参与多种蛋白质翻译后修饰和多条代谢通路,间接揭示了Lys 参与癌症[6]、抑郁症[7]和先天性疾病[8]等重大疾病的作用机理,更针对性地发明多种蛋白质修饰抑制剂或促进剂以治愈疾病。与此相比,近年来在犊牛阶段的Lys 营养调控研究却多集中在探究Lys 不同水平或与其他氨基酸配比对犊牛生长发育和表观性状的影响上[5,9],其对犊牛生长性能、营养物质代谢和作为原料参与蛋白质合成的研究相对丰富,有充分的研究说明Lys 对犊牛生长发育和氮代谢存在影响,但在此基础上的机理研究十分匮乏。因此,本文基于其他模型动物和犊牛上已有的研究报道,结合犊牛自身的生理特点,对Lys 参与蛋白质合成或作为营养信号调控代谢通路的研究进展进行综述,以期为犊牛上Lys 的研究提供思路。
1 犊牛的生理特点
生长发育迅速、初乳提供的免疫因子消耗后自身免疫力降低、消化系统发生巨变是犊牛的三大生理特点。首先,犊牛阶段生长发育迅速,出生时日增重(ADG)约为0.37 kg,生长至6 月龄时ADG 已达到1.09 kg[10]。Soberon 等[11]研究证明,在商业模式下犊牛的ADG 每增加1 kg,奶牛第一泌乳期的奶产量便会增加1 113 kg以上。因此,做好犊牛阶段的氨基酸营养调控对提高养殖效益有着重要作用。其次,犊牛出生后免疫系统在组织结构和功能上尚不成熟。研究发现犊牛在90 日龄之前始终缺乏成年牛的免疫稳定性[12]。另外,犊牛与单胃幼龄动物消化方式的不同在于断奶前后由皱胃单一消化模式过渡到以瘤胃为主的复胃混合消化模式。研究发现犊牛出生时瘤胃在牛胃中的重量占比仅为34%,皱胃占比高达56%,随着犊牛采食开食料至断奶,犊牛断奶时瘤胃在复胃中的重量占比提升到66%[13],重量上与成年牛相当,微生物发酵功能也已经成熟。
基于犊牛阶段机体敏感、变化剧烈和具有潜力效应等生理特点,该阶段饲料营养的供给应与之快速匹配以保证健康生长,尤其是对限制性氨基酸等必需营养因子的供给应做到精准饲喂。
2 Lys 对犊牛生长性能的影响
近年来,关于不同Lys 水平对犊牛生长性能的影响见表1。由于各个试验的试验设置不同,所以统一换算成试验组相对于对照组添加或扣除Lys 对犊牛ADG 的影响。由表1 可知,由于犊牛出生后饲喂液体饲粮,断奶前Lys 在饲粮中添加比例高于断奶后。其中,Silva等[16]除每天在饲粮中添加17 g 赖氨酸盐外还额外添加了 5.3 g 蛋氨酸(Met)、0.672 g 谷氨酸和 0.672 g 谷氨酰胺,基于理想蛋白质的氨基酸平衡原理可以解释ADG 的显著增加。此外,云强等[15]的研究中Lys 与Met 比值相对较小,Lys 相对需要量的减少可能是因为过瘤胃赖氨酸(Rumen Protective Lysine,RP-Lys)的使用,相比于赖氨酸盐酸盐,RP-Lys 因减少Lys 在瘤胃中微生物发酵的损失而使得利用率增高,这也提示过瘤胃氨基酸在断奶后犊牛阶段的应用潜力巨大。
相比于生长性能上的改变,Lys 作为限制性氨基酸最直接的影响是犊牛的氮代谢过程。由表1 可以看出,氮代谢率的变化与ADG 的变化极为相似,尽管Silva等[16]的研究中并未进行氮代谢试验,Gami 等[17]在体重为143.66 kg 摩拉水牛犊牛的饲粮中同样额外添加17 g/d的RP-Lys,使氮利用率提高21.33%,水牛摄入含粗蛋白质120 g/kg 的饲粮并额外添加17 g/d 的RP-Lys 可获得与含粗蛋白质140 g/kg 的饲粮相似的氮沉积。这种通过低蛋白饲粮中添加Lys 以替代高蛋白饲粮的技术一方面可减少蛋白质饲料的利用,另一方面可提高氮的利用率,减少氮排放。Batista 等[18]在体重为165 kg 的荷斯坦公犊牛瘘管中梯度添加赖氨酸盐,结果显示氮代谢率随Lys 的添加而线性增加,同时血清中亮氨酸、缬氨酸、色氨酸和酪氨酸浓度随Lys 添加而线性降低,这说明添加Lys 增加了犊牛氨基酸沉积,但当灌注量超过9 g/d 时氮代谢率进入平台期。
综上分析,目前关于犊牛阶段Lys 需要量的研究中对象主要为荷斯坦犊牛;主要添加方式为断奶前犊牛添加L-Lys 与断奶后犊牛添加RP-Lys;研究方法以剂量效应法为主,仅Wang 等[5]使用优化的氨基酸扣除法。尽管关于犊牛阶段Lys 需要量的研究已经较为丰富,但还需大量研究补充犊牛在不同生产因素下的Lys 需要量以及Lys 调控犊牛生长发育的内在机理;此外,研究方法的陈旧也需得到升级,仅以剂量效应法很难同时对多种氨基酸适宜添加量进行研究。
3 Lys 参与功能物质合成
3.1 白蛋白 血清球蛋白(Globulin,Glo)在无免疫刺激时水平的提高被认为是免疫力提高,而白蛋白(Albumin,Alb)因为具有维持血浆渗透压的功能,所以对Glo 起着保护作用,可以间接提升免疫力。同时,由于Alb 半衰期长达14~20 d,所以血清Alb 水平常作为长期氨基酸营养不良的标志。张乃锋等[19]研究表明,在犊牛代乳品中补饲Lys 和Met 少量提升了血清中总蛋白含量;Shailesh 等[20]使用每天加入2 g 过瘤胃蛋氨酸(Rumen Protective Methionine,RP-Met) 和 17 g RP-Lys的代乳品饲喂犊牛同样使得血清中Alb 和Glo 含量少量增加。以上研究说明,Lys 和Met 对犊牛血清中的Glo和Alb 含量有提升作用。可能的原因是饲粮中Lys 的波动会引起肝脏中Lys 水平的增减,而肝脏作为合成血清Alb 的唯一器官,合成原料的增加可能使血清中Alb 含量增加。
3.2 肉碱 犊牛时期需严格控制脂肪沉积以防止脂肪堆积引起的乳房发育迟缓和妊娠综合征。L- 肉碱(L-Carnitine,L-CN)是一种类氨基酸,由Lys 和Met参与合成。L-CN 可将脂肪酸由胞质转移至线粒体参与β-氧化,Lys 在肉碱合成中的通路如图1 所示。近期的研究发现,给断奶后公犊牛每天补饲4 g 的L-CN 可降低血浆中甘油三酯含量,同时皮下脂肪和背脂厚度也降低,说明L-CN 可促进犊牛的脂质分解[22],但机理尚不清楚。随后在围产期奶牛上的一系列研究阐述了其中机理。有研究发现,围产期奶牛L-CN 的合成基因ALDH9A1、TMLHE、L-CN 及摄入相关基因SLC22A5相比干奶期奶牛表达量显著上调,且肝脏脂肪堆积得到缓解[23]。此外,对围产期奶牛提供过瘤胃肉碱或皱胃注射L-CN发现肝脏脂肪酸氧化能力提升,证明L-CN 促进犊牛脂质分解的机理在于促进肝脏中脂肪酸的氧化。供应L-CN除影响脂代谢外还可降低犊牛血清中尿素氮含量和增加总蛋白含量[24],Pas 等[25]在放牧犊牛补饲液体L-CN的研究中也同样发现氮平衡得到改善,可能原因是L-CN添加通过节省用于合成L-CN 的Lys 和Met 来提高体内蛋白质的周转。
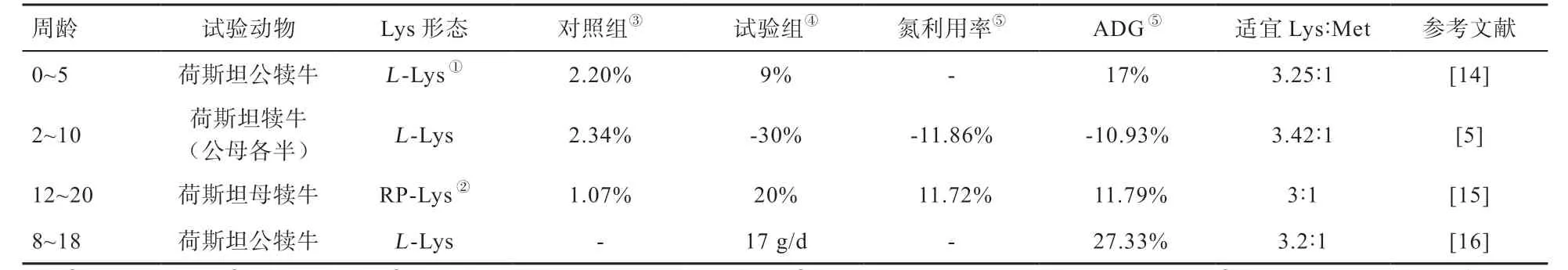
表1 Lys 水平对犊牛ADG 的影响
最新研究发现,L-CN 在促进脂肪酸氧化的过程中受到过氧化物酶体增殖物激活受体α(Peroxisome Proliferators-Activated Receptorsα,PPARα)的调控。在Rosenbaum 等[26]对奶牛肉碱相关基因的研究中发现,PPARα调控的脂肪酸代谢基因(FABP4、SLC25A20、ACOX1、CYP4A24)随L-CN 相关基因的表达而变化,在鼠、人和猪上的研究也同样发现L-CN 的合成受PPARα的调控[27]。PPARα作为由配体激活的核转录因子可与基因上游的一段DNA 片段结合从而调控基因表达。Song 等[28]研究发现,PPARα促进L-CN 合成量增加的原因与肉毒碱棕榈酰转移酶1A(Recombinant Carnitine Palmitoyltransferase-1A,CPT-1A) 的 增 加有关,当PPARα与过氧化物酶体增殖物激活受体共激活因子通过不同区域同时作用到CPT-1A基因时可促进CPT-1A 表达,但该结论仅在奶牛围产期阶段而未在犊牛阶段得到验证。

图1 Lys 参与肉碱形成[21]
3.3 胶原蛋白 胶原蛋白(Collagen,COL)是天然纤维蛋白,是动物结缔组织的主要组成部分,COL 作为机体分布最广的功能性蛋白占蛋白质总量30% 以上。有研究发现,秦川公犊牛在生长阶段牛肉嫩度随COL含量的增加而增加[29]。除参与犊牛阶段肉质的形成外,COL 在新生犊牛骨骼发育中也具有十分重要的作用。研究发现,与饲喂优质初乳的新生犊牛相比,饲喂不良初乳的犊牛血浆中骨代谢标志物降低,其中包括COL[30]。COL 中3 条链上的Lys 缩合形成的羟醛赖氨酰吡啶链(Hydroxylysylpyr- Idinoline,HP)数量的降低可能是牛肉嫩度降低和骨骼发育迟缓的原因[31]。尽管COL 的特性氨基酸为脯氨酸,但近年来的研究发现Lys 在其结构稳定性上发挥着重要作用,COL 含有由3 条多肽链构成的3 股螺旋体结构,螺旋区段最大的特点是氨基酸呈现Gly-X-Y 的周期性排列。Kitamura等[32]的研究中使用Ac-(Pro-Hyp-Gly)5-Pro-Lys-Gly-(Pro-Hyp-Gly)5-Ala-NH2的氨基酸排列替代原本的排列方式Ac-(Pro-Hyp-Gly)11-Ala-NH2,结果发现 3 股螺旋体结构经Lys 替代后热稳定性提高,证明Lys 在COL 构成中的重要作用。但目前还缺乏Lys 合成COL通路的研究,并且Lys 通过COL 调控犊牛,尤其是新生犊牛骨骼以及肌肉合成的研究相对较少,难以揭示其内在机制。
3.4 与精氨酸合成蛋白质 犊牛肺炎严重威胁着犊牛的存活率。犊牛肺炎可由牛传染性鼻气管炎(Infectious Bovine Rhinotracheitis,IBR)继发引起,IBR 是由牛疱疹病毒-1 型引起的一种急性接触性传染病。Maggs等[33]通过体外试验发现Lys 可以抑制疱疹病毒的复制增殖。Kate 等[34]以荷斯坦犊牛为试验动物,对照组和试验组犊牛在接种呼吸道病毒疫苗的基础上分别在代乳品中每天添加17 g 酪蛋白和17 gL-Lys,结果显示2 组犊牛接种疫苗后的体温和IBR 抗体效价均没有显著差异,但添加L-Lys 提高了血清中Lys 与精氨酸(Arg)的比例,可能的原因是Lys 增加后与Arg 共同合成体蛋白。此外,Arg 被证明参与疱疹病毒的复制过程[35],结合二者的试验结果说明,Lys 能够通过与疱疹病毒争夺Arg 来减小疱疹病毒相关疾病的发病率和抑制病情,并且Lys 在治疗猫传染性支气管炎上已经取得了良好效果[36]。
综上,Lys 参与犊牛体内多种功能物质的合成过程,各功能物质在犊牛体内的重要性和占比大多排在前列,分别维持着犊牛的免疫、脂质代谢和机体结构的完整性等功能。但Lys 作为多种动物、多个阶段的第一限制性氨基酸,广泛参与体内多种蛋白质的合成,所以在此基础上的研究仍需进行。
4 Lys 参与信号通路调控
由于犊牛并非稳定的模型动物,目前关于Lys 对犊牛上信号通路的研究还十分匮乏。但是,为方便后续研究的开展,将借助牛的其他生长阶段或哺乳动物上关于Lys 参与调控信号通路的研究,结合犊牛自身的生理特点,对Lys 可能调控的通路和机理进行总结。
4.1 mTOR 通路 哺乳动物雷帕霉素靶蛋白(Mammalian Target of Rapamycin,mTOR)是一种非典型丝氨酸-苏氨酸蛋白激酶,在进化上相对保守,可整合营养、能量及生长因子等多种细胞外信号,在细胞生长和凋亡中发挥重要作用。近年来在犊牛上的研究发现,氨基酸是调控mTOR 通路的重要信号因子,其在通路中的角色并非作为原料参与蛋白质合成而是作为营养信号调控mTOR 通路以控制多种蛋白质的合成,包括α-淀粉酶[37]、胰蛋白酶和脂肪酶等[38]。以小鼠为对象的研究发现额外口服Lys 使得骨骼肌3- 甲基组氨酸释放量减少,mTOR、核糖体S6 激酶1(Ribosome Protein Subunit 6 Kinase 1,S6K1)和真核转录起始因子4E 结合蛋白1(eIF4 E-Bind-ing Protein 1,4EBP1)的磷酸化水平没有变化,而自噬相关蛋白(LC3- Ⅱ)的减少说明Lys 通过抑制蛋白质分解来提高肌肉中蛋白质的沉积[39],随后的研究得到了相似的结果,但唯一不同的是mTOR 通路被激活[40],说明mTOR 通路可能与抑制蛋白自噬-溶酶体体系协同促进蛋白质沉积有关,但当mTOR 活性被雷帕霉素(Rapamycin,RAP)抑制时,蛋白质自噬效果仍存在,说明除mTOR 外的其他通路(如蛋白激酶B 等)调控因子也参与蛋白质沉积[41]。在犊牛上的研究同样发现扣除初乳中部分氨基酸使得骨骼肌中的mTOR、S6K1表达量下降,蛋白质沉积率降低,但4EBP1的表达不受影响;该研究还发现犊牛不同肌肉部位的蛋白质沉积存在特异性,其中快速型肌肉(如背最长肌和半腱肌)对营养物质的敏感性较强,而咬肌等慢速型肌肉则相对不敏感[42]。另外的研究使用患有孤独症谱系障碍(Autistic Spectrum Disorder,ASD)的小鼠为模型动物,分别饲喂高水平Lys 饲粮和正常水平Lys 饲粮,结果发现高水平Lys 摄入逆转ASD 小鼠的行为障碍并抑制前额页皮质和躯体感觉皮质中mTOR活动[43],这可能与通常认为的Lys 可以促进动物采食有关,但与犊牛骨骼肌上发现的Lys 激活mTOR 通路结果相反;在肠道上的研究发现Lys 缺乏对mTOR 通路磷酸化水平没有影响,而显著上调了氨基酸转运体的表达并激活AMP 依赖的蛋白激酶通路(AMPK),说明Lys 可特异性激活肌肉中的mTOR 通路而非肠道,但可通过提高肠道氨基酸转运增加氨基酸摄入[44]。以上研究均说明Lys 调控mTOR 通路存在组织特异性,但最终均指向调控机体适应Lys 的缺乏,包括增加氮沉积和肠道氨基酸吸收,通过大脑感觉神经减少Lys 缺乏饲粮的摄入等。
最新的研究证明,Lys 除作为信号因子参与mTOR通路外还可以作为蛋白翻译修饰位点参与蛋白合成。赖氨酸去甲基化酶4A(Lysine-specific Demethylase 4A,KDM4A)是近年发现的作用于Jmjc 结构域并去甲基化 H3K9me3、H3K36me3、H4K26me3 的 Lys 去 甲 基化酶。Capucine 等[45]研究发现,KDM4A 缺失可通过增强雷帕霉素的敏感性和改变启动子的释放来改变翻译起始因子的分布并最终抑制蛋白质的合成;另外的研究发现结节性硬化复合物2(Tuberous Sclerosis Complex 2,TSC2)中的 Lys 可被 Lys 去乙酰化酶(Sirtuin1,SIRT1)作用,去乙酰化后的TSC2 泛素化并随后被泛素系统降解,进而刺激mTOR 复合物1 的相关通路[46],这为临床通过mTOR 抑制剂治疗癌症提供了思路。Lys在mTOR 通路中的营养因子作用和作为酰化位点参与蛋白自噬和合成的途径汇总如图2 所示。
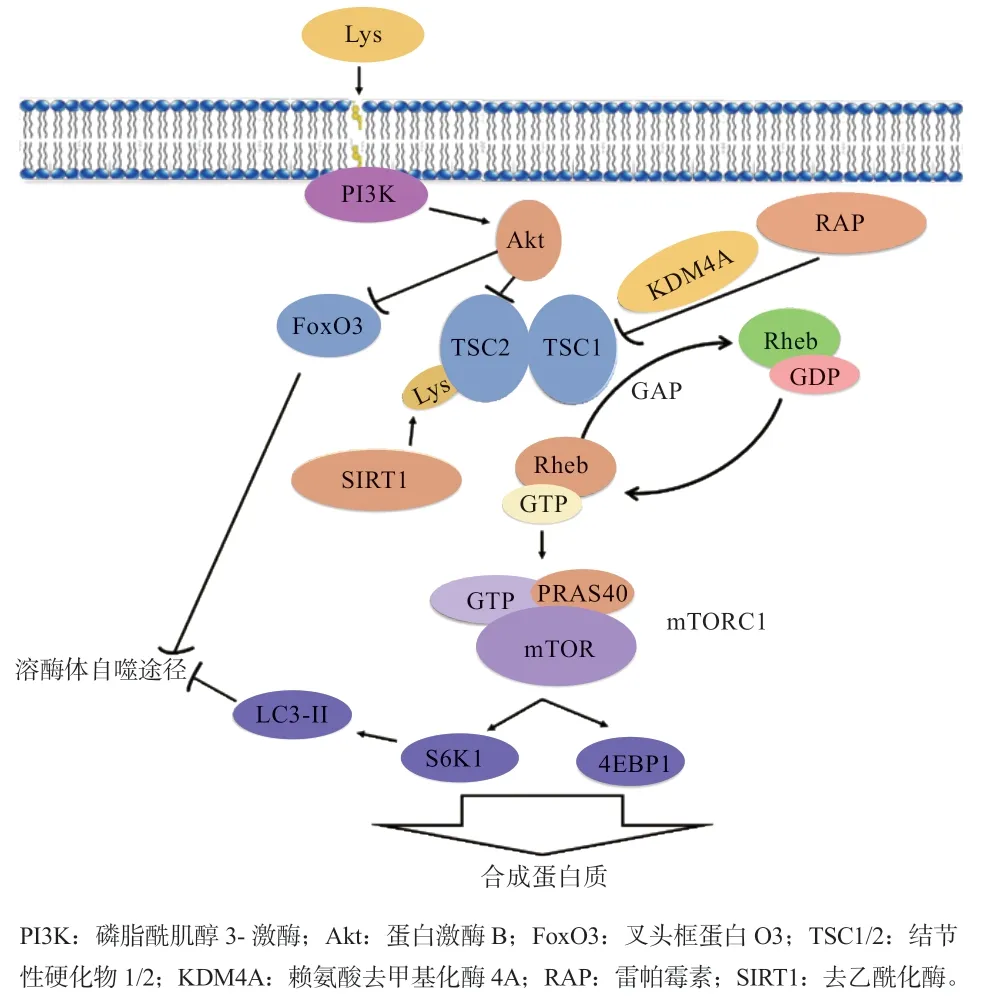
图2 mTOR 通路中Lys 促进蛋白质合成和分解的作用途径[40-42,45-46]
4.2 Janus 激酶信号转导与转录激活子 Janus 激酶信号转导与转录激活子(Janus Kinase-signal Transducers and Activators of Transcription,JAK-STAT)是很多细胞因子和生长因子在细胞内传递信号的共同途径,介导细胞增殖、分化、迁移和凋亡等生物学反应,犊牛阶段快速的细胞增殖和分化使得该通路在犊牛阶段具有重要作用。李喜艳[47]使用不同浓度Lys 的培养基培养荷斯坦奶牛乳腺上皮细胞,拟合出了随Lys 浓度变化的酪蛋白合成量变化曲线,结果显示Lys 浓度为1.2 mmol/L时酪蛋白合成量最大,同时与乳蛋白表达相关的JAK2-STAT5 信号通路的STAT5、JAK2、ELF5表达量均显著上调,证明Lys 可通过JAK-STAT 通路影响酪蛋白合成。更进一步的研究发现Lys 与Met 在上调蛋白合成基因上具有协同作用。王芳[48]使用Lys 和Met 绝对添加量为1.2 mmol/L 和0.4 mmol/L(平衡组)或1.4 mmol/L和0.6 mmol/L(不平衡组)的培养基对奶牛乳腺上皮细胞进行培养,结果显示与不平衡组相比,平衡组STAT5、JAK2、ELF5以及mTOR均显著上调,说明Lys 和Met 之间具有协同性和平衡性,这需要在生产中使用氨基酸添加剂时考虑到这一点。此外,四甲基偶氮唑盐微量酶反应比色法测定细胞增殖情况的结果同样显示平衡组细胞增长率显著高于不平衡组,但对作用通路未做研究[48]。这一方面可能与mTOR 和JAKSTAT 通路的激活有关,另一方面,STAT5 与STAT3 具有相同的细胞受体,STAT5表达的升高预测STAT3也可能共表达升高,而STAT3 在被组氨酸转乙酰酶p300-CREB 结合蛋白(histone acetyltransferase p300-CREB-binding protein,p300-CBP)乙酰化修饰后可激活目的基因,这些基因翻译合成包括参与了细胞生长和存活的细胞周期素D1、凋亡抑制因子(bcl-xL)以及癌基因(c-myc)[49]。Lys 除了通过 JAK-STAT 通路影响细胞生长外也参与免疫功能的构建。最新的研究表明,嗜酸性粒细胞分化、激活所依赖的白细胞介素5(Interleukin 5,IL-5)以及其受体(Interleukin 5 Receptor,IL-5R)受Lys 的调控,当IL-5 与IL-5R 在细胞膜上结合形成共同链后,该链尾部的泛素化并被蛋白酶降解可激活EOS,而由该链上Lys457、Lys461 以及Lys467 组成的蔟是泛素化所必需的,该蔟的存在保证了JAK1/2 与膜受体的结合并维持信号传导[50]。以上关于Lys 通过调控JAK-STAT 通路维持细胞增殖以及维持免疫功能稳定的研究均大多来自于泌乳牛,但相比于泌乳牛,犊牛阶段更需要维持免疫功能的稳定和持续、细胞的快速增殖,所以还需对犊牛阶段Lys 调控JAK-STAT 通路的机制进行验证和拓展。
4.3 有丝分裂元激活的蛋白激酶 有丝分裂元激活的蛋白激酶(Mitogen-activated Protein Kinase,MAPK)是一组在真核生物中非常保守的丝氨酸-苏氨酸蛋白激酶,在生长、细胞分化和细胞运动等许多细胞活动中起作用。陆黎敏[51]通过基因沉寂和过表达技术,减少或增加MAPK1、eEF1B的表达水平后检测STAT5的表达,结果显示MAPK1、eEF1B 介导mTOR 信号通路,从而影响STAT5的表达,进而调节蛋白合成,随后的Lys 处理组也显示SKIV2L2、MAPK1的mRNA 表达量增加,说明Lys 可通过MPKA 与生长通路联合作用调节蛋白质合成。
5 小 结
目前关于犊牛阶段Lys 的需要量在断奶前阶段有详细的结果借鉴,但经历断奶应激后的断奶后阶段还缺乏研究。并且,目前研究氨基酸需要量(包括Lys)的方法还不成熟,无法做到同时对多种氨基酸进行定量研究。由于犊牛并非稳定的模型动物,目前关于Lys 在分子层面的作用机理研究仍十分落后。一方面表现在犊牛缺乏细胞培养试验,难以对饲养试验的结果进行验证;另一方面,Lys 调控mTOR 通路的研究相对较多,但其他多条明星通路上的研究还处于初级阶段甚至没有研究,研究范围狭窄,未来研究潜力巨大。

