东方百合‘索邦’组蛋白去乙酰化酶基因 LoSorHDA1的克隆与表达分析
蒙 娟,杨 捷,彭梦笛,贾桂霞,何恒斌
(花卉种质创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,城乡生态环境北京实验室,教育部林木花卉育种实验室,北京林业大学 园林学院,北京100083)
乙酰化是最早被研究的表观遗传修饰[1]。研究表明,组蛋白的乙酰化是乙酰化转移酶(HATs)和去乙酰化酶(HDAC)共同协调控制的一个动态的过程,参与调控基因的转录[2-3]。去乙酰化酶基因(HD1)最早在人类中发现并克隆[4],随后HDACs在其他动物以及植物中相继被发现。根据酵母HDACs的分类,植物的HDACs家族被分为三大类:RPD3/HDA1-like,SIR2-like和HD2,其中HD2亚家族是植物所特有的,首次在玉米(Zeamays)中被鉴定出来[5-6]。
在模式植物拟南芥(Arabidopsisthaliana)中,共鉴定出18个HDACs成员,目前与人类HDACs家族成员数量一致[7],但亚组分类上有一定差异,其中HDA1-like 12个,HDT 4个,SIR 2个。研究表明,HDACs蛋白不直接与DNA结合发挥功能,而是与其他蛋白结合以转录复合体的形式与DNA互作[8],广泛参与植物的生长发育以及胁迫响应过程[5]。AtHDA1-like亚家族成员都含有一个组蛋白去乙酰化酶结构域,在该结构域中含有一些与去乙酰化功能密切相关的活跃结合位点,包括锌指结构等,这些位点对去乙酰化修饰的发挥具有促进作用[9]。拟南芥中,HDA1可以与SCL15、VAL2、TPL、AP2、LEUNIG等蛋白互作,参与调控拟南芥的种子成熟、成花转变及花器官发育等重要发育过程[10-14],尤其是在花器官中,AtHDA1的表达量较高,并且其突变体植株花发育异常。此外,HDA1在植物防御反应和胁迫反应中也发挥重要功能:AtHDA1与AtHDA6具有功能冗余,两者与AtSin3、AtERF4 和 AtERF7形成抑制复合物,通过去乙酰化修饰抑制ABA以及非生物胁迫的响应[15];AtHDA1与WRKY38/62、MSI1互作,参与了水杨酸、乙烯和茉莉酸等信号通路防御反应的响应[16-18]。
除拟南芥外,在水稻(Oryzasativa)、杨树(Populustrichocarpa)、香蕉(Musanana)等其他植物中也有与HDA1功能相关的研究,但在观赏植物中少有报道。百合是重要的鲜切花和园林花卉,由于其花大艳丽、花香等特点而被广泛地使用,但关于百合乙酰化等表观遗传调控以及其HDAC基因家族功能等相关的研究还未见报道。本试验以切花百合的一个主要品种‘索邦’(Liliumoriental hybrid‘Sorbonne’)为研究材料,克隆到LoSorHDA1基因全长编码序列,分析LoSorHDA1的蛋白序列和结构、与其他植物的系统进化关系、亚细胞定位以及在各个组织和不同花发育阶段的表达情况,为后续的去乙酰化修饰以及在花发育中的功能研究奠定基础。
1 材料与方法
1.1 试验材料
以2018年12月底在北京市怀柔基地种植的东方百合‘索邦’为试验材料,取茎生根、嫩茎、上部叶、下部叶、花被片、花药、花丝、柱头、花柱、子房10种组织用于半定量表达分析;取5、10、15、20、25 mm 5个不同花发育阶段的雌蕊、雄蕊、内花被、外花被用于荧光定量表达分析(图1)。以上所有材料用液氮速冻法取材后,立即放于 -80 ℃冰箱,备用。

a. 花部组织的取材部位 Flower tissues sampled;B.不同发育阶段花蕾的大小 Flower bud size at different developmental stages
图1 不同花发育阶段花蕾与取材部位
Fig.1 Flower tissues and sampled buds at different development stages
1.2 试验方法
1.2.1 总RNA的提取与cDNA的合成 总RNA提取按照艾德莱EASYspinPlus植物RNA快速提取试剂盒的方法标准操作。利用ThemoNanoDrop 2000分光光度计测定RNA的浓度,且保证OD260(核甘酸的吸收峰)与OD280(蛋白质的吸收峰)的比值为1.8~2.2。采用Quantitect Reverse Transcription Kit 试剂盒(QIAGEN),对上述操作得到的RNA进行反转合成cDNA,分别用琼脂糖凝胶电泳检测,后将RNA置于 -80 ℃冰箱保存,cDNA置于-20 ℃冰箱保存,备用。
1.2.2 RT-PCR 以‘索邦’不同组织材料的总RNA反转所得的cDNA为模板,根据预期序列(CL10571.Contig1)设计半定量引物F1和R1(表1),进行PCR扩增,内参基因选择TIP41[19],正反向引物分别为F2和R2(表1)。总反应体系20 μL,其中,2×TaqMix 10 μL,引物各0.4 μL,cDNA模板根据内参调整后的量添加(一般为 0.8 μL),ddH2O补足至20 μL。反应程序为:95 ℃ 5 min,95 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 6 min;4 ℃保存。

表1 试验中所用引物序列Table 1 Primer sequences used in the experiments
1.2.3 基因编码序列的克隆 根据半定量的表达情况,以‘索邦’花丝的cDNA为模板,根据转录组数据得到的预期HDA1序列,设计克隆引物F3和R3(表1),PCR扩增编码区序列。总反应体系为50 μL,酶为高保真酶KOD(东洋坊生物公司),其中10×PCR buffer 5 μL,dNTPS 5 μL,MgSO43 μL,引物F3和R3各1 μL,模板cDNA 2 μL,KOD-Plus-Neo 1 μL,ddH2O 32 μL,反应程序为:94 ℃预变性 5 min;98 ℃变性 10 s,55 ℃ 30 s,68 ℃ 1 min,40 个循环;最后 68 ℃ 6 min;4 ℃保存。扩增产物用10 g/L琼脂糖凝胶电泳检测,拍照后切胶回收预期大小条带,连接至pTOPO-B平末端克隆载体(艾德莱公司),转化DH5α感受态细胞,挑选菌落进行PCR检测后送至睿博兴科测序公司测序,结果采用EMBL-EBI在线网站Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)比对拼接,得到正确编码序列,保存菌液。
1.2.4 生物信息学分析 利用Primer3(http://biotools.umassmed. edu/bioapps/primer3_www.cgi)在线设计特异性引物;在NCBI和Phytozome 12.1上下载其他物种的HDA1基因的CDs序列和氨基酸序列;利用MAGE 7.0对所得其他物种编码序列与克隆所得‘索邦’编码序列比对,翻译后构建N-J系统进化树,EvolView(https://www.evolgenius.info//evolview/)在线网站修饰进化树;利用ExPASy(https://web.expasy.org/translate/)翻译得到可能的氨基酸序列,ProtParam tool (https://web.expasy.org/protparam/)分析蛋白的理化性质;利用PredictProtein(https://www.predictprotein.org/)预测蛋白质的二级结构;利用WoLF PSOR (https://wolfpsort.hgc.jp/)和Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)进行亚细胞定位预测;利用DNAMAN、NCBI中的保守结构域数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和Pfam(http://pfam.xfam.org)进行蛋白保守结构域结构的比对分析,GSDS2.0 (http://gsds.cbi.pku.edu.cn/index.php) 绘制蛋白保守结构域预测图。
1.2.5 亚细胞定位瞬时表达载体构建 将保存的克隆菌液大摇后提取pTOPO-B-HDA1重组质粒,以此为模板进行亚克隆的PCR 扩增,根据酶切位点设计亚克隆引物F4,R4(表1),总反应体系为50 μL,酶为高保真酶KOD,其中10×PCR buffer 5 μL,dNTPS 5 μL,MgSO43 μL,引物F4和R4各1 μL,模板1 μL,KOD-Plus-Neo 1 μL,ddH2O 33 μL,反应程序为:94 ℃预变性 5 min;98 ℃变性 10 s,55 ℃ 30 s,68 ℃ 1 min,40 个循环;最后68 ℃ 6 min;4 ℃保存。扩增产物用10 g/L琼脂糖凝胶电泳检测,切胶回收预期大小条带,infusion连接至pSuper1300-GFP表达载体,转化HST08感受态细胞,挑选菌落进行PCR检测后送至睿博兴科测序公司测序,结果采用EMBL-EBI在线网站ClustalOmega(https://www.ebi.ac.uk/Tools/msa/clustalo/)比对拼接,得到正确序列,提取重组质粒,将表达载体pSuper1300-HDA1-GFP通过液氮转化法导入GV3101农杆菌[20],PCR检测后挑选阳性菌落扩大培养,重悬后注射侵染烟草叶背面,暗培养 48 h,采用激光共聚焦显微镜观测定位结果。
1.2.6 qRT-PCR 以‘索邦’不同花发育阶段(5、10、15、20、25 mm)的花部组织雌蕊、雄蕊、内花被、外花被反转得到的cDNA为模板,按照实时荧光定量的引物要求设计目的基因引物F5和R5(表1),内参基因选择ACTIN,正反向引物为F6和R6(表1),进行实时荧光定量qRT-PCR反应,根据SYBRPremix ExTaqTMⅡ(TaKaRa)说明书,配制PCR反应液:体系为20 μL,稀释10×后的模板8 μL,F5和R5混合稀释10×后2 μL,酶10 μL。使用CFX Connect Real-Time PCR System(Bio-Rad)程序进行扩增反应,每份样品重复3次。PCR反应程序为:95 ℃预变性3 min;95 ℃变性10 s,59.4 ℃(ACTIN)/ 55 ℃(HDA1)退火5 s,72 ℃延伸15 s,40个循环;随后以每5 s升温0.5 ℃的速度从65 ℃升至 95 ℃,得到扩增产物的熔解曲线。采用BioRadCFXManager和Excel软件进行数据处理。
2 结果与分析
2.1 ‘索邦’组蛋白去乙酰化酶基因 HDA1编码序列的克隆和分析
以‘索邦’花丝的cDNA为模板,通过PCR扩增,得到清晰的扩增片段条带(图2),大小与预期相符,经纯化回收、连接转化和测序,成功得到‘索邦’HDA1基因的编码区序列长度为1 518 bp,以此序列进行Blastn检索,发现与海枣(Phoenixdactylifera)、油棕(Elaeisguineensis)、小果野焦(Musaacuminata)、天门冬(Asparagusofficinalis)、凤梨(Asparagusofficinalis)等单子叶植物的HDA1具有较高的的相似性 (>80%),与AtHDA1相似性为70.2%,确定该基因为东方百合‘索邦’HDA1基因,并命名为LoSorHDA1。
在拟南芥中,AtHDAC基因家族成员分为3个亚家族,其中最大的为RPD3/HDA1-like亚家族,挑选拟南芥所有HDA1-like亚家族成员和部分植物的HDA1基因(包括单子叶和双子叶),与LoSorHDA1进行同源比对,构建进化树(图3)。结果表明,所有植物的HDA1基因单独聚为一支(Ⅰ),可信度(100%)很高,拟南芥HDA1-like亚家族其他成员各自聚为一支,说明HDA1分支在进化过程中较为保守,其成员的出现可能发生在这些植物物种形成之前。在植物中,HDA1基因的同源性很高,分为单子叶和双子叶两大分支,这与植物的生物学分类一致,在双子叶分支2中,茄科与菊科聚为一支,拟南芥与杨柳科、蔷薇科、葡萄科以及亚麻科聚为一支;在单子叶植物分支1中,HDA1基因的也具有较高的保守性,其中禾本科与凤梨科聚为一支,LoSorHDA1与芭蕉科和棕榈科聚为一支,且与小果野焦(Musaacuminata)的同源性最高,其次是海枣(Phoenixdactylifera)和油棕(Elaeisguineensis),与其他单子叶植物水稻、玉米等同源关系较远。

M.AL5000 marker ;1,2.扩增条带 Amplified target band
图2LoSorHDA1基因编码序列的PCR扩增
Fig.2 PCR amplification of the coding sequence ofLoSorHDA1gene

LoSor.东方百合‘索邦’Liliumoriental hybrid‘Sorbonne’;Ac.凤梨Ananascomosus;Ao.天门冬Asparagusofficinalis;Pd. 海枣Phoenixdactylifera;Eg.油棕Elaeisguineensis;Ma.小果野焦Musaacuminata;Os.水稻Oryzasativa;Bd.二穗短柄草Brachypodiumdistachyon;Zm.玉米Zeamays;At.拟南芥Arabidopsisthaliana;Sl. 番茄Solanumlycopersicum;Ha.向日葵Helianthusannuus;Pt.毛果杨Populustrichocarpa;Lu.亚麻Linumusitatissimum;Pp.桃Prunuspersica;Vv. 葡萄Vitisvinifera
图3 不同植物HDA1基因的系统进化树
Fig.3 Phylogenetic tree of different plantsHDA1genes
2.2 LoSorHDA1氨基酸结构分析
分析结果显示,LoSorHDA1编码的氨基酸序列长度为505 aa,分子相对质量为56 708.56,等电点(PI)为5.23,正电荷残基数53,负电荷残基数78,不稳定系数为36.35(<40),表明该蛋白质稳定,总平均疏水性-0.510,该蛋白为亲水蛋白,脂肪系数73.74。蛋白质的二级结构预测结果显示(图4),在蛋白质结构中,包含大量的螺旋、折叠和无规则卷曲,其中螺旋和折叠结构主要集中在保守结构域中,经统计发现,α螺旋(Helix)占23.71%,β股(Strand)占7.33%,无规则卷曲(Loop)最多,占65.54%。

图4 LoSorHDA1蛋白质的二级结构预测
Fig.4 Prediction of secondary structure of LoSorHDA1 protein
对其保守结构域进行分析(图5),发现在LoSorHDA1的N端包含一个组蛋白去乙酰化酶结构域(Histone deacetylase domain),该结构域位于37~328 aa,属于精氨酸类/组蛋白类水解酶超家族(Arginase-like/histone-like hydrolase superfamily)中的组蛋白去乙酰化酶家族(HDAC)[21-22],占氨基酸序列的大部分,是主要发挥去乙酰化功能的区域,这与毛果杨、番茄和菠萝的研究结果一致[23-25]。与其他植物比对发现该结构域保守性很高,均存在一些关键的活跃位点,包括金属(锌、铁)结合位点(Zn binding site),亲脂管和足口袋(lipophilic tube and foot pocket),在蛋白质赖氨酸的乙酰化、蛋白活性等功能中可能发挥着重要的作用(图6)[26-29]。

图5 LoSorHDA1蛋白保守结构域预测图Fig.5 Predicted map of LoSorHDA1 protein conserved domain
2.3 LoSorHDA1蛋白亚细胞定位分析
WoLF PSORT亚细胞定位预测结果显示,该蛋白最有可能定位在细胞核(5)中,其次是细胞质(4), Plant-mPLoc预测显示LoSorHDA1位于细胞核与细胞质,但未找到明确的核定位位点。
为验证LoSorHDA1蛋白的定位情况,构建了pSuper1300-HDA1-GFP表达载体,农杆菌介导转化烟草叶片表皮细胞,观察GFP瞬时表达情况(图7),结果显示:LoSorHDA1在细胞质和细胞核中均有表达,可能在细胞质与细胞核中均发挥作用,结果与预测结果较为一致。
2.4 LoSorHDA1在不同组织中的表达分析
半定量表达的试验结果显示(图8),LoSorHDA1在‘索邦’不同组织中均有表达,并未在某一个或某几个组织中特异性表达。LoSorHDA1在茎生根、嫩茎、下部叶、花被片、花丝、柱头、花柱和子房中表达量较高,在上部叶和花药中表达稍低,说明其可能广泛地参与东方百合各阶段的生长发育,这与番茄SlHDA1的组织表达模式相似[24]。
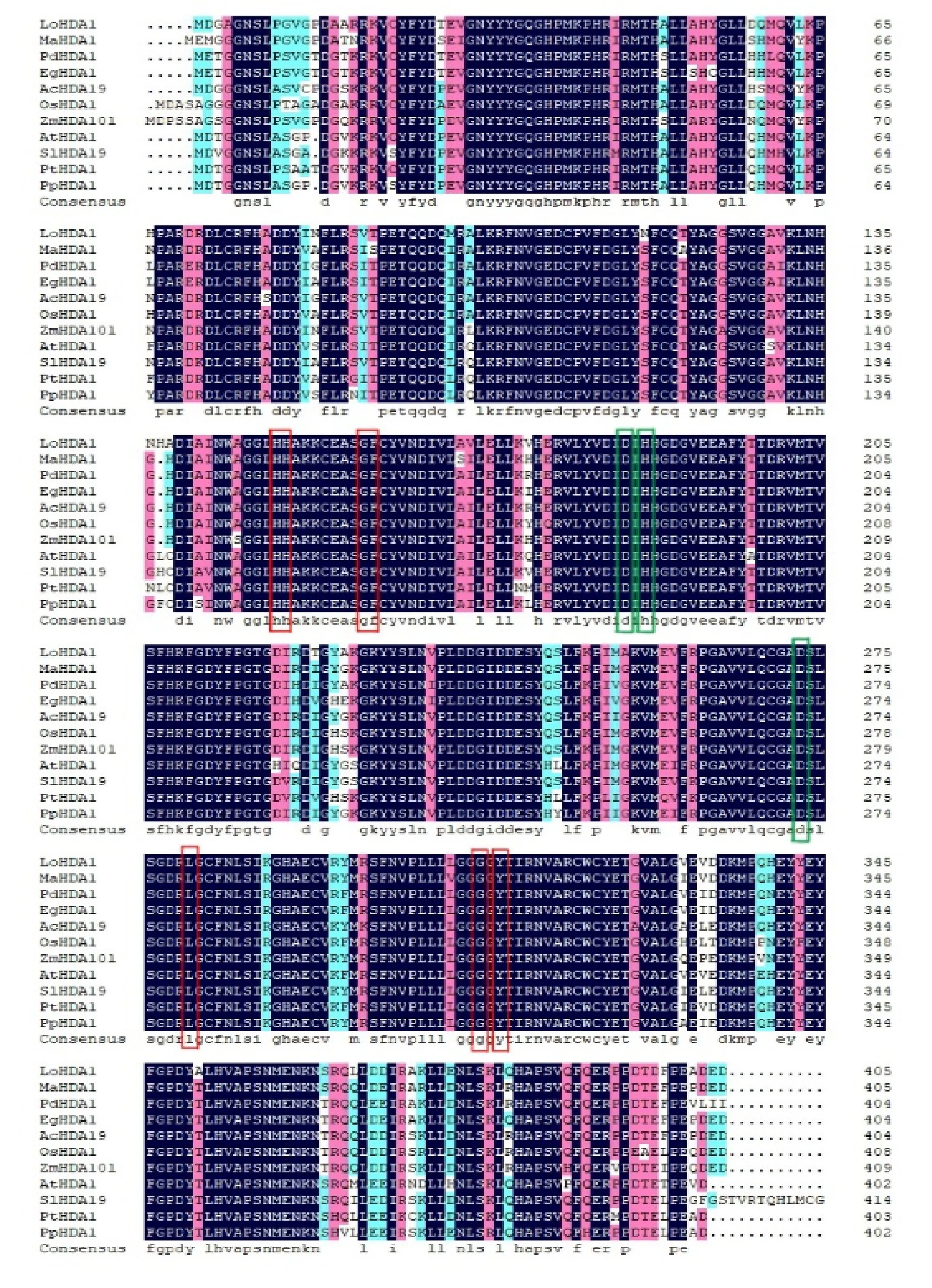
Lo.东方百合Liliumoriental hybrid‘Sorbonne’;Ma.小果野焦Musaacuminata;Pd.海枣Phoenixdactylifera;Eg.油棕Elaeisguineensis;Ac.天门冬Asparagusofficinalis;Os.水稻Oryzasativa;Zm.玉米Zeamays;At.拟南芥Arabidopsisthaliana;Sl.番茄Solanumlycopersicum; Pt.毛果杨Populustrichocarpa;Pp.桃Prunuspersica;方框为主要的活跃位点,其中绿色为金属(锌)结合位点 The box is marked as the main active site, where green is the metal (zinc) binding site
图6 不同植物HDA1氨基酸序列比对结果
Fig.6 Comparison of HDA1 amino acid sequence alignment of different plants

图7 HDA1蛋白的亚细胞定位Fig.7 Subcellular localization of HDA1 protein

图8 LoSorHDA1在不同组织中的表达Fig.8 The expression of LoSorHDA1 in different tissues
2.5 LoSorHDA1在不同花发育阶段中的表达分析
半定量结果显示LoSorHDA1在除花药外的花被片、花丝、花柱、柱头等花部组织中表达量均较高,为了进一步探究LoSorHDA1在花发育阶段的表达情况,利用5、10、15、20和25 mm花蕾中的雌雄蕊以及内外花被片的cDNA进行荧光定量表达分析,结果显示LoSorHDA1在各个阶段的花部组织中都有不同程度的表达(图9),在雌蕊中,早期5 mm中表达量最高,明显高于10、15、20和25 mm,在25 mm时明显下降,中间过程表达量无明显的变化,说明LoSorHDA1可能参与了雌蕊早期的发育;在雄蕊中,呈现与雌蕊相反的趋势,花发育早期表达量较低,在15 mm中表达量最低,后逐渐上升,25 mm中表达量最高,说明LoSorHDA1可能参与雄蕊后期的发育;在花被片中的表达趋势较为一致,先上升后降低,呈现一定的波动性:在内花被中,各个发育阶段的表达量差异不十分明显,在花蕾15 mm时表达量最高;在外花被中,5~10 mm的表达量下降,后又升高,在花蕾20 mm时达到最高,到 25 mm又下降,呈现一个动态变化趋势。
3 讨 论
LoSorHDA1的编码区序列1 518 bp,与拟南芥等植物的HDA1的序列长度相当。已有的HDA1氨基酸序列比对结果(NCBI-Blast)显示,LoSorHDA1与其他植物同源蛋白序列具有很高的保守性,其中与小果野焦同源性最高,从进化关系来看,百合与小果野焦同为单子叶植物,亲缘关系相对较近,基因的功能更为接近,从比对结果发现,LoSorHDA1自身在保守结构域内外也有不同于其他植物的特异性位点,这可能导致百合HDA1功能的变化。在发挥去乙酰化功能的保守结构域中,存在几个与人类HDACs相同的活跃结合位点,这些位点对其正常功能发挥有重要作用。

*表示在0.05水平下的差异显著性 * indicates the significant difference at the 0.05 level
进化关系显示,LoSorHDA1与单子叶植物HDA1的同源性更高;拟南芥HDA1-like亚家族成员系统进化树分析发现,各成员在进化过程中十分保守,在这些高等被子植物物种形成之前,可能已经进化完成,并具有一定同源性。比对3个亚家族的蛋白结构域发现:HDA1-like亚家族与HD和SIR亚家族在蛋白结构域上差异较大,HD2、SIR2亚家族不含有组蛋白去乙酰化酶结构域,存在甘氨酸、天冬氨酸和谷氨酸丰富区;EFWG保守区以及Sir2 domain,在功能机制上可能存在差异[9]。从蛋白质的亚细胞定位上来看:AtHDA1定位于细胞核,非核仁,但PtHDA1(毛果杨)定位于细胞质,可能在细胞质中发挥作用[23],研究表明HDA1-like亚家族主要定位于细胞核中,部分成员位于细胞质,也有一些成员穿梭于细胞核与细胞质之间,这与它的功能存在一定联系[5];亚细胞定位预测显示LoSorHDA1定位于细胞核中的可能性最大,其次位于细胞质中,试验结果显示LoSorHDA1定位于细胞质和细胞核,可能在细胞质、细胞核中均发挥功能,说明HDA1在不同植物中的定位存在一定差异。
LoSorHDA1在百合组织中广泛表达,这说明它与拟南芥、番茄等其他已研究的植物一样,广泛地参与百合生长发育的各个阶段。LoSorHDA1、AtHDA1、FvHDA3(AtHDA1的同源基因)在花部组织、花发育过程中表达量尤为高,证明其与花发育过程密切相关[9,30]。开花植物花器官发育的调控主要依靠ABCDE模型相关基因AP1、AP2、AP3、AG等,大部分属于MADs-box转录因子家族,它们的异常表达直接影响花器官的正常发育,HDA1与花发育相关基因(AP2)直接互作影响开花[11],转录抑制因子LEUNIG,其靶基因涵盖植物的各个发育阶段,LEUNIG通过与HDACs家族成员HDA1等互作,实现对花发育相关基因的抑制[14],HDA1还参与了A类基因AP1与C类基因AG间的相互抑制作用,保证花被片与生殖器官的正常。拟南芥hda19系列突变体具有花发育异常表型:花瓣融合,数量减少、雄蕊变短、雌雄蕊育性降低等[31-32],在百合中,LoSorHDA1在雌雄蕊和花被片中都表达,值得注意的是LoSorHDA1在雌蕊的早期发育中(5 mm)表达量明显高于其他阶段,在雄蕊后期高于其他阶段,其很可能参与了雌蕊的分化形成和早期发育、雄蕊后期的发育,进一步推测LoSorHDA1在雌雄蕊的正常发育、维持花被片数量中发挥一定功能。不仅如此,AtHDA1功能的缺失,导致其他发育阶段的异常,这些结果表明AtHDA1是一种在植物中通过DNA序列独立或表观遗传机制控制发育过程中基因表达的全方位调节剂[32],因此在百合中,HDA1基因如何影响花发育,突变是否会导致花瓣减少、雄蕊花丝变短等发育异常,需对其功能做进一步研究,通过过表达或恢复突变体表型来确认是否与AtHDA1具有相似的功能。然而番茄中研究表明SlHDA1在花中表达较低,在果实中高表达,与果实成熟密切相关[24];在香蕉中,MaHDA1与乙烯信号通路转录因子MaERF11直接互作影响香蕉果实的成熟[33];在拟南芥中,AtHDA1与HSL1/VAL2互作参与种子发育[12],而非ERF,因此百合中HDA1是否与这些蛋白互作或存在新的蛋白,值得进一步研究,也说明HDA1在不同植物中可能与不同蛋白互作,在果实和种子成熟中发挥重要作用。
笔者从序列比对、系统进化、亚细胞定位、组织表达模式和不同花发育阶段花部组织表达格局初步推测,LoSorHDA1可能与拟南芥AtHDA1类似,在百合的成花与花发育中具有重要作用。但是其是否可以与VAL2、AP2、FLD、FVE等蛋白质形成复合物,共同作用于其他基因;是否与HDA6具有功能冗余,通过去乙酰化修饰参与调控百合种球发育、成花转变和花的发育,还须进一步的研究。此外对于LoSorHDA1在种子成熟、胁迫响应以及防御反应中是否与AtHDA1发挥相似的作用,还有待探究。

