水分胁迫下氮素增加对玉米生长的抑制作用∗
邢换丽,周文彬,郝卫平,李 丽,王 超,马海洋,3,王耀生**
(1.作物高效用水与抗灾减损国家工程实验室/农业农村部旱作节水农业重点实验室/中国农业科学院农业环境与可持续发展研究所,北京 100081;2.中国农业科学院作物科学研究所,北京 100081;3.中国热带农业科学院南亚热带作物研究所,广东湛江 524091)
中国干旱、半干旱地区面积占全国土地总面积的50%[1],与此同时,中国又是世界上最大的化学氮肥消耗国,总用量达到了全球总量的33%[2]。干旱胁迫和低氮肥利用率成为限制作物生产最重要的两大因素。氮素是作物生长必需也是需求最多的矿物元素,然而氮肥投入的不断增加并没有持续提高作物产量,反而造成氮肥利用率降低,土壤酸化和水体富营养化等环境污染和生态问题日益严峻[3],使农业生产成本和环境成本增加。水分胁迫和氮肥亏缺一般会通过限制植株的光合作用影响其生长,光合作用是植物最重要的生理过程之一,为其生命活动提供物质和能量[4]。目前有关光合作用的大量研究更多关注气孔因素,而光和CO2响应曲线作为研究植物光合生理和植物生理适应性的热点,水分胁迫下氮素对其的影响的研究报道较少。研究表明,通过测定作物叶片对光和CO2的响应,可以得到反映不同生理生化过程及环境变化对作物光合生理影响的重要参数,如最大净光合速率(Amax)、饱和光强(Qsat)和初始羧化效率(a)等[5]。杜伟莉等通过研究玉米的光合响应曲线,发现干旱条件下Amax降低[6],即植株的光合能力下降。王帅等从氮素角度出发研究发现,增加施氮量,玉米穗位叶光合速率随之提高,氮肥施用量过高或氮肥亏缺时则下降[7-8]。在不同水分条件下,氮素对植物光合速率的影响并不相同[9],这与水氮互作效应密切相关。Wang 等研究表明,水氮互作可以提高作物的水肥利用效率[10],干旱条件下增施氮肥可以提高作物抗旱性[11]。作物抗旱性是一种综合适应机制,仅研究地上部的反应很难揭示作物整体抗旱性的本质。随着根源信号物质的发现,地下部根系在作物整体抗旱性中的作用逐渐被揭示。根系是作物吸收水分和养分的主要器官,其吸收能力的大小很大程度上取决于根系的形态[12],尤其根长对水分利用效率的贡献大于根系比表面积和根干重[13],因此,Oikeh 等提出将根系形态的差异作为氮素高效和耐旱玉米的选择标准[14]。然而,根系本身的生长和发育又与土壤水肥状况密切相关。信乃诠等研究指出,土壤干旱条件下施肥可以促进作物根系的生长[15]。但是,有关氮肥对根系生长的影响,研究结果还不一致。既有研究表明施氮增加根长[16],也有研究指出施氮抑制玉米根长[17]。研究提出根的大小是老根的衰老和新根的发育之间平衡的结果[18]。根据Ogawa 等研究,玉米根的衰老又与来自地上部的同化物的供应有关[19],当叶片的光合作用受限制时,根系大小会显著降低[20]。目前将玉米地上部叶片生理过程和地下部分根系的生长发育作为一个相互关联的有机体,同时对地下和地上部分器官受旱后及受旱后对不同水平氮肥处理的响应还不清楚,这制约了干旱发生发展过程对玉米影响的认识[21]。研究根系的最终目的是通过改善根系,保证植株在干旱逆境下最大限度地获取水分和氮素,提高植株抗旱性,以消耗最少量的水分和氮素获得最高的产量。因此,另一方面本研究将从根系形态变化,探究水分胁迫下施氮对植株地下部分抗旱性的影响。本研究通过测定不同土壤水分条件下施氮水平对玉米光合作用、气孔导度、水分利用效率及光和CO2响应曲线的影响,揭示水分胁迫下施氮对植株光合能力及水分利用效率的影响机制。同时通过测定根系性状,探索植株地下部分对水分胁迫下不同氮素处理的响应,为不同土壤水分条件下合理施用氮肥,优化根系形态,提高作物在逆境中的适应性和抗旱性提供科学依据。
1 材料与方法
1.1 试验设计
试验于2018年4-8月在中国农业科学院农业环境与可持续发展研究所玻璃温室内进行。试验地点属于典型的暖温带半湿润大陆性气候,夏季炎热多雨,冬季寒冷干燥,年均气温10~12℃,年无霜期180~220d。供试土壤类型为沙壤土,田间持水量为35%(体积含水量),土壤全碳含量9.0g⋅kg-1,全氮含量1.0g⋅kg-1,pH 值为7.6。试验选用10.6L的塑料盆,盆口直径为27.5cm,下底直径为20.0cm,高为24.0cm,每盆装12.0kg 过5mm 筛的干土,土壤容重为1.2g⋅cm-3。
试验所用材料为玉米自交系B73。本试验采用双因素完全随机设计,设3个水分处理,分别为中度水分胁迫(W1,40%~50%田间持水量),轻度水分胁迫(W2,60%~70%田间持水量),充足供水(W3,75%~90%田间持水量);在3个水分处理水平下设置低氮(N1,1.0g·盆-1),中氮(N2.5,2.5g·盆-1)和高氮(N5,5.0g·盆-1)3个施氮水平。供试氮肥为NH4NO3,共9个处理,每个处理4 次重复。各处理磷肥和钾肥用量相同,于移栽前将5.75g·盆-1KH2PO4(磷酸二氢钾)、1.88g·盆-1K2SO4(硫酸钾)和全部氮肥作为基肥一次性与盆栽土混匀施入。玉米种子进行催芽育苗,在玉米幼苗二叶一心时移栽定植,一盆一株。在玉米拔节期前各处理土壤含水量均控制在80%田间持水量,拔节期开始水分胁迫处理。在盆壁与植株中间插入一对长15cm的探针,控水期间每日 17:00 采用高精度时域反射仪(TDR,MINITRASE,Soil Moisture Equipment Corp.,CA,USA)监控当天15cm 深处土壤体积含水率。通过测定的土壤体积含水率、设定的灌溉水平和盆内土壤体积计算每次需要的灌溉量。量筒定量浇水控制土壤含水量。由于设定的灌溉水平不同,因此每个处理的灌水量不同。
本研究中土壤最大田间持水量为35%,由图1可知,充足供水(W3)条件下,两次浇水期间实际土壤含水量平均为26.9%,即田间持水量的76.9%;轻度水分胁迫(W2)下,实际土壤含水量平均为20.7%,即田间持水量的59.1%;中度水分胁迫(W1)下,实际土壤含水量平均为15.8%,即田间持水量的45.1%。
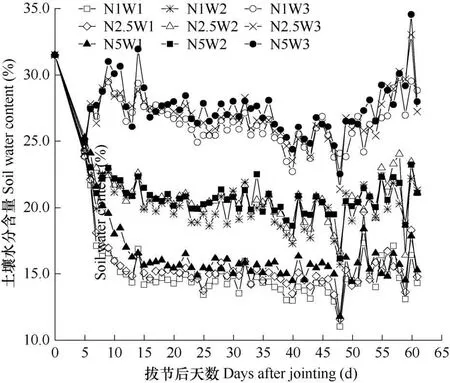
图1 玉米拔节期后各处理土壤水分含量动态变化Fig.1 Variations of soil water contents under different treatments after maize jointing stage
1.2 项目测定
土壤水分测定:玉米生育期内土壤含水量采用高精度TDR 水分测定仪进行采集并记录。
气体交换参数及水分利用效率测定:试验从玉米拔节期开始每周测定一次玉米叶片的气体交换参数,包括光合速率(An)和气孔导度(Gs)等,直至玉米成熟收获。选晴天的9:00-12:00,利用Li-6400 便携式光合仪(Li-cor,USA)测定,设定人工光源光强为2000μmol⋅m-2⋅s-1,CO2浓度为400μmol⋅mol-1,选择各处理生育进程一致、照光均匀的植株叶片进行测定。叶片水分利用效率(WUEi)为[10]

光响应曲线及二氧化碳响应曲线测定:在玉米吐丝期,选晴天9:00-12:00,利用Li-6400 便携式光合仪连续测定,设定CO2浓度为400μmol⋅mol-1,设定光强梯度为2000、1500、1000、700、500、300、200、100、50和0μmol⋅m-2⋅s-1。测定穗位叶在每一光强下的An等参数。利用直角双曲线修正模型进行光响应曲线拟合[22],计算式为

式中,An是净光合速率,Q 是光强即光量子通量密度,β和γ 为系数(m2⋅s⋅μmol-1),Rd是暗呼吸速率,α 为光响应曲线的初始斜率。同时计算植物的饱和光强和光饱和时的最大净光合速率(Amax),计算式为[23]
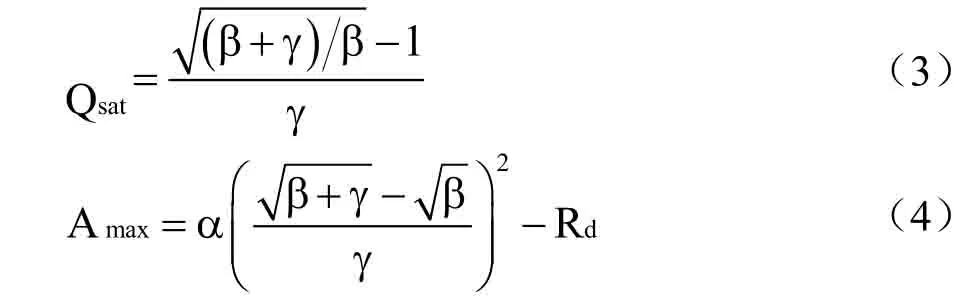
在玉米吐丝期,选晴天9:00-12:00,利用Li-6400 便携式光合仪测定穗位叶在每一CO2浓度下的An等参数,测定时控制光强为2000μmol⋅m-2⋅s-1,并用CO2注入系统控制CO2浓度,设定CO2浓度梯度为400、350、250、150、100、50、400、600、800、1000、1200、1500μmol⋅mol-1。利用直角双曲线修正模型进行CO2响应曲线拟合[24],即
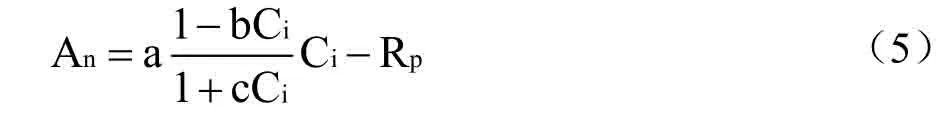
式中,An是净光合速率,Ci是胞间CO2浓度;b和c 为系数(mol⋅μmol-1),Rp是光呼吸速率,光下暗呼吸很小,因此,近似将光下叶片向空气中释放CO2的速率看作光呼吸速率[25],a 为CO2响应曲线的初始羧化效率。同时计算植物的饱和胞间CO2浓度和饱和胞间CO2浓度对应的光合能力(Amax),计算式为[23]
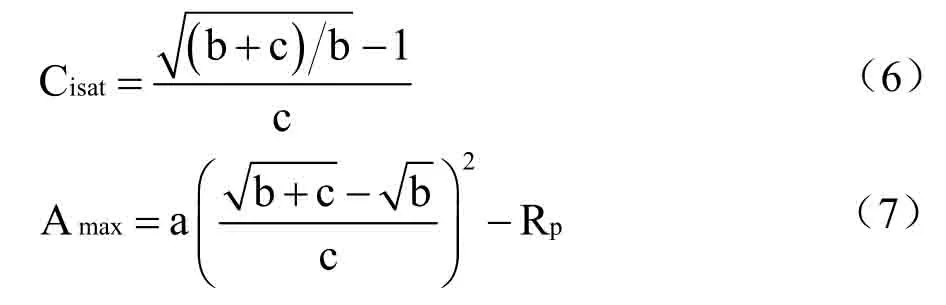
样品采集及根系测定:收获时采集0.5g 根系,自来水快速清洗以除去黏附的土壤,用吸水纸吸干并用锡箔纸包裹后立即放入液氮冷冻,储存在-80℃冰箱用于根系脱落酸(ABA)含量的测定,采样与液氮冷冻间隔时间不超过20s。根样品加液氮研磨后在中国农业大学通过ELISA 方法测定ABA 浓度[26]。再采集一部分根系除去黏附的土壤颗粒,利用WP4C露点水势仪测定根水势。最后收集盆里其余所有根系,将土和杂质去除并洗净,用扫描仪(WinRHIZO根系分析系统)逐个扫描,扫描后获得的图像经根系分析程序(WinRHIZO 根系分析软件)处理得到根长、根体积、根表面积等数据,根系经过扫描后放进烘箱在105℃杀青30min,然后调至恒温70℃烘至恒重,测量根干重。根系比表面积(cm-1)为

1.3 数据分析方法
试验数据采用SPSS 22.0(IBM Corporation,USA)软件进行单因素和双因素方差分析。当方差分析显著时,继续用Duncan 多重比较法进行多组样本间差异显著性分析(P<0.05)。采用Origin 8.0(USA)软件制作图表。
2 结果与分析
2.1 水分胁迫下氮素对玉米叶片光响应曲线和二氧化碳响应曲线的影响
2.1.1 光响应曲线
随着我国社会的不断进步,我国的经济发展速度也越来越快,畜牧业作为我国的基础产业之一,其发展将会直接影响我国的经济发展。口蹄疫作为一种接触性传染疾病,对于畜牧业中的牛羊等偶蹄类动物具有较大的威胁,并且可以通过患病动物或者其他带有致病病毒的物品进行传播,一但动物染病后,将会在口、舌、唇、蹄等部位产生水泡,对我国的畜牧业发展产生了很大的危害。本文通过对口蹄疫病及其危害进行介绍,同时对牛羊口蹄疫的病症鉴别诊断进行分析,最终对如何更好的开展牛羊口蹄疫防治工作提出一些建议。
由图2a、b和c可见,相同氮素水平下,不同水分处理间叶片光响应曲线变化趋势和最大净光合速率有明显差异(表1)。暗呼吸速率(Rd)、最大净光合速率(Amax)和饱和光强(Qsat)均随水分胁迫加重而减小。从数值上看,在中、高氮条件下,水分处理间的Rd和Amax变化幅度最大(P<0.05),而在低氮条件下水分处理间变化最小。较充足供水时,中、高氮条件下中度水分胁迫处理的Amax分别显著降低38.31%和37.11%(P<0.05);Rd分别显著降低31.23%和42.06%(P<0.05);Qsat分别降低12.99%和14.85%。不同处理间初始斜率(α)变化较小。
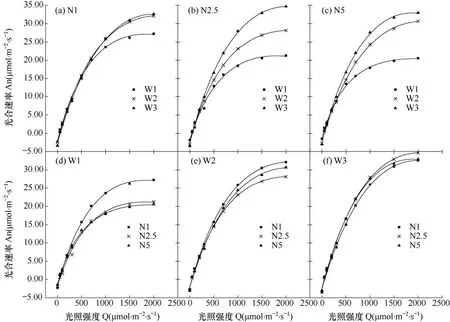
图2 不同氮素处理下水分胁迫(a、b、c)及不同水分胁迫下氮素处理(d、e、f)对吐丝期玉米叶片光响应曲线的影响Fig.2 Effect of water stresses under different N treatments(a, b, c) and effect of N treatments under different soil water stresses(d, e, f) on photosynthetic light response curve of maize plants during the silking stage
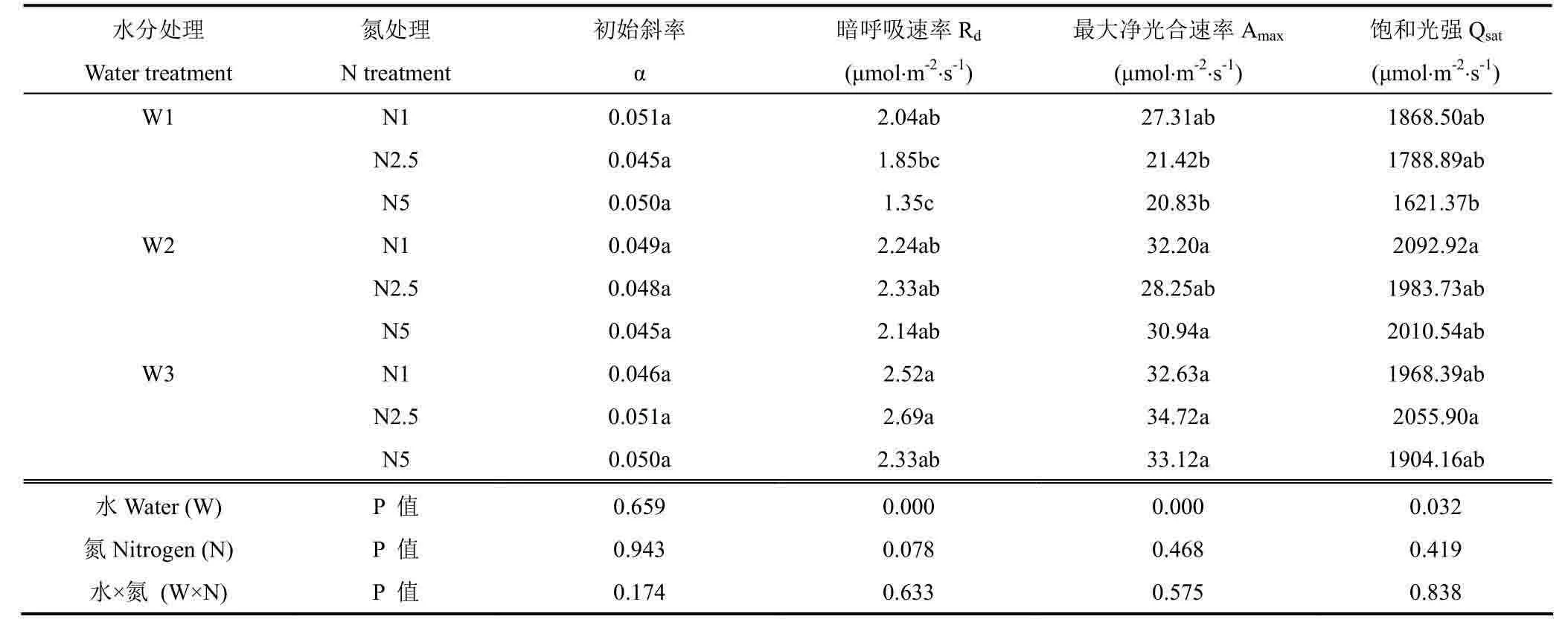
表1 不同水分胁迫下氮素处理对光响应曲线拟合参数的影响Table1 Effect of N treatments on the initial slope(α), the maximum net photosynthetic rate(Amax), the dark respiration rate(Rd), and the saturation irradiance(Qsat) derived from the photosynthetic light response curve(equation 2-4, fig.2) of maize plants under different soil water stresses
图2d、e、f显示了相同水分条件下不同施氮处理间光响应曲线的变化趋势。由图2e和2f可见,在轻度水分胁迫和充足供水条件下,不同氮素处理间叶片光响应曲线差异较小。但由图2d可见,中度水分胁迫条件下,低氮处理与中、高氮处理的叶片光响应曲线变化趋势和最大净光合速率有明显差异。从数值上看(表1),中、高氮处理的Rd、Amax和Qsat平均值较低氮处理分别下降21.57%、22.65%和8.74%,但差异不显著。这说明水分和氮素均会影响玉米叶片的光响应曲线,水分处理的影响更明显。在相同施氮水平下,水分胁迫一定程度抑制了叶片的光能利用能力和最大光合能力,而中度水分胁迫下,增加施氮量使叶片的光能利用效率和光合能力进一步降低。
2.1.2 二氧化碳响应曲线
由图3a、b和c可知,相同氮素水平下,不同水分处理间叶片CO2响应曲线变化趋势和最大光合能力有明显差异(表2)。初始羧化效率(a)、光呼吸速率(Rp)、光合能力(Amax)和高氮条件下的饱和胞间CO2浓度(Cisat)均随水分胁迫加重而减小;低、中氮条件下Cisat随水分胁迫加重而增大,但变化不显著。
由图3d、e和f可知,相同水分条件下不同施氮处理间CO2响应曲线差异较小。从数值上看,各水分处理尤其中度水分胁迫下,a和Rp随施氮量的增加而降低,且中度水分胁迫下 a 值变化显著(P<0.05),Cisat也随施氮量的增加而降低;而不同氮素处理间Amax则变化较小。结合图表分析,水分和氮素均会影响玉米叶片的CO2响应曲线,水分处理的影响更明显。在相同施氮水平下,水分胁迫一定程度抑制了叶片的CO2利用能力和光合能力,而中度水分胁迫条件下,中、高氮处理较低氮处理a和Rp降低即初始羧化效率和光呼吸速率减小,而且高氮条件还降低了Cisat。此外,图3还显示,光合能力随着胞间CO2浓度的增加而增加,直至达到饱和胞间CO2浓度后光合能力出现下降。
2.2 水分胁迫下氮素对玉米叶片气体交换参数和水分利用效率的影响
由图4a和b可知,相同氮素水平下,不同水分处理间叶片光合速率(An)和气孔导度(Gs)均随水分胁迫加重而降低,尤其是中度水分胁迫下显著降低。各氮素处理下,中度水分胁迫较充足供水的An和 Gs显著降低,下降幅度分别达 32.37%~51.97%和41.85%~56.14%,其中高氮处理下降幅度最大。
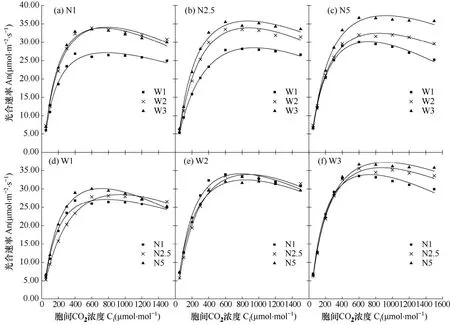
图3 不同氮素处理下水分胁迫(a、b、c)及不同水分胁迫下氮素处理(d、e、f)对吐丝期玉米叶片CO2 响应曲线的影响Fig.3 Effect of water stresses under different N treatments(a, b, c) and effect of N treatments under different soil water stresses(d, e, f) on photosynthetic CO2 response curve of maize plants during the silking stage
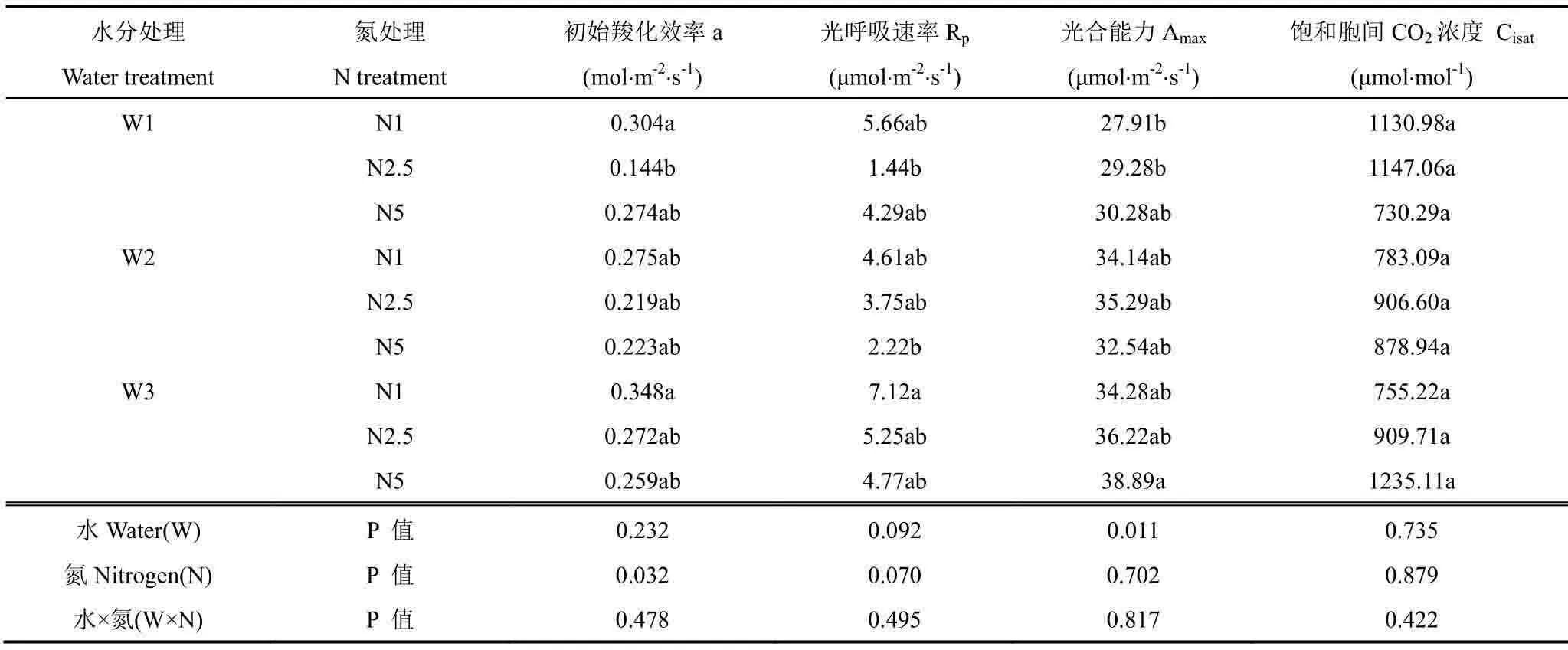
表2 不同水分胁迫下氮素处理对CO2 响应曲线拟合参数的影响Table2 Effect of N treatments on the initial carboxylation efficiency(a), the rate of the photorespiration(Rp), the photosynthetic capacity(Amax), and saturation intercellular CO2 concentration(Cisat) derived from the photosynthetic CO2 response curve(equation 5-7, fig.3) of maize plants under different soil water stresses
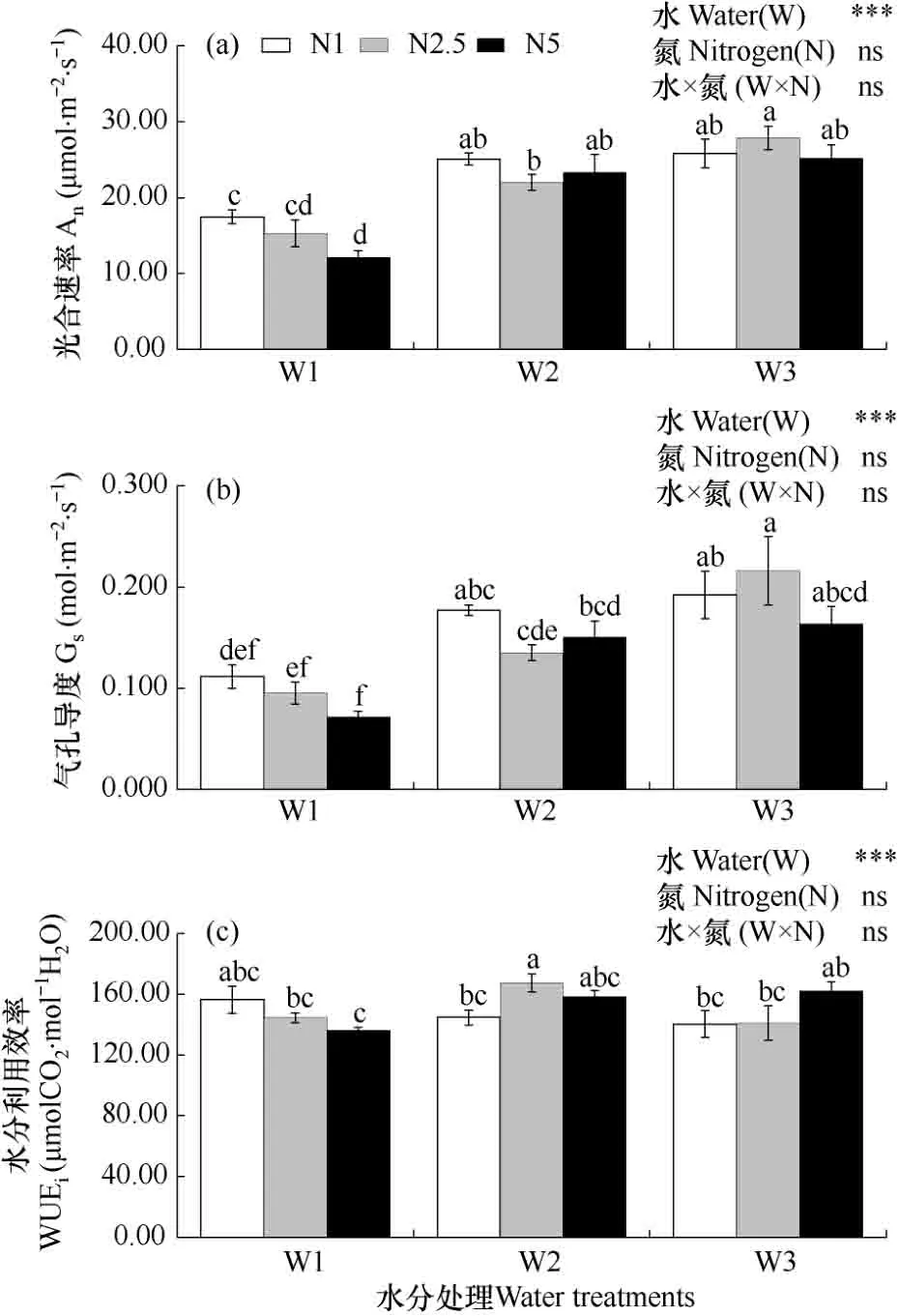
图4 不同水分胁迫下氮素对玉米叶片光合速率、气孔导度和水分利用效率的影响Fig.4 Effect of N treatments on photosynthesis(An), stomatal conductance(Gs) and intrinsic water use efficiency(WUEi) of maize leaf under different soil water stresses
2.3 水分胁迫下氮素对根水势和根激素的影响
由图5a可知,相同水分条件下不同氮素处理间和相同施氮条件下不同水分处理间根的ABA 浓度无显著变化。将相同施氮条件下不同水分处理间根ABA 浓度进行比较可得,相同施氮条件下,中度水分胁迫显著降低根水势,而充足供水和轻度水分胁迫间根水势无显著差异。此外,由图5b可看出,充足供水和中度水分胁迫条件下,增施氮肥根水势逐渐降低;尤其是充足供水下高氮处理较低氮处理根水势显著降低(P<0.05)。结果表明,无论相同氮素处理不同水分处理间或相同水分处理不同氮素处理间,根ABA 浓度基本一致。在相同施氮水平下,水分胁迫显著降低根水势,而在中度水分胁迫下,增加施氮量,根水势降低幅度增大。
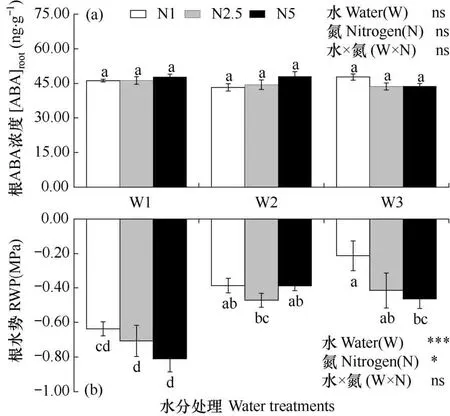
图5 不同水分胁迫下氮素对玉米根水势和根ABA 浓度的影响Fig.5 Effect of N treatments on the root water potential (RWP) and root ABA concentration([ABA]root) of maize plants under different soil water stresses
2.4 水分胁迫下氮素对玉米根系形态的影响
由图6a可见,相同氮素水平下,不同水分处理间根长有明显差异,且变化趋势基本一致,即根长随水分胁迫的加剧而增加,尤其低、中氮条件下根长变化显著。从数值上看,各氮素处理下,水分胁迫的根长平均值较充足供水增幅达 106.39%~208.82%。由图6b可见,相同氮素处理下,根系比表面积也随水分胁迫加重而增大。从数值上看,各氮素处理下,水分胁迫的根系比表面积平均值较充足供水显著增加45.81%~105.85%。此外,低氮条件下水分胁迫处理的根长、根系比表面积增加幅度最大,中氮条件下居中,高氮条件下增加幅度最小。根据图6c可得,相同施氮条件下,根干重随水分胁迫的加剧而减小,从数值上看,各氮素处理下,中度水分胁迫的根干重较充足供水降低幅度达23.94%~36.61%,高氮下降低幅度最大。
图6a和b可见,相同水分条件下,根长、根系比表面积均随施氮量增加而降低,尤其是在水分胁迫条件下高氮处理的根长、根系比表面积较低氮处理分别显著降低41.85%~54.10%、18.68%。相同水分条件下,根干重随施氮量增加而降低,尤其中度水分胁迫下高氮处理的根干重较低氮处理显著降低33.75%。
综合图6分析,相同施氮水平下,水分胁迫促进玉米根长、根系比表面积增加,低氮下增加幅度最大,中氮次之,高氮下增加幅度最小,而水分胁迫的根干重降低,高氮条件下降低幅度大于低氮;无论轻度水分胁迫或中度水分胁迫条件下,高氮处理的根长、根系比表面积、根干重均低于低、中氮处理。水分胁迫下高氮处理抑制玉米根系生长。
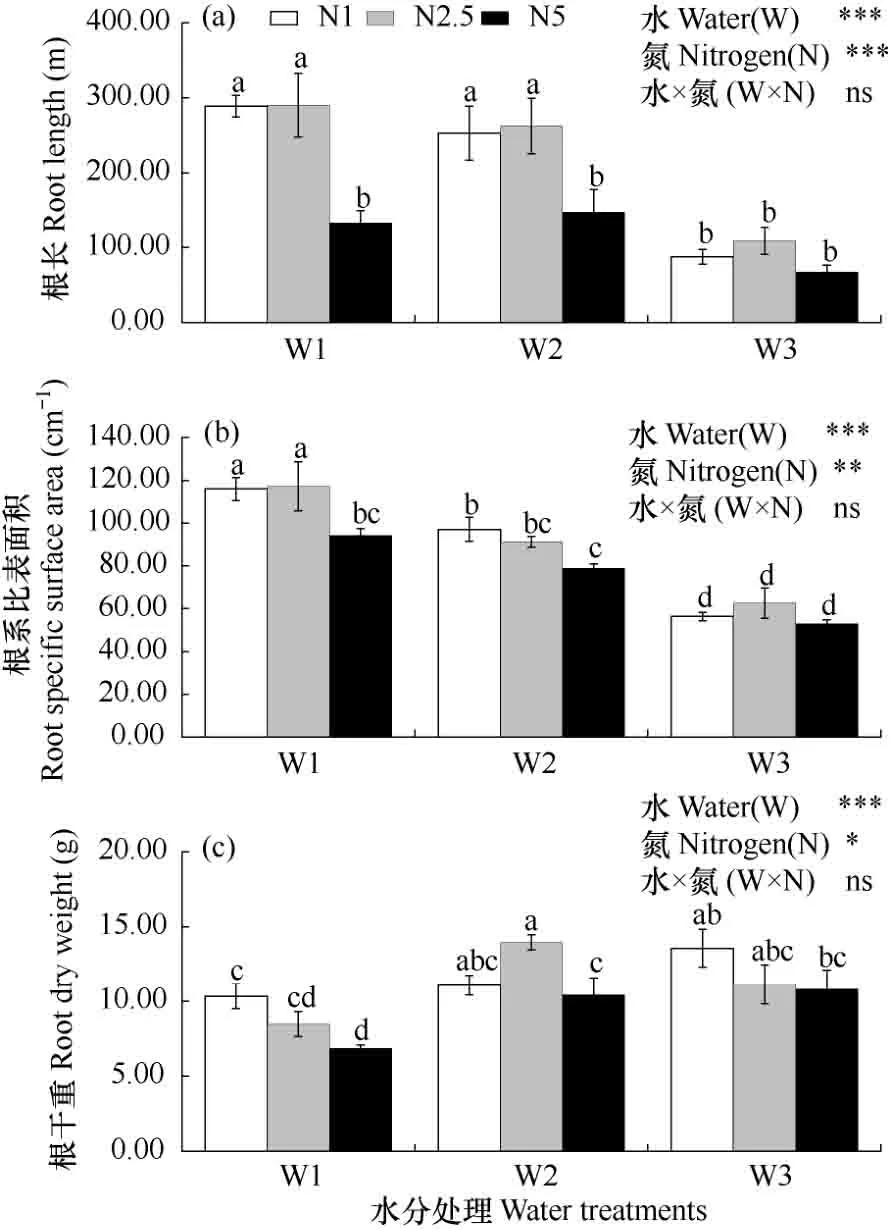
图6 不同水分胁迫下氮素对玉米根长、根系比表面积和根干重的影响Fig.6 Effect of N treatments on the root length, root specific surface area and root dry weight per plant of maize under different soil water stresses
3 结论与讨论
3.1 讨论
从作物本身出发,揭示其抗逆性机理,为培育具有高效吸收和利用水分、养分的作物新品种提供理论依据,是有效应对目前水资源匮乏、氮肥过多施用的严峻挑战的重要策略[27]。光合作用是玉米进行物质生产的基本生理过程,对环境胁迫非常敏感。玉米光和CO2响应曲线通过描述光量子通量、CO2浓度与光合速率之间的关系[8],反映了植株在不同环境下的光合能力。采用模型拟合响应曲线得到一些重要参数,这些参数反映了植物光反应过程中的光化学效率和潜在的光、CO2利用能力,有助于解释植物应对土壤干旱、氮肥亏缺的生理生态学过程,是从植物光合生理特性方面研究其干旱、低氮适应性的重要生理指标[28]。此外,除了地上部反映光合生理特性的指标,地下部根系形态在提高作物整体抗旱性中也具有重要作用。丁红等研究指出,根系在土壤中的生长具有可塑性,干旱条件下合理施肥,可以扩大作物根系延伸范围,增强根系综合活力[29]。信乃诠等研究提出,旱地合理施肥促进植株根系生长的效应是“以肥调水,以水促肥”的机理[15]。为进一步揭示水分胁迫下不同施氮水平对植株的光合特性及根系形态的影响,本研究在不同土壤水分条件下测定了不同氮素处理的叶片气体交换参数和水分利用效率及光和CO2响应曲线以及根系形态,揭示玉米在土壤水分胁迫下对氮素的响应及调节机制。
气孔因素是影响叶片光合作用过程的主要因素[30]。气孔关闭伴随光合速率下降是植株适应环境胁迫的一种策略。本研究表明,在相同施氮水平下,水分胁迫显著降低叶片的Gs和An,这与已有研究一致[31-32]。在中度水分胁迫条件下,增施氮肥又使Gs和An下降幅度增加,而水分胁迫和氮素对WUEi均无显著影响。可见,水分胁迫使植株光合能力显著下降,而在水分胁迫下增加施氮量使光合能力降低幅度增加;而在轻度水分胁迫和充足供水条件下,不同氮素水平对Gs和An则无显著影响,这与李扬等在水分供应良好基础上,施用氮素使An明显增加的研究结果不同[33]。这一方面可能与气孔导度下降有关,另一个方面可能与光和CO2利用能力有关。本研究结果显示,水分和氮素均会影响玉米叶片的光响应曲线和CO2响应曲线,水分处理的影响更明显。氮素处理相同时,较充足供水,水分胁迫降低了光响应曲线特征参数Rd、Amax和Qsat,尤其是中、高氮条件下,中度水分胁迫处理的这些参数降低幅度显著。Qsat反映了叶片利用光的能力,其值降低表明植株的生长发育容易受到强光的抑制[23];饱和光强下对应的最大净光合速率Amax的减小,反映了叶片的最大光合能力即植株潜在光合能力下降[28]。由此可得,水分胁迫降低了植株光利用效率和光合能力,这与前人的研究结论一致[28,34],而此时增施氮肥将进一步加剧水分胁迫对植株的伤害,使光利用能力和光合能力降低幅度加大,更容易受到强光的抑制。吴爱姣等研究指出,同一水分处理下不同氮素处理对叶片的光能利用效率的影响不显著[28],这与本研究结果相符。本研究CO2响应曲线拟合参数显示,a、Rp、Amax和高氮条件下的Cisat均随水分胁迫的加剧而减小,而且中度水分胁迫下,中、高氮处理的a和Rp即初始羧化效率和光呼吸速率低于低氮处理,且Cisat也随施氮量的增加而降低。拟合参数a 为CO2响应曲线的初始羧化效率,其值减小反映了核酮糖-1,5-二磷酸羧化酶(Rubisco)的量及其酶活性即利用低CO2浓度的能力降低;而饱和胞间CO2浓度Cisat下降反映了叶片利用高浓度CO2的能力减小。拟合曲线显示,胞间CO2浓度高于Cisat会抑制植株的最大光合速率,因此,Cisat越低,表明叶片在高浓度CO2环境中其光合能力越容易受抑制;而Cisat对应的叶片光合能力Amax的减小反映了叶片的光合电子传递和磷酸化的活性降低[23]。可见,水分胁迫会降低叶片对低浓度CO2的利用能力和最大光合能力。高氮条件下,水分胁迫处理的植株光合能力更易受到高浓度CO2的抑制,而且中度水分胁迫下,增加氮素进一步抑制了叶片对低浓度CO2和高浓度CO2的利用能力,使植株的光合能力更易受到高浓度CO2的抑制。此外,Rd和Rp均随着水分胁迫程度的加剧而下降,而且中度水分胁迫下增加氮素供应其值进一步减小,对此可能的解释是玉米在环境胁迫中通过抑制呼吸作用减少对光合产物的消耗,以维持在干旱土壤中的生存,或者干旱条件下光合作用的下降使呼吸作用因可利用底物减少而随之降低,因此呼吸作用的下降很可能与光合作用的降低有关,这与前人的研究结果基本一致[28]。总之,水分胁迫下叶片Gs减小,光、CO2利用效率和最大光合能力下降即光合性能降低,导致An降低,此时增加施氮量又使Gs、光和CO2响应曲线特征参数下降幅度增大即光、CO2利用能力和最大光合能力进一步削弱,植株光合作用更容易受到强光和高浓度CO2的抑制,An降低幅度加大。
前人研究表明,不同土壤水分条件下,氮素对根系生长的影响不同,而且相同水分条件下氮素对根系形态的影响也存在争议[29]。李秧秧等对玉米的研究表明,在充足供水条件下,增加氮素供应会增加玉米根长[35],但是王艳等的研究却指出,玉米和棉花根长、根干重和根系表面积随施氮量的增加而减小[36-37]。当土壤水分亏缺时,施氮可以促进棉花根系生物量的积累,但随施氮量增加,根系表面积降低[37]。水稻的相关研究表明,增施氮肥显著增加根干重,促进根系向深层土壤下扎[38]。刘世全等提出,土壤水分胁迫条件下氮肥施用量对根系生长存在少量促进根系生长,过量则表现为抑制生长的效应[39]。本研究结果表明,相同施氮水平下,水分胁迫的玉米根长、根系比表面积增加,低氮下增加幅度最大,中氮次之,高氮下增幅最小。可见水分胁迫对玉米根长、根系比表面积表现为促进效应。这表明玉米通过自身调节作用增强抗旱性,但中度水分胁迫增加施氮量一定程度抑制了促进效应,加剧了水分胁迫,同时水分胁迫还会导致根干重降低,这与以往的研究结果一致[20],而且高氮处理下降低幅度大于低氮处理。无论是水分胁迫下根干重降低或水分胁迫下增施氮素,根干重下降幅度增加均可能与地上部叶片光合作用的减弱有关[20],因为光合碳同化能力的削弱,减少了同化物的积累以及向地下部的运输,进而抑制了根系生物量的积累,造成根干重减小,同时也可能促进根系的衰老,引起根系活力下降。而且,轻度水分胁迫或中度水分胁迫下,高氮的根长、根系比表面积、根干重均低于低、中氮处理。可见,水分胁迫下施氮对根系的生长产生抑制效应,根长的缩短不利于吸收更多的水分和养分;根系比表面积反映了单位体积根系活性吸收面积,是评价植物根系活力的重要依据,其下降表明了根系活性吸收面积减小,因此无论根长减小或根系比表面积下降均不利于植株抗旱。较以往研究,本研究表明,土壤水分胁迫条件下增施氮肥不仅无法提高根系活力、优化根系性状,缓解干旱胁迫对玉米的影响,反而加剧了胁迫程度,这与本研究水分胁迫条件下地上部分玉米叶片对不同施氮量的光合生理响应相符。
此外,根水势和根ABA 是根系重要的水力信号和化学信号,水分胁迫下玉米根区水分条件限制了根系吸水,导致根水势降低,而根水势的降低有助于减少根系失水,有利于植株抵御干旱。中度水分胁迫下,根水势随施氮量增加而进一步降低,表明此时根系水分条件较单独中度水分胁迫处理时更加严峻。此外Wang 等研究发现,ABA可能与植株氮素营养有关[40]。但本研究表明,根系ABA 浓度既不受水分处理的影响,也不受氮素处理的显著影响,这可能与干旱后期玉米根系的衰老有关。
3.2 结论
水分胁迫促进根长、根系比表面积增加,有利于植株抗旱;而水分胁迫下,增施氮肥不仅未缓解水分胁迫,反而抑制根长、根系比表面积增加,加剧了根系的水分胁迫,导致根水势降低,从而影响了地上部分叶片的Gs,削弱了叶片的光合性能即降低了叶片对CO2、光的利用能力和最大光合能力,这些气孔因素和非气孔因素最终抑制了光合作用,导致光合碳同化能力降低,影响了根系生物量的积累。因此,在干旱和土壤贫瘠地区,玉米生产应该严格控制施氮量,不宜施氮过高,避免加剧水分胁迫程度,降低光合作用导致作物死亡或减产。

