肝细胞肝癌复发前后CD3高表达T淋巴细胞的变化
金方方, 金子铮, 刘 宁, 娄金丽
(首都医科大学附属北京佑安医院临检中心,北京 100069)
肝细胞肝癌(hepatocellular carcinoma,HCC)占原发性肝癌的90%以上,居我国恶性肿瘤病因的第4位,肿瘤致死病因的第3位,全球每年有50%以上的HCC新发病例和死亡病例发生在我国[1-2]。HCC起病隐匿、早期症状不典型,多中心发生,发现时多处于中晚期且伴随不同程度的肝硬化,手术切除率低,具有易早期播散、转移的特点。目前,临床常用的HCC治疗方法有手术切除、肝动脉导管化疗栓塞、射频消融、肝移植等。这些治疗方法虽然能去除局部的病灶,但远期效果并不十分理想,术后5年复发率高达75%[3],术后5年生存率仅为30%~40%[4]。因此,寻找与肝癌术后复发相关的指标有助于尽早发现复发的肿瘤,改善患者预后。在外周血单个核细胞中有一类具有CD3高表达现象的T淋巴细胞(CD3brightT细胞),该群细胞分布广泛,具有反应迅速、升高明显、增殖能力强、持续时间长等免疫反应特点,与感染及肿瘤的发生、发展密切相关[5]。本研究拟探讨CD3brightT细胞在HCC患者术后复发中的提示作用,为HCC临床诊疗提供依据。
1 材料和方法
1.1 研究对象
选取2013年1月—2018年6月首都医科大学附属北京佑安医院确诊为HCC的患者69例,其中男53例、女6例,年龄49~72岁;69例患者中,有47例患者接受抗病毒治疗,22例患者未接受抗病毒治疗。TNM分期Ⅰ期19例、Ⅱ期32例、Ⅲ期8例。所有患者均有完整的病历资料及长期门诊复诊或住院治疗记录,具体时间间隔为:术后半年内每月复查1次肝脏电子计算机断层扫描(computed tomography,CT)或B超、甲胎蛋白(alpha-fetoprotein,AFP)、肝功能,半年后每3个月复查1次,2年后每6个月复查1次,以术后5年或死亡为研究终点。复发以影像学诊断为准,如B超、CT、磁共振成像(magnetic resonance imaging,MRI)、肝动脉造影等,单纯AFP升高不作为复发的标准。所有患者术前均有乙型肝炎病史,均无糖尿病、甲状腺功能异常以及自身免疫性肝病等自身免疫性疾病史,且均未进行过免疫治疗。根据临床资料统计患者5年内的复发情况:5年内复发52例,未复发17例。
1.2 病例入选、排除标准
入选标准:经术后病理或肝穿刺病理活检确诊为HCC的患者。排除标准:肝功能异常(术前Child-Pugh分级为C级);术前有感染,如肺炎、腹膜炎、尿路感染等;术后病理或肝穿刺病理活检未证实为HCC;失访。
1.3 方法
1.3.1 治疗方法 根据HCC临床分期及肝功能情况,经临床术前准备、保肝治疗后,行肝叶切除、肝叶不规则切除或介入(肝动脉化疗栓塞、射频消融)治疗。
1.3.2 相关指标的检测 分别采集所有患者术后1个月、复查及复发时的静脉血4 mL,乙二胺四乙酸抗凝,充分混匀,采用荧光抗体CD3-藻红蛋白花青苷5(phycoerythrin cyanin 5,PeCy5)、CD8-藻红蛋白-德克萨斯红(phycoerythrin and Texas red tandem,ECD)、CD4-藻红蛋白(phycoerythrin,PE)(美国BD公司)标记淋巴细胞,用溶血剂溶解红细胞,离心,弃上清,用磷酸盐缓冲液(phosphate-buffered saline,PBS)洗2次,采用BD FACS Calibur流式细胞仪(美国BD公司)进行检测。采用Kaluza Analysis软件(美国Beckman Coulter公司)分析CD3+T细胞、CD4+T细胞、CD8+T细胞分别占总T细胞的百分比(CD3%、CD4%、CD8%),计算CD4/CD8比值。设门圈出CD3brightT细胞占CD3+T细胞的百分比(CD3bright%)。同时采用cobas e601全自动免疫分析仪(瑞士罗氏公司)及配套试剂(电化学发光法)检测血清AFP水平。
1.4 统计学方法
采用SPSS 22.0软件及GraphPad Prism 7软件进行统计分析。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,组间比较采用非参数Mann-Whitney U检验。采用Logistic回归分析(前向逐步法)评估各项目对HCC复发的提示作用。以P<0.05为差异有统计学意义。
2 结果
2.1 CD3bright T细胞表型特征分析
CD4+CD8双参数设门显示CD3brightT细胞不表达CD4分子,少部分表达CD8分子,主要为CD4-CD8-T细胞。见图1。
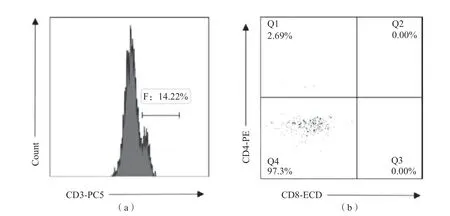
图1 CD3bright T细胞表型特征分析
2.2 复发组与未复发组各项指标的比较
复发组AFP、CD4%、CD8%高于未复发组(P<0.01),CD3bright%低于未复发组(P<0.01)。CD3%和CD4/CD8比值2个组之间差异均无统计学意义(P>0.05)。见表1。
2.3 HCC复发患者术后及复发时各项指标的比较
与术后比较,复发时患者血清AFP水平明显升高(P<0.01)、CD3bright%降低(P=0.04),其他指标2个组之间差异均无统计学意义(P>0.05)。见表2。
2.4 AFP、CD3%、CD4%、CD8%、CD4/CD8比值及CD3bright%与HCC术后复发的关系
单变量Logistic回归分析结果显示,AFP、CD3%、CD8%及CD3bright%与HCC术后复发有关[比值比(odds ratio,OR)分别为1.012、1.033、1.048和0.841,95%可信区间(confidence interval,CI)分别为1.001~1.023、1.006~1.060、1.016~1.081、0.785~0.900。
多变量Logistic回归分析结果显示,AFP、CD3bright%与HCC术后复发独立相关(OR值分别为1.012和0.841,95%CI分别为1.001~1.023和0.783~0.902)。见表3。

表1 复发组与未复发组各项指标的比较 M(P25~P75)

表2 复发患者术后及复发时各项指标的比较 M(P25~P75)
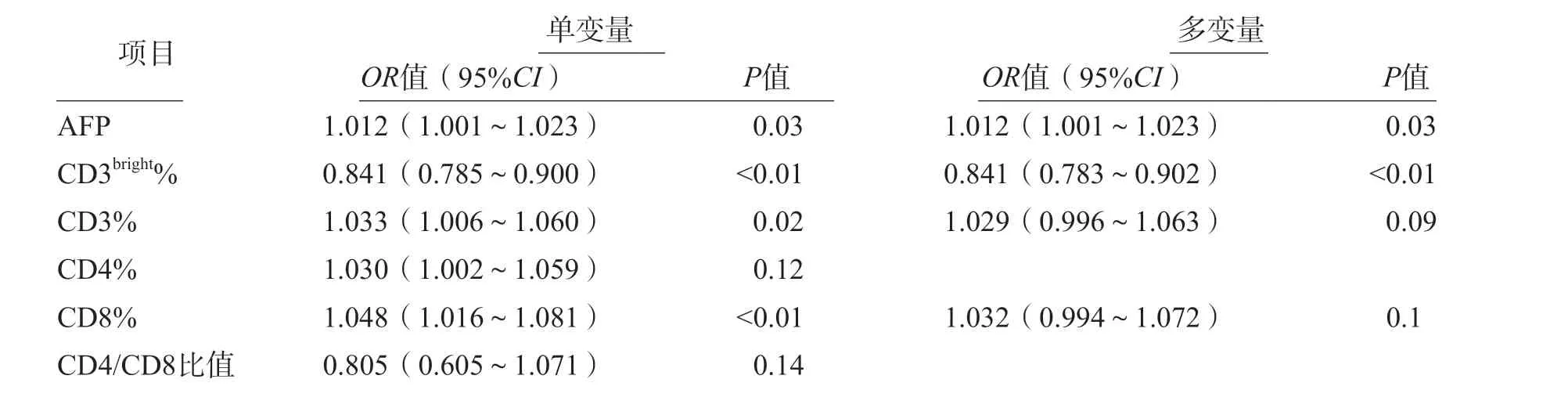
表3 AFP、CD3%、CD4%、CD8%、CD4/CD8比值及CD3bright%与HCC术后复发的单变量和多变量Logistic回归分析结果
3 讨论
HCC的发生、发展与机体的免疫功能密切相关,针对HCC的免疫学研究一直是重点和热点。以T细胞为主导的细胞免疫反应在HCC患者免疫监视、杀伤和调节中扮演着重要角色。T细胞主要分为CD4+T细胞亚群和CD8+T细胞亚群。CD4+辅助T细胞可直接或通过分泌细胞因子,如干扰素-γ(interferon gamma,IFN-γ)、干扰素-α(interferon alpha,IFN-α)等起杀伤肿瘤细胞的作用[6]。CD8+细胞毒性T细胞和CD4+细胞毒性T细胞分别通过人类白细胞抗原Ⅰ类和Ⅱ类实现对肿瘤细胞的监视及杀伤作用。抗肿瘤T细胞数量减少和功能障碍可减弱机体对肿瘤细胞的杀伤作用,抑制性调节T细胞数量增加可抑制机体免疫功能,导致肿瘤细胞发生免疫逃逸[7-8],促进肿瘤的复发与转移。由此可见,T细胞亚群在HCC的发生、发展中发挥着重要作用,但与HCC复发的关系尚不明确。本研究结果显示,复发组CD4%、CD8%高于未复发组(P<0.01),CD4/CD8比值差异无统计学意义(P>0.05)。提示CD4/CD8比值虽可在一定程度上反映HCC患者免疫系统的紊乱,但对于复发的提示作用有限。
根据T 细胞表面C D 3 分子的表达可区分C D 3brightT 细胞亚群。C D 3brightT细胞亚群在健康人群中普遍存在,有8 0%~8 4%的人均可检测到该细胞群,占外周循环中T 细胞的3.1 5%±2.6 0%[5,9]。本研究结果显示,HCC患者CD3brightT细胞主要为CD4-CD8-T细胞,与文献报道一致[5,9]。PAGET等[10]对纯化的CD3brightT细胞进行特征分析,CD3brightT细胞为γδT细胞,主要分布于皮肤及黏膜等屏障部位,在早期防御病原体中发挥重要作用。CD3brightT细胞还共表达趋化因子受体6(chemokine receptor 6,CCR6)和趋化因子受体2(chemokine receptor 2,CCR2)。当发生炎症时可通过下调白细胞介素(interleukin,IL)-23介导的稳态受体CCR6,驱动CD3brightT细胞快速聚集到远处的炎症部位,参与屏障部位以外的免疫反应[11]。CD3brightT细胞在肿瘤的进展中也扮演着重要角色。作为固有免疫细胞,CD3brightT细胞可通过提供IFN-γ等炎性细胞因子发挥抗肿瘤作用[12-13]。目前,对IL-17介导的促肿瘤学说尚存在争议。有研究结果显示,CD3brightT细胞可通过分泌IL-17,促进肿瘤部位血管的生成及肿瘤细胞的生长转移[14]。还有研究结果显示,IL-17可通过促进肿瘤部位中性粒细胞的浸润与活化而抑制肿瘤的生长[15]。BAO等[16]的研究结果显示,非小细胞肺癌患者外周血中CD3brightT细胞水平低于健康人。本研究结果显示,术后5年内复发的HCC患者外周血CD3brightT细胞水平显著低于未复发患者,且在复发时进一步降低。多变量Logistic回归分析结果显示,AFP、CD3bright%与HCC术后复发独立相关(OR值分别为1.012和0.841,95%CI分别为1.001~1.023和0.783~0.902)。较低的CD3brightT细胞水平与HCC较差的预后及高复发率相关,具体机制还有待进一步研究。
总之,较低的CD3brightT细胞水平与HCC较差的预后及较高的复发率有关。对CD3brightT细胞在HCC患者免疫抑制状态中的作用进行研究有助于为HCC患者的免疫治疗提供新的靶点。由于本研究为回顾性分析,且回顾时间为5年,可持续跟踪的病例数有限,因此有关CD3brightT细胞在HCC中的作用还有待进一步深入研究。

