水解羽毛粉最佳酶解条件的研究
陈 明,李 艳,朱爱萍,唐 芯,周 慧
(江苏农牧科技职业学院,江苏 泰州 225300)
随着规模化养禽业的迅速发展,每年被废弃的羽毛越来越多,不仅造成了一系列环境污染的问题,而且也造成了蛋白源的大量浪费。羽毛的合理加工应用能很好的解决上述问题。羽毛中85%~90%为角蛋白,含有大量的色氨酸、谷氨酸、甘氨酸和甲硫氨酸等[1]。但其是一种硬蛋白,分子结构中含有丰富的二硫键和氢键,结构稳定,很难被动物消化吸收。所以,羽毛粉不能直接用于动物饲料中,必须经过一定的处理,破坏角质蛋白的稳定结构,才能被动物消化吸收利用。国内外处理羽毛的加工工艺主要包括:高温高压水解法、酶解法、微生物发酵法、酸(碱)解法、膨化法。其中酶解法多于水解法结合[2]。角蛋白是一种中性缓冲不溶性多肽,一般的蛋白酶(胃蛋白酶、胰蛋白酶等)很难将其分解[3]。本试验选用水解羽毛粉为原料,采用角蛋白酶对其降解,对酶解条件(加酶量、水解时间、pH以及水解温度)进行研究,以期为水解羽毛粉工业化酶解提供参考。
1 试验材料
1.1 试验原料
水解羽毛粉(购于连云港万事兴饲料有限公司)、角质蛋白酶、牛血清蛋白、85%磷酸、95%乙醇、考马斯亮蓝G-250。
1.2 试验器材
电子分析天平(FA1104,上海舜宇恒平科学仪器有限公司)、连续式离心机(DL-5C,上海安亭科学仪器厂)、恒温干燥箱(DHG-9101,江苏金怡仪器科技有限公司)、温控水浴锅(HH-S,金坛市城东新瑞仪器厂)、pH酸度计(STARTER2100,上海毅畅实业有限公司)。
2 试验方法
2.1 试剂配制
蛋白质染色剂和标准蛋白质溶液作为比色空白对照,两种试剂配取方式参照张永彬方法[4]。
2.2 控制酶解条件单一变量因素
为确定角质蛋白酶最大活力,将单一变量分别设为温度、加酶量、水解时间及pH。利用考马斯亮蓝G-250染色,在波长595 nm的条件下测定酶解后产品的吸光度,从而对比吸光度值得出最佳的酶解条件,每个单因素试验进行5个梯度进行试验,取每个梯度的平均值从而减小试验误差。
2.2.1 温度对水解羽毛粉吸光度的影响
称取水解羽毛粉0.5 g,倒入50 mL蒸馏水,pH 6.86,加酶量0.01 g,水解时间为5.5 h,水浴锅温度分别设为50、55、60、65、70和75℃,以标准蛋白质溶液作为空白对照,测出水解羽毛粉的吸光度值。
2.2.2 加酶量对水解羽毛粉吸光度影响
称取水解羽毛粉0.5 g,倒入50 mL蒸馏水,pH 6.86,水解温度60℃,水解时间为5.5 h,加酶量分别设为0.01、0.012 5、0.01 5、0.017 5、0.02和0.022 5 g,以标准蛋白质溶液作为空白对照,测出水解羽毛粉的吸光度。
2.2.3 水解时间对水解羽毛粉吸光度影响
称取水解羽毛粉0.5 g,倒入50 mL蒸馏水,pH 6.86,加酶量0.01 g,水解温度60℃,水解时间分别设为5、5.5、6、6.5、7和7.5 h,以配制的蛋白质溶液作为空白对照,测出水解羽毛粉的吸光度。
2.2.4 pH对水解羽毛粉吸光度影响
称取水解羽毛粉0.5 g,倒入50 mL蒸馏水,加酶量0.01 g,水解温度60℃,水解时间为5.5 h,pH 分 别 设为 4.04、 5.42、 6.86、 7.59、 8.24 和9.18,以标准蛋白质溶液作为空白对照,测出水解羽毛粉的吸光度。
2.3 水解羽毛粉的测定
水解结束后样品放入离心机以3 000 r·min-1的速度离心10 min;离心结束后先取上清液0.6 mL加入具塞试管中,然后加入0.4 mL水,最后加入配好的考马斯亮蓝G-250试剂5 mL,摇匀静置3 min,在波长595 nm条件下测得产品的吸光度值。
2.4 羽毛蛋白降解率的计算及其验证
称取水解羽毛粉Ag放入离心管中,再称取水解羽毛粉和离心管的总质量为Bg,按照最佳的酶解条件进行水解,即:加酶量0.015 g、水解时间6 h、水解温度65℃及pH 6.86进行水解。水浴取出后放入离心机以3 000 r·min-1离心10 min,测定其吸光度;后除去上清液,将沉淀和离心管一起烘干后的称总质量为C,计算羽毛蛋白降解率,计算公式见式1。
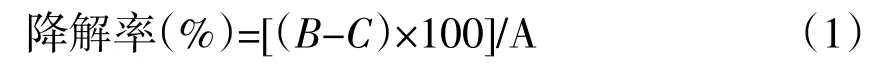
空白对照:称取水解羽毛粉Dg放入离心管中,再称取水解羽毛粉和离心管的总质量为Fg,水解时不加酶按照水解时间6 h、水解温度65℃及pH 6.86进行水解。水浴取出后放入离心机以3 000 r·min-1离心10 min,后除去上清液,将沉淀和离心管一起烘干后称总质量为G,计算方式同上,得出羽毛蛋白的降解率与加酶得出数据进行对比,计算公式见式2。

2.5 统计分析
试验数据用Excel进行初步处理,再用SPSS20.0软件进行统计分析和T检验,结果以“平均值±标准误”表示。
3 结果与分析
3.1 不同温度对水解羽毛粉吸光度影响
不同温度对水解羽毛粉吸光度影响见表1。
由表1可知,水解温度不同,水解羽毛粉的吸光度值不同。水解温度为65℃时,吸光度值为0.54,数值最大。随着温度升高,吸光度呈下降趋势。不同水解温度,吸光度值65℃与其他温度比较,差异极显著(P<0.01)。
3.2 不同加酶量对水解羽毛粉吸光度的影响
不同加酶量对水解羽毛粉吸光度的影响见表2。由表2可知,不同加酶量下,水解羽毛粉的吸光度值不一样。随着加酶量的增加,吸光度值先增加后减小。加酶量为0.015 g时,吸光度值是0.59,数值最大。加酶量为0.015处的吸光度与其他组相比差异均极显著(P<0.01)。

表1 不同水解温度对水解羽毛粉吸光度的影响

表2 不同加酶量对水解羽毛粉吸光度的影响
3.3 不同水解时间对水解羽毛粉吸光度的影响
不同水解时间对水解羽毛粉吸光度的影响表3。
由表3可知,不同水解时间下水解羽毛粉的吸光度值也均不同。随着水解时间的延长,吸光度值先逐渐增大,再呈下降趋势。水解时间6 h时,吸光度值为0.48,且值最大;此处吸光度与其他各处的吸光度值,差异均极显著(P<0.01)。

表3 不同水解时间对水解羽毛粉吸光度的影响
3.4 不同pH对水解羽毛粉吸光度的影响
不同pH对水解羽毛粉吸光度的影响见表4。
由表4可知,不同pH相对应的水解羽毛粉的吸光度值也不同。在pH为6.86时,吸光度值约为0.59且值最大;pH为6.86处的吸光度值与其他pH处的吸光度值比较,差异均极显著(P<0.01)。

表4 不同pH对水解羽毛粉吸光度的影响
3.5 蛋白质降解率比较验证
水解羽毛粉和水解羽毛粉蛋白降解率比较见表5。
由表5可知,水解羽毛粉蛋白质降解率和加酶试验组(加酶量为0.015 g、水解时间为6 h、水解温度为65℃、pH 6.86),分别做5次平行,求蛋白质降解率,并进行“T检验”,两者试验结果差异极显著(P<0.01)。

表5 水解羽毛粉和水解羽毛粉蛋白降解率比较
4讨 论
4.1 不同温度对水解羽毛粉吸光度的影响
酶的活性与温度有关,每种酶都有其最适水解温度。在某一水解温度下,有最大的酶活性,温度越低或越高时,都会使酶的活性降低甚至失活。本次试验温度<65℃时,吸光度值随温度的增大而增大,则酶的活力随温度的增长而增大,从而可溶性蛋白含量也越来越大;温度>65℃时,吸光度值随着温度的升高而减小,则酶的活力也越来越小,从而蛋白质降解率越来越小。由此可知,在所设温度梯度中,水解温度为65℃时水解羽毛粉中蛋白质降解率最大,这与梁玥等试验结果是一致的[5]。
4.2 不同加酶量对水解羽毛粉吸光度的影响
本试验结果表明,加酶量<0.015 g时,酶活力随加酶量的增加逐渐增大,吸光度值随着量的增加而增大,蛋白质降解率也越来越大;加酶量>0.015 g时,吸光度值随着加酶量的增大而减小,从而蛋白质降解率越来越小,可能是因为加酶量超出一定范围,产生了竞争性抑制。
4.3 不同水解时间对水解羽毛粉吸光度的影响
试验中,水解时间<6 h时,吸光度值越来越大,羽毛蛋白降解率随着加时间的增长而增大,6 h之后,吸光度值逐渐减少,代表蛋白质降解率越来越小,可能是蛋白质进一步被降解成氨基酸,使得可溶性蛋白质含量变小的原因。
3.4 不同pH对水解羽毛粉吸光度的影响
pH对酶活力的影响比较大,过度的酸性或碱性都会破坏酶的活力。长时间在碱溶液中加热易导致氨基酸消旋,使其不能与蛋白酶的底物结合位点相结合,降低消化率[6]。本试验中,pH<6.86时,吸光度值随pH增长而升高,则酶的活力随时间的增长而增加,羽毛蛋白降解率也随之增多;而pH>6.86时,吸光度值逐渐降低,则酶的活力随pH增长而减小,羽毛蛋白降解率也随之减少。可能在pH升高时,破坏了酶的结构导致酶失活,从而引起降解率下降,吸光度值也随之减小。
5结 论
验证实验中,加酶条件下的水解羽毛粉蛋白质降解率比普通水解羽毛粉降解率显著提高,差异极显著(P<0.01)。本次试验研究确定水解羽毛粉的最佳酶解条件为:水解温度65℃、加酶量0.015 g、水解时间6 h和pH 6.86。

