改良外科Apgar评分对肝门部胆管癌术后并发症的预测价值
刘俊鹏, 苏 洋
中国医科大学附属盛京医院, 沈阳 110004
肝门部胆管癌是指累及肝总管、左右肝管及其汇合部的胆管黏膜上皮癌[1]。肝门部胆管癌因其解剖结构复杂及浸润生长的特性,预后较差。手术治疗是其唯一可能治愈和长期生存的手段[2-3]。近年来,随着技术的进展及手术操作的提高,肝门部胆管癌的R0切除率及术后生存率有所提高。但因手术切除范围扩大,术后并发症发生率也有所升高[1-2]。在2007年,Gawande等[4]提出了外科Apgar评分(SAS)。通过术中最低心率、最低平均动脉压和估计失血量3项参数,在许多疾病中能很好地预测术后30 d内并发症的发生风险[5-7]。然而术中失血的增多,观察估计的失血量往往会低于实际失血量,因此会降低SAS的准确性[8]。在2016年,Ejaz等[8]发现术中输血的患者术后并发症的发生率明显高于未输血者,并将术中输血情况纳入原评分系统后提出了一种改良外科Apgar评分(mSAS)。多项研究[8-9]表明mSAS能提高对术后并发症的预测能力。目前国内尚无mSAS在肝门部胆管癌中的研究。本文通过对肝门部胆管癌患者的mSAS进行分析,探讨其对肝门部胆管患者术后并发症的预测价值。
1 资料和方法
1.1 研究对象 回顾性分析2013年4月-2019年9月于本院接受外科手术治疗的188例肝门胆管癌患者的临床资料。将其分为并发症组(n=125)和无并发症组(n=63)。纳入标准:(1)经手术治疗,术后结合病理证实为肝门部胆管癌;(2)生化检查、影像学检查、手术记录单、麻醉记录单等资料完整。排除标准:(1)合并有其他消化道恶性肿瘤者;(2)伴有重要脏器功能不全,无法耐受手术者;(3)一般临床资料缺失者。术后胆漏、腹腔出血、术后肝衰竭诊断标准均采用2011年国际肝脏外科小组提出的相应诊断标准[10-12]。本研究方案经由中国医科大学附属盛京医院伦理委员会审批,所纳入患者均已签署知情同意书。
1.2 研究方法 从电子病历中获取患者基本资料、化验结果、手术记录、术后并发症等详细资料。根据麻醉记录单中的术中参数对每个患者进行外科SAS及mSAS评分,并分组进行分析。Ejaz提出的mSAS评分区别在于:当患者术中输血时,“估计失血量”得分将记为0(表1)。
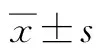
2 结果
2.1 一般资料 188例肝门部胆管癌患者中男125例(66.5%),女63例(33.5%);年龄63(57~67)岁。根据Bismuth-Corlett分型:Ⅰ、Ⅱ型82例(43.6%),Ⅲ、Ⅳ型106例(56.4%)。术后30 d内出现并发症的发生率为66.5%(125/188),其中出现菌血症24例,肺部感染85例,腹腔感染75例,切口并发症36例,胆漏15例,腹腔出血44例,肝衰竭36例,死亡3例。
2.2 肝门部胆管癌术后并发症的危险因素分析 两组患者在CA19-9、Bismuth-Corlett分型、术前黄疸水平、SAS、mSAS、手术方式方面差异均有统计学意义(P值均<0.05)(表2)。
以单因素分析中差异有统计学意义的指标(CA19-9、Bismuth-Corlett分型、术前黄疸水平、mSAS、手术方式)为自变量进行logistic回归分析(赋值见表3),选择前进LR法,纳入变量的标准为0.05,剔除变量的标准为0.10。结果显示自变量包括mSAS、手术方式、术前黄疸水平是影响肝门部胆管癌术后并发症发生的独立因素(P值均<0.05)(表4)。
2.3 mSAS与SAS对术后并发症的预测能力比较 SAS平均分为7.48,而mSAS平均分为6.60。并发症组与无并发症组SAS和mSAS比较差异均有统计学意义(χ2值分别为33.881、65.685,P值均<0.001)(表2)。ROC曲线显示,SAS的AUC为0.776(95%CI: 0.710~0.834)(图1),mSAS的AUC为0.830(95%CI: 0.768~0.880)(图2),差异有统计学意义(Z=1.965,P=0.049)。ROC曲线Younden指数取最大值时,SAS的最佳临界值为7.5,而mSAS的最佳临界值为6.5。mSAS与SAS相比,敏感度从86.3%提高到了96.6%;特异度从53.8%提高到了59.4%;准确度从70.2%提高到了76.6%。

表1 改良外科Apgar评分计算方法
注:1)当患者术中输血时,“估计失血量”得分将记为0;2)出现病理性缓慢性心律失常,包括窦性停搏、房室传导阻滞或分离、房室交界性或室性逸搏心律和心搏停止等情况,此项得分为0。

表2 肝门胆管癌患者术后并发症的单因素分析
注: 1)姑息性切除为非R0切除,其中不包括联合肝脏切除;2)根治性切除指单纯胆管癌切除+肝十二指肠韧带“骨骼化”+胆管空肠Roux-en-Y吻合;3)联合肝脏切除指联合肝叶、半肝或扩大半肝的切除。

表3 logistic回归分析中自变量的分类及赋值

表4 肝门部胆管癌术后并发症危险因素多因素logistic回归分析
注:OR,优势比;95%CI,可信区间。
2.4 mSAS高分组与低分组并发症发生率比较 根据Younden指数,将mSAS分为高分组(≥7分)和低分组(≤6分)。高分组共101例,其中41例(40.6%)出现并发症;低分组共87例,其中84例(96.6%)出现并发症,两组比较差异有统计学意义(P<0.001)。对并发症进一步分析,发现菌血症、肺部感染、腹腔感染、切口并发症、腹腔出血以及术后肝衰竭在两组间差异均有统计学意义(P值均<0.05)(表5)。
3 讨论
肝门部胆管癌手术切除困难,常联合肝叶切除,术后并发症发生率较高,易出现腹腔出血、胆瘘、肝衰竭、感染及其他多器官功能衰竭等并发症[13]。早期识别高危患者,及早采取有效预防手段,是降低术后并发症发生的关键。一旦出现严重并发症时也能够保证有足够医疗资源可以进行处理,使得在有限的医疗资源下取得最大的收益。因此,寻找一种能有效预测术后并发症风险的方法十分重要。
在外科系统中,目前有很多评分系统用来判断患者的预后。但是由于各种原因,目前还没有一个外科评分系统被广泛常规地使用。在1953年,由Virginia Apgar[14]提出了Apgar评分,最早应用于对新生儿的状态评估。在2007年,Gawande等[4]提出了SAS用于评估术后并发症的发生风险来指导术后治疗。SAS优势在于获取参数简单、直接,仅通过术中最低心率、最低平均动脉压和估计失血量3项参数即可做出初步判断。既往研究[8,15-16]证实,SAS是以血液循环为基础的评估系统,仅包括术中失血量1个参数也可对术后并发症的发生做出初步预测。笔者亦将SAS中的3项参数分别与肝门部胆管癌并发症进行相关性研究,结果显示,仅估计失血量与并发症有显著相关性。
虽然SAS在不同的外科领域均被证实具有预测并发症或死亡风险的能力,但仍有不足。在实际临床工作中,估计失血量往往难以准确判断,所以部分学者对SAS的准确性提出了质疑。为了提高准确性,有学者对其进行了一定的修改。比如Jering等[17]将SAS与ASA评分进行了联合应用,其预测能力明显比两者单独使用要高。Janowak等[15]和Miki等[16]在研究SAS在胃切除术和食管切除术的术后风险评估中,分别将术中失血量的评分划分进行了修改,发现能够较好预测术后风险。
2016年Ejaz等[8]将术中输血情况纳入原评分系统后提出了一种mSAS。Ejaz等发现术中输血与多个因素相关,除了术中失血量外,还与血流动力学稳定性、术前和术中血红蛋白水平以及终末器官灌注情况等有关。也许正是在这多种因素共同作用下最终才决定术中输血,因此mSAS并不仅仅解决了估计失血量不准确的问题,它能更加准确的反映患者术中情况。Janowak等[15]的改良法仅是针对不同疾病的出血量进行了重新划分,而Ejaz的改良法则是在纳入术中输血情况后对患者术中情况做出更为全面准确的评估。所以Ejaz改良法较Janowak改良法更加适用,Ejaz改良法具有更高的预测价值。

图1SAS的ROC曲线

图2 mSAS的ROC曲线

表5 mSAS高分组与低分组术后并发症比较[例(%)]
本研究中患者并发症的发生率为66.5%,其中感染、腹腔出血、肝衰竭是主要的并发症。本研究结果提示,mSAS与肝门部胆管癌患者术后总体的并发症显著相关,表明mSAS可以预测肝门部胆管癌术后并发症的发生,尤其是菌血症、感染、肝衰竭,但是无法预测胆漏的发生。
本研究在探讨mSAS与肝门部胆管癌术后并发症的同时考虑了性别、年龄、BMI、Bismuth-Corlett分型、CEA、CA19-9、黄疸情况、Alb水平、手术时间、手术方式等因素对并发症的影响,结果显示:联合肝切除、术前重度黄疸的患者术后并发症的发生率明显升高。扩大范围切除、术前黄疸是术后并发症发生的独立危险因素。与既往研究[18]认为年龄和术前Alb水平是肝门部胆管癌术后并发症的危险因素不同,本研究未得出该结论,这可能与严格的术前筛选及干预有关。
本研究所选取的病例仅限于同一地区的一家医院,研究结果未必普遍适用于所有肝门部胆管癌手术患者;本研究中可能存在未被考虑的混杂变量,它们是今后研究的考虑因素;本研究的样本量有限,死亡病例和多并发症的发生例数较少,导致这些并发症的发生风险与mSAS的关系无法明确。因此后续还需要大样本、前瞻性、多中心研究来更好地探索mSAS在肝门部胆管癌手术中的应用价值。
综上所述,mSAS适用于肝门部胆管癌术后并发症的预测,在临床工作中具有一定的应用价值。

