microRNA-21靶向调控Wnt2基因对肝癌细胞HepG2增殖与迁移的影响
王泽鑫, 关利君, 李建明, 王志超, 薛梦若, 秦孝军
内蒙古医科大学附属医院 介入放射科, 呼和浩特 010050
肝癌为目前全球范围内最为常见的恶性肿瘤之一,每年约有60万人死于肝癌,近10年来,随着现代诊断技术以及外科手术的不断发展和进步,肝癌的临床诊断和外科手术治疗已经取得了长足的进步[1]。但肝癌发病较为隐匿,患者早期临床症状无特异性,大部分患者临床确诊时已经处于疾病中晚期,失去了手术治疗的机会,患者5年生存率较低[2-3]。研究[4]表明,microRNA-21(miR-21)与肝癌的发生发展、侵袭和转移密切相关,但miR-21对肝癌的具体调控机制尚不明确。Wnt信号通路具有明显的促癌作用,与多种恶性肿瘤的发生发展有关,而Wnt2是Wnt信号通路中一种重要的信号转导因子,研究[5]证实,在恶性肿瘤细胞中Wnt2蛋白高表达,可促进肿瘤细胞的增殖。miR-21是否通过Wnt信号通路影响肝癌细胞的增殖和转移,目前尚无相关报道。本研究拟探讨miR-21靶向调控Wnt2基因对肝癌细胞HepG2增殖与迁移的影响。
1 材料与方法
1.1 细胞来源 胚肾细胞株HEK293、肝癌细胞株HepG2以及正常肝细胞株LO2均购自中国科学院上海生物化学与细胞生物学研究所。
1.2 主要试剂与仪器 DMEM高糖培养基(美国Hyclone公司),青霉素-链霉素混合溶液(美国Hyclone公司),澳洲胎牛血清(美国Thermo公司),0.25%胰蛋白酶(美国Thermo公司),miR-21抑制剂及其阴性对照(上海吉码生物科技有限公司),LipofectaminTM 2000(美国Invitrogen公司),质粒提取试剂盒(美国Invitrogen公司),Trizol(美国Invitrogen公司),兔抗人Wnt2多克隆抗体(武汉中美科技有限公司),Annexin V-FITC/PI细胞凋亡试剂盒(南京凯基生物科技发展有限公司),HRP标记二抗(北京中杉金桥生物技术有限公司),四甲基氮唑盐(MTT,美国Sigma公司),BCA蛋白浓度测定试剂盒(北京碧云天生物技术有限公司)。
1.3 方法
1.3.1 实时荧光定量PCR法检测细胞miR-21表达 使用Trizol提取HepG2细胞以及LO2细胞中总RNA,加入Trizol裂解后使用氯仿/异丙醇处理,收集白色RNA沉淀;75%乙醇洗涤,离心后弃取上清。晾干后采用DEPC水溶解,合成cDNA,并进行实时荧光定量PCR反应,反应条件:95 ℃变性30 s,(95 ℃ 5 s、60 ℃ 30 s)35个循环。以U6作为内参,采用2-△△Ct方法表示miR-21相对表达量。操作严格按照试剂盒使用说明书进行。
1.3.2 细胞转染 转染前1天,将对数生长期的HepG2细胞接种于6孔板内(1×105/孔),待细胞融合度达到60%~70%时,换为无血清的培养基,采用Lipofectamine脂质体法将miR-21抑制剂及阴性对照转染至HepG2细胞,分别作为抑制剂组及对照组。转染48 h后,采用荧光定量PCR检测抑制剂组与对照组miR-21表达水平,miR-21检测方法参照1.3.1,以评价转染效果。
1.3.3 MTT法检测细胞增殖 转染48 h后消化细胞,接种至96孔板内进行细胞培养,培养24、48、72 h,每孔分别加入5 μg/μl MTT溶液,继续培养4 h后加入DMSO,震荡10 min,检测酶标仪490 nm下各孔吸光值,设空白对照判断各孔细胞增殖情况,每组实验重复3次。
1.3.4 流式细胞技术检测细胞凋亡 将HepG2细胞接种于6孔板内转染,转染48 h后,消化收集细胞,采用流式细胞技术检测各组细胞凋亡情况,参照Annein V-FITC/PI细胞凋亡试剂盒使用说明书进行操作,染色15 min后上机检测各组细胞凋亡率,每组实验重复3次。
1.3.5 Transwell实验检测细胞迁移能力 按照上述步骤转染细胞48 h后,常规洗涤、消化,离心5 min(1000 r/min),收集细胞后使用无血清培养基将细胞密度调整为1×106个/ml,取150 μl将其接种于Transwell小室的上室,然后使用含10%胎牛血清的培养基600 μl接种于下室内,培养12 h后,将上室内的细胞使用棉签擦去,95%甲醇固定10 min,PBS洗涤,结晶紫染色30 min,置于倒置显微镜下观察细胞迁移情况。
1.3.6 Western Blot检测蛋白表达 转染48 h后向每孔细胞内加入200 μl蛋白裂解液,冰上裂解30 min后将其转入EP管内,离心10 min(12 000 r/min),取上清并使用BCA蛋白浓度测定试剂盒测定蛋白浓度。每组取等量的蛋白样品→SDS-PAGE凝胶电泳→转膜→5%脱脂奶粉室温封闭→Wnt2一抗封闭过夜(4 ℃)→室温下孵育二抗1 h→ECL化学发光法显色→凝胶成像仪观察,Wnt2蛋白相对表达量以目标条带与内参GAPDH的光密度值表示。
1.3.7 双荧光素酶报告基因实验 构建基因A 3′UTR的双荧光报告质粒,分别在HepG2细胞及HEK293细胞中按照双荧光素酶检测试剂盒说明书进行双荧光报告,使用miR-21抑制剂及其阴性对照转染,以验证miR-21与Wnt2基因的关系。各组相对荧光强度以萤火虫荧光素酶强度/海肾荧光强度比值表示。
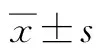
2 结果
2.1 转染miR-21抑制剂对HepG2细胞miR-21表达的影响 HepG2细胞miR-21相对表达水平(1.978±0.035)明显高于LO2细胞(1.586±0.022),差异有统计学意义(t=16.424,P<0.05)。转染miR-21抑制剂后,抑制剂组miR-21相对表达水平(0.857±0.017)较对照组显著降低(1.684±0.039),差异有统计学意义(t=33.669,P<0.05)。
2.2 转染miR-21抑制剂对HepG2细胞增殖、迁移和凋亡的影响 抑制剂组HepG2细胞增殖能力较对照组显著降低(P值均<0.05)(表1)。
抑制剂组穿过Tranwell小室的细胞数(83.72±15.06)显著低于对照组(147.85±20.64),差异有统计学意义(t=4.347,P<0.05)。抑制剂组细胞凋亡率(25.67%±3.95%)明显高于对照组(10.27%±2.14%),差异有统计学意义(t=5.937,P<0.05)(图1)。

表1 转染miR-21抑制剂对HepG2细胞增殖的影响
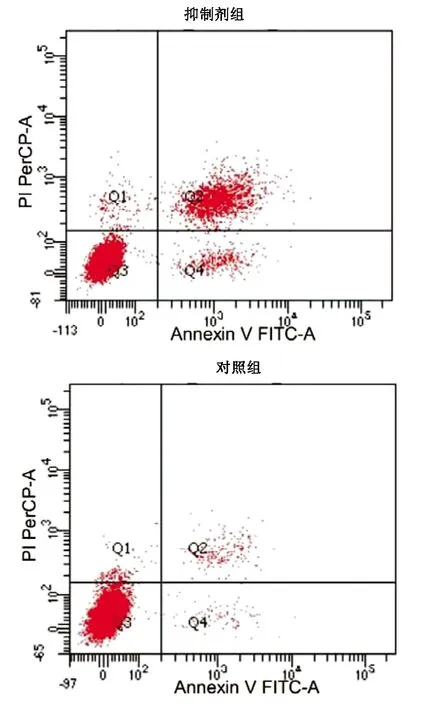
图1转染miR-21抑制剂HepG2细胞凋亡情况
2.3 转染miR-21抑制剂对HepG2细胞Wnt2表达的影响 抑制剂组HepG2细胞Wnt2相对表达水平(0.862±0.127)明显低于对照组(1.306±0.218),差异有统计学意义(t=3.048,P<0.05)(图2)。
2.4 miR-21对Wnt2的靶向调控作用验证 TargetScan软件发现Wnt2可能是miR-21的潜在靶点,miR-21抑制剂可显著抑制野生型Wnt2-3′ UTR质粒转染细胞的荧光素酶活性(0.972±0.102 vs 0.612±0.092,t=4.219,P<0.001),而对突变型Wnt2-3′ UTR质粒转染细胞的荧光素酶活性并无明显影响(0.982±0.093 vs 0.911±0.128,t=0.972,P>0.05)。
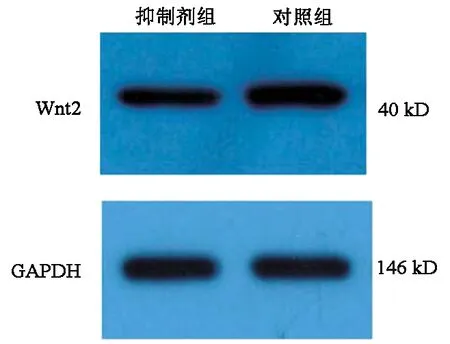
图2 Wnt2蛋白表达的电泳图
3 讨论
microRNA是近年来发现的一类内源性小分子非编码单链RNA,约18~25个核苷酸长度,具有高度保守性[6-7]。microRNA可通过Watson-Crick碱基互补匹配原则对靶mRNA进行降解或抑制翻译来调控蛋白的表达情况[8]。学者[9-10]预测,人类基因中大约有1000个microRNA参与机体30%的蛋白编码基因,在细胞生长、发育、分化以及繁殖等多个方面均发挥着重要作用。越来越多的研究[11-13]证实,miR-21作为一种新的原癌基因,在肿瘤的发生发展中扮演着重要角色。
miR-21位于17号染色体短臂FRA17B脆性区域上,研究证明miR-21在多种肿瘤中表达显著升高,参与癌症相关基因的表达。肝癌作为世界范围内最为常见的恶性肿瘤之一,由于诊断和治疗困难,患者总体预后较差[14]。研究[15]显示,microRNA参与癌细胞免疫逃逸、肿瘤转移以及肿瘤血管的生成过程。临床研究[16]显示,在肝癌组织中miR-21明显升高,并与肝癌患者临床病理特征具有密切联系。本研究结果显示,HepG2肝癌细胞miR-21相对表达水平明显高于正常肝细胞;而转染miR-21抑制剂后,抑制剂组HepG2细胞与对照组比较,miR-21相对表达水平明显降低,表明miR-21在肝癌细胞中呈高表达状态,与学者报道结果[17]相似。miR-21可能是肝癌促癌基因之一,其高表达与肿瘤发生、发展有关。本研究显示,抑制剂组的HepG2细胞增殖、迁移能力明显低于对照组,而细胞凋亡率则明显高于对照组,表明miR-21表达受到抑制后,可有效抑制肝癌细胞的增殖和迁移,同时促进肝癌细胞的凋亡,进一步提示了miR-21与肝癌细胞增殖、迁移等恶性行为有关,与临床报道结果[18]相一致。
Wnt是一种分泌性糖蛋白,相对分子质量约为40 000,在多种组织中均有表达,当细胞外界因素发生变化时,可导致Wnt过度激活,进而发生失调导致机体发育异常甚至形成肿瘤[19-20]。Wnt信号通路在肝癌、胃癌、结直肠癌以及胰腺癌等多种恶性肿瘤中均有一定的促进癌细胞增殖、生长以及转移的作用[21]。Wnt2作为Wnt信号通路中的一种重要分子,研究[22]显示,Wnt2的大量分泌可激活Wnt2-β连环蛋白信号通路,最终促进癌细胞生长,且Wnt2表达与恶性肿瘤侵袭潜能、肿瘤分期及临床分级呈正相关关系。本研究结果显示,抑制剂组HepG2细胞Wnt2相对表达水平明显低于对照组,提示miR-21表达受到抑制后,细胞中Wnt2蛋白表达明显降低,从而可抑制Wnt信号通路的过度激活。采用双荧光素酶报告基因实验进一步证实,Wnt2是miR-21的潜在靶基因,并且miR-21对Wnt2表达存在显著调控作用,表明在肝癌中miR-21可能扮演促癌的microRNA角色。miR-21在肝癌中异常高表达促进Wnt2蛋白的表达,导致Wnt信号通路的激活,促进肿瘤细胞增殖生长以及恶性侵袭的潜能;而抑制miR-21表达,有助于促进肝癌细胞的凋亡以及增殖抑制。miR-21有望成为肝癌治疗的潜在靶点之一[23-24]。
综上所述,抑制miR-21表达可有效抑制HepG2细胞增殖和迁移,促进HepG2细胞凋亡,并抑制Wnt信号通路的过度激活,可能成为肝癌治疗的潜在靶基因之一,值得进一步深入研究分析。

