猪源多杀性巴氏杆菌的分离及毒力基因检测
郭伟娜,胡明静,赵 霞,路振香,顾有方
(安徽科技学院 动物科学学院,安徽 凤阳 233100)
多杀性巴氏杆菌(Pasteurellamultocida,Pm)是健康动物上呼吸道的一种正常寄生性细菌[1],但也是许多动物的潜在病原体,与多种动物的呼吸道综合征有关。当动物机体受到多种应激因素作用时,或者机体的免疫功能低下,主要引起猪萎缩性鼻炎、猪肺疫、禽霍乱和牛出血性败血症等多种病症[2-3]。多杀性巴氏杆菌血清型较多,根据荚膜抗原的不同,可分为A、B、D、E和F共5个血清型,根据脂多糖结构不同可分为16个血清型[4]。不同荚膜血清型的Pm可感染猪、禽、牛等多种动物,其中血清型A、B、D均可诱发猪的疾病,其中A和D血清型主要引起猪肺炎,而B血清型引起猪出血性败血症[5];与禽类相关的主要是A血清型,而感染牛的主要是A和D血清型。
多杀性巴氏杆菌的致病性与多种毒力因子有关,主要包括皮肤坏死毒素、黏附素、铁摄取蛋白、外膜蛋白、唾液酸酶等[6]。其中皮肤坏死毒素是由toxA基因编码,与黏附素相关的编码基因包括ptfA、fimA、flp1、flp2、hsf1和hsf2等,与铁摄取蛋白有关的编码基因有tonB、exbB、exbD、tbpA、hgbA、hgbB、Fur等,与外膜蛋白有关的编码基因有ompA、ompH、oma87、plpB等,编码唾液酸酶的基因主要为nanB和nanH。多杀性巴氏杆菌的致病性与病原菌的毒力、数量、侵入途径以及机体的免疫力和环境因素等有关,而含有毒力因子不同对其致病性有重要作用。目前,我国的猪病发生多表现为混合感染,及时检出隐性带菌的动物,对猪场疾病的防控有重要意义。因此,本研究主要是采集安徽凤阳地区某猪场的鼻拭子进行Pm的分离,用PCR方法检测分离菌株的23个毒力基因,从而为研究多杀性巴氏杆菌的致病性提供一定参考。
1 材料与方法
1.1 材料
荚膜血清A型猪源Pm(CVCC401,中国兽药监察所);实验用清洁级昆明小鼠及垫料(合肥博源动物实验有限公司);血琼脂培养基(常德比克曼生物科技有限公司);PCR MasterMix,5×TAE缓冲液,DL-2000 DNA Marker等(南京迈克沃德生物科技有限公司)。
1.2 方法
1.2.1 样品采集 于2019年9月从安徽凤阳某规模化养猪场无菌采集育肥猪的鼻拭子样品30份。采集后的拭子样品置于已灭菌的PBS中浸润,做好标记,用冰袋保存快速送实验室进行培养。
1.2.2 Pm的分离纯化 将鼻拭子样品分别接种于普通营养琼脂、麦康凯培养基和血琼脂培养基,37 ℃培养24 h,然后挑取符合Pm特征的单个菌落接种到血琼脂培养基上进行纯化,对纯化后的单个细菌用美蓝染色镜检。
1.2.3 模板的制备 挑取纯化后的单个菌落溶于50 μL无菌超纯水中,用煮沸法提取核酸作为模板,于-20 ℃保存备用。
1.2.4 引物合成 参考相关文献中Pm的16S rRNA引物序列[7],以及其23个毒力基因的引物序列[8],由安徽通用物有限公司合成引物,引物序列及目的片段大小见表1。

表1 引物序列及目的片段大小Table 1 The primer sequences and size of target fragments
1.2.5 16S rRNA的PCR扩增及测序 PCR反应体系为50 μL:2 μL模板、25 μL的2× PCR MasterMix、10 μmol/L的上游引物和下游引物各2 μL、19 μL超纯水。PCR反应条件为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物用1.5%的琼脂糖凝胶电泳检测是否扩增出目的条带,将有目的条带的PCR产物送至安徽通用生物有限公司进行测序分析。
1.2.6 毒力基因的PCR检测 PCR方法检测分离菌株的23个毒力基因,其反应体系同1.2.6节,退火温度调整为51 ℃,其它反应条件一致。用琼脂糖凝胶电泳检测PCR扩增产物,并将有目的条带的PCR产物送测序分析。
1.2.7 小鼠致病性试验 选用12只清洁级雌性昆明小鼠,分为实验组和对照组2组,每组6只小鼠。用纯化后的分离菌株复苏培养至对数生长期,实验组小鼠每只腹腔接种0.2 mL纯培养物;对照组用0.2 mL生理盐水进行腹腔注射。接种后每隔一段时间观察并做好记录。
2 结果与分析
2.1 病原菌的分离及染色结果
从鼻拭子样品中分离纯化的菌株在血琼脂培养基上可观察到圆形、光滑、湿润、半透明的灰白色小菌落(图1),而在普通营养琼脂和麦康凯培养基上不生长,与多杀性巴氏杆菌的培养特点一致。该分离菌株用美蓝染色镜检,可见典型的两极浓染的短球杆菌(图2),符合多杀性巴氏杆菌的染色特征。由以上分离及染色结果初步判定该分离菌为多杀性巴氏杆菌,但仍需结合后续分子鉴定结果。

图1 分离菌在血琼脂培养基上的菌落形态Fig.1 Colony morphology the isolated bacteria on blood agar medium

图2 分离菌的美蓝染色镜检结果(×1 000)Fig.2 Methylene blue staining microscopy results of the isolated bacteria
2.2 16S rRNA的PCR扩增结果
16S rRNA的PCR扩增结果显示Pm分离株检测出425 bp的目的条带,与Pm标准菌株一致(图3)。PCR产物的测序结果表明,分离菌与多杀性巴氏杆菌菌株VP161(Genbank登录号:CP048792)的同源性为99.52%。
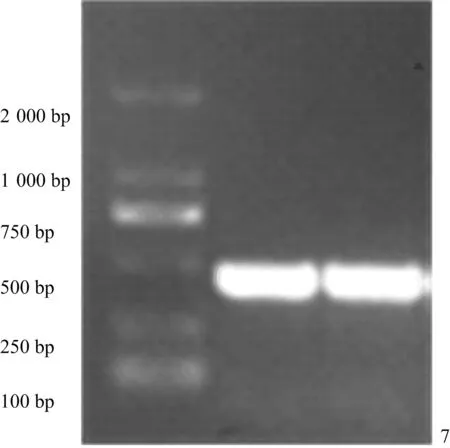
图3 16S rRNA的PCR扩增结果Fig.3 The results of PCR amplification for 16S rRNA
2.3 毒力基因的PCR检测结果
分离菌的23个毒力基因的PCR扩增结果中,除了toxA、hgbB、nanB、hsf1、tbpA等5个基因未扩增出目的条带,其余的18个毒力基因均检测出目的条带 (图4~5),PCR产物的测序结果表明,其与Pm相应毒力基因的同源性位于98.82%~100%之间,具体见表2。

图4 毒力基因的PCR扩增结果Fig.4 The results of PCR amplification for virulent genes注:1~12分别是ptfA、fimA、pfhA 、tadD、toxA、sodA、sodc、ompA0、ompH、oma87、plpB、exbB基因。

图5 毒力基因的PCR扩增结果Fig.5 The results of PCR amplification for virulent genes注:13~23分别为exbD、tonB、hgbA、hgbB、Fur、nanB、nanH、hsf1、hsf2、tbpA、pmHAS基因。
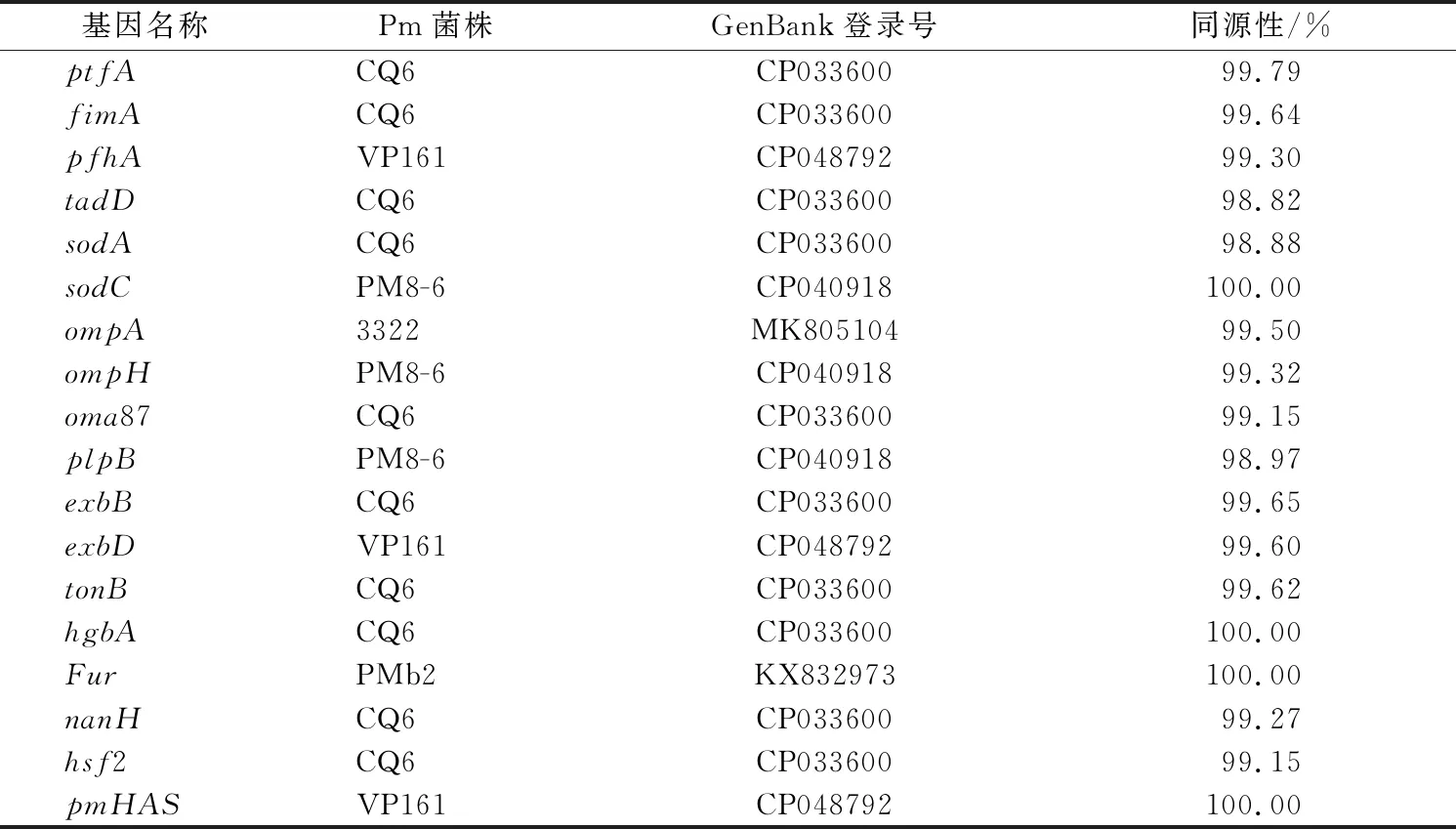
表2 毒力基因同源性比对结果Table 2 The identity comparison of virulence genes
2.4 小鼠致病性试验结果
接种后发现,实验组小鼠有精神萎靡、食欲不振等症状,于接种后的18 h内全部死亡,而对照组小鼠表现正常。剖检病死鼠发现,其心脏、肝脏和肺脏均有出血,从病变组织中再次分离到Pm菌株,并且其菌落特征和染色结果均与原分离株相符,后经16S rRNA的PCR扩增及序列测定,证实与原分离株相同。
3 结论与讨论
黏附素是病原菌一种潜在的毒力因子[9]。研究发现,fimA、pfhA和ptfA等黏附相关基因在Pm中的携带率较高[10-11],本研究也检测出fimA、pfhA和ptfA这3个毒力基因,其序列与Pm相应毒力基因的同源性分别为99.64%、99.30%和99.79%。Pm所含的铁摄取相关蛋白和外膜蛋白等在病原菌感染过程中同样发挥重要作用[12]。从中国、巴西和越南分离的猪源Pm菌株中铁摄取蛋白相关基因exbB和exbD均有较高的携带率[10,13-14],本研究也检测出这2个毒力基因,其序列与Pm对应基因的同源性分别为99.65%和99.60%。Khac等[14]研究发现,81个猪源Pm菌株中外膜蛋白基因ompA、ompH和oma87的检出率分别为56.62%、68.67%和100%,本研究共检测出ompA、ompH、oma87和plpB等4个外膜蛋白基因,其序列与Pm对应基因的同源性分别为99.50%、99.32%、99.15%和98.97%。tbpA基因编码一种转铁结合蛋白A,是与铁摄取相关的一种受体,有研究表明,该受体主要存在于牛、羊等动物源Pm[15]。本研究未检测出tbpA基因,分析可能是该基因不存在于猪源Pm中。toxA基因编码的皮肤坏死毒素可引起鼻甲骨的溶骨作用,是猪传染性萎缩性鼻炎的主要致病因子[16],多数研究表明[6,10,13],主要是D血清型的Pm含有toxA基因,而A血清型不含有该基因。本试验中的Pm菌株没有检测出toxA基因,经后期鉴定为A血清型,与以上结果一致。
本研究从安徽凤阳某猪场采集的鼻拭子中分离到1株Pm,并检测出18个毒力基因,同时致病性试验表明该分离菌株对小鼠有致死性,这对该猪场的疾病防控提出了预警,也为猪源多杀性巴氏杆菌的致病性研究提供一定参考。本试验中样品采集的时间在2019年9月份,外界气温较高,样品采集、保存和运输过程等都会受到一定影响。另外,猪场环境因素对Pm的检出也有一定促进作用,如猪舍的温度、湿度、通风条件、卫生消毒等饲养管理措施不严格都会引发疾病。由此可知,猪场的环境卫生条件及管理对猪病特别是一些条件致病菌的防控及其关键,每个猪场均需制定严格的饲养管理制度和卫生消毒措施,减少应激因素才能较好地控制疾病的发生。

