荒漠植物中总脱氧核糖核酸分子的提取方法
赵 昕,张继伟,陈国雄,李玉霖
(中国科学院 西北生态环境资源研究院 甘肃省寒区旱区逆境生理与生态重点实验室,甘肃 兰州 730000)
为研究植物核酸分子在生命活动中的作用,常常需要从不同的生物材料中提取核酸.核酸的主要组分为核糖核酸分子(RNA)和脱氧核糖核酸(DNA),其纯品呈白色粉末或结晶.
由于荒漠植物体内含有大量的多糖、多酚、单宁酸和其它次级代谢物,因此荒漠植物具有强抗逆性.现代分子生物学技术的运用对揭示荒漠植物强抵抗逆境的机制及其遗传种质资源的保护具有重要的作用,检测不同环境胁迫下基因表达水平的变化为理解植物的抗逆性提供一些必要的基础数据,高质量DNA的提取是进行分子生物学基因表达研究的必要前提.
DNA提取方法有CTAB法[1]、高盐低pH法[2]、SDS法[3]、蛋白质变性和苯酚抽提法[4]等.然而,已有文献都反映出分离高质足量的DNA存在不同困难,主要表现在植物组织细胞破碎后,释放出大量的多酚、多糖以及其它次级代谢物而干扰DNA的提取.多酚易氧化成多醌而与核酸结合,多糖在低离子浓度缓冲溶液中与DNA结合产生共沉淀,这些都导致DNA产量降低.不同植物组织中多糖、多酚以及其它次级代谢物含量的不同,显著地影响着核酸的抽提及纯化过程,因此研究荒漠植物抗逆机制及DNA提取方法是科技工作者必须解决的一个技术难题.
目前分子生物学实验室常用的经典方法以及各种生物公司出售的提取试剂盒,在针对模式植物拟南芥和水稻等的核酸提取时,效果较好.因为模式植物材料幼嫩、次生代谢产物少,能够保证提取出高品质高产量的核酸产物.但是荒漠高寒植物含有较多的多糖、蛋白质、酚类、萜类等次生代谢产物,采用常规方法提取核酸时,匀浆过程中会释放酚类物质,氧化后与核酸稳定的结合,形成难溶的胶状物.同时萜类化合物和RNase会分别造成核酸的化学降解和酶解.
本文综合各种已知方法的优点,经过改良,确保能够提取到荒漠植物中高品质DNA.本方法不仅能从常见荒漠植物中提取出高质量的DNA,同时也适合于其它富含多糖、多酚以及大量次级代谢物植物DNA的高效提取,如提取水果果实、百合鳞茎中的DNA,具有广泛的应用价值.此方法已经获得发明专利授权[5].
1 试验部分
1.1 仪器
凝胶电泳系统,琼脂糖水平电泳槽DYCP-31DN型(北京六一仪器厂);全自动数码凝胶成像系统380C型(上海培清生物技术有限公司);微量紫外分光光度计Nanodrop2000C型(Thermo-Fisher Sciencific公司).
1.2 试剂
十六烷基三甲基溴化铵(CTAB)、三羟甲基氨基甲烷(Tris)、四乙酸乙二胺(EDTA)、β-巯基乙醇、聚乙烯吡咯烷酮(PVPP 6755)购自美国Sigma公司,琼脂糖(Agarose)等购自兰州鹏程生物科技公司,其他试剂均为国产化学级产品.
1.3 样品
挑选腾格里沙漠南缘沙坡头地区的常见荒漠植物沙米、红砂、珍珠猪毛菜、柠条、沙冬青、油蒿、沙拐枣、沙木蓼、文冠果、花棒、蒙古莸和霸王等植株,取其叶片立即冻存于液氮,贮存在-80 ℃冰箱备用.
1.4 DNA提取准备工作
提取试剂配制所用容器、提取所用研钵、药匙和研杵等用高温灭菌.制备DNA的离心管、枪头等于120 ℃高压蒸汽灭菌20 min后烘干备用.电泳槽和梳子的处理:用去污剂清洗后,用水冲洗并用乙醇干燥,然后装满3%的H202溶液,室温下处理10 min.操作过程中,带手套口罩,无菌超净工作台上提取,研磨迅速,避免DNA受到污染.
1.5 溶液配置
交联聚乙烯吡咯烷酮(PVPP粉末):购自Sigma公司;高压灭菌锅120 ℃ 20 min灭菌后,密封低温保存;前处理缓冲液:200 mmol/L Tris-HCl+50 mmol EDTA+250 mmol/L NaCl +0.5-2%β-巯基乙醇(V/V);提取裂解液:2% CTAB(W/V)+1.4 mol/L NaCl+0.02 mol/L EDTA+0.1 mol/L Tris-HCl+0.2-0.5%β-巯基乙醇(V/V);pH 8.0;有机溶剂有纯化液、异丙醇和乙醇.纯化液组成为酚:氯仿:异戊醇(体积比为25∶24∶1,化学级,市售有机溶剂);异丙醇为100%纯度,分析化学级,市售有机溶剂;75%乙醇(V/V),分析化学级;所有溶液都用高压灭菌处理的超纯水配置.
普通植物DNA提取试剂盒采用离心柱型普通DNA提取试剂盒(货号DP305,北京天根公司).
2 荒漠植物叶片DNA提取
2.1 材料研磨
取荒漠植物叶片大约0.2~0.5 g,置于研钵中,在研钵中直接加上PVPP粉末,加入量为荒漠植物叶片质量的0.5%~2%,充分研磨(可加入液氮),至少研磨三次以上,将样品粉末装入2 mL微量灭菌离心管.
2.2 溶解除糖
加入前处理缓冲溶液,溶解多糖类物质.在研磨好的样品粉末中迅速加入前处理缓冲液500~1 000 μL,涡旋仪上高速混匀,离心机上低速900 r/min离心5 min,弃上清,取沉淀物.
2.3 萃取抽提
在沉淀物中加入500~1 000 μL的CTAB提取裂解液(经60~70 ℃预热),涡旋仪上充分混匀,恒温水浴锅60~70 ℃温浴1 h,充分震荡混匀后高速离心机12 000 r/min离心10 min.抽提DNA清除多糖类产物.
CTAB提取液包含有较高浓度的CTAB(2%)、NaCl(1.4 mol/L)、β-巯基乙醇(0.2%~0.5%)以及25 mmol/L EDTA和100 mmol/L Tris-HCl(pH值8.0).CTAB是一种阳离子去污剂,能溶解细胞膜,对植物细胞具有较好的裂解作用,而且与β-巯基乙醇共同具有对蛋白质的强烈变性作用,使核酸从蛋白-核酸复合物中彻底释放出来.在高离子浓度的NaCl溶液中(NaCl>0.7 mol/L),释放出来的核酸与较高浓度的CTAB(2%,W/V)形成可溶性的复合物,而变性蛋白质与CTAB形成不溶性的复合物,随着氯仿的抽提,蛋白质被去除.同时β-巯基乙醇不但可以作为强还原剂防止多酚氧化,提供pH值为8.0的缓冲环境,还能有效降低多酚物质在酸性条件下被氧化的几率.
2.4 纯化萃取漂洗
取上清液,加入新的2 mL微量离心管,加等体积(800 μL)纯化液混匀,抽提一次,室温下,高速离心机上12 000 r/min离心5 min.
取上清液,加入新的2 mL微量离心管,加入1/2体积、预冷的异丙醇放入冰箱冷冻室,-20 ℃沉淀DNA 30~60 min.
取出2 mL微量离心管,在4 ℃ 12 000 r/min转速离心5~10 min,弃去液体部分,取沉淀用75%乙醇清洗两遍.
2.5 溶解保存
放入通风厨吹干至乙醇充分挥发,加入40~100 μL超纯水溶解,贴标签放入-18 ℃冰箱冷冻室冻存盒保存.
3 结果与讨论
3.1 总DNA完整性检测
每个样品中取3 μL总DNA溶液通过凝胶电泳检测其完整性,其它DNA样品保存在-18 ℃冰箱中.将1 μL缓冲液和3 μL总DNA溶液室温混合,然后进样到1%琼脂糖凝胶(已加2 μL溴化乙锭EB)样孔中,在100 V电泳槽中电泳30 min,用全自动数码凝胶成像系统380C拍照记录,结果如图1所示,从左到右依次为柠条、沙米、红砂、珍珠猪毛菜、霸王、油蒿、沙木蓼、沙冬青、蒙古莸、沙拐枣、文冠果和花棒所提取的DNA电泳结果.由图1可以看出,12种荒漠植物提取的DNA完整性良好.
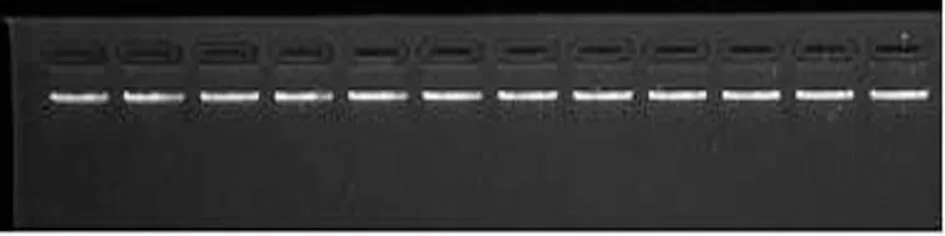
图1 12种荒漠植物提取的DNA电泳结果
3.2 总DNA产量和纯度检测
取1μL提取获得的DNA溶液,用微量紫外分光光度计(Nanodrop 2000C)测定OD260、OD280和OD230处的吸光值(以超纯水为空白液调零),计算DNA产量及纯度.总DNA产量计算根据式(1)[6]:
DNA产量=50×OD260×样品的体积(μL)/材料重(mg)
(1)
其中,DNA、蛋白质和多糖、多酚分别在OD260、OD280和OD230具有最大吸光值,常用A260/230、A260/280的比值来表示DNA的纯度.A260/230、A260/280的值在1.6~2.2之间,表示DNA具有较高的纯度.A260/230低于1.8,说明DNA被多糖和多酚污染,A260/280低于1.8,说明DNA被蛋白质污染.
采用本论文改进的试剂配方提取的12种荒漠植物DNA结果如表1所列.由表1可见,总DNA质量浓度超过500 ng/μL,A260/230高于1.8,A260/280在1.6~2.2之间,表明所提取的DNA产量和纯度均高.
采用市售普通植物DNA提取试剂盒提取12种荒漠植物DNA结果如表2所列.由表2可见,总DNA质量浓度低于100 ng/μL,A260/230低于1.8,除了第一个样品,其他样品的A260/280均低于1.6,表明所提取的DNA浓度低,纯度差.
从表1、2的结果比较可以看出,采用研磨过程中直接加入PVPP粉的方法,显著提高了荒漠植物的DNA浓度.PVPP粉作为多酚化合物的螯合剂,具有很强的结合酚能力.在此试验中特别提高了PVPP粉和前处理缓冲液中β-巯基乙醇的含量,使其质量分数均达到0.5%~2%,β-巯基乙醇提供还原条件,二者协同作用,使得多酚类物质不易被氧化,而与PVPP充分结合形成螯合物.再通过后续的步骤抽提除去,有效抑制了酚类物质对DNA提取的影响.
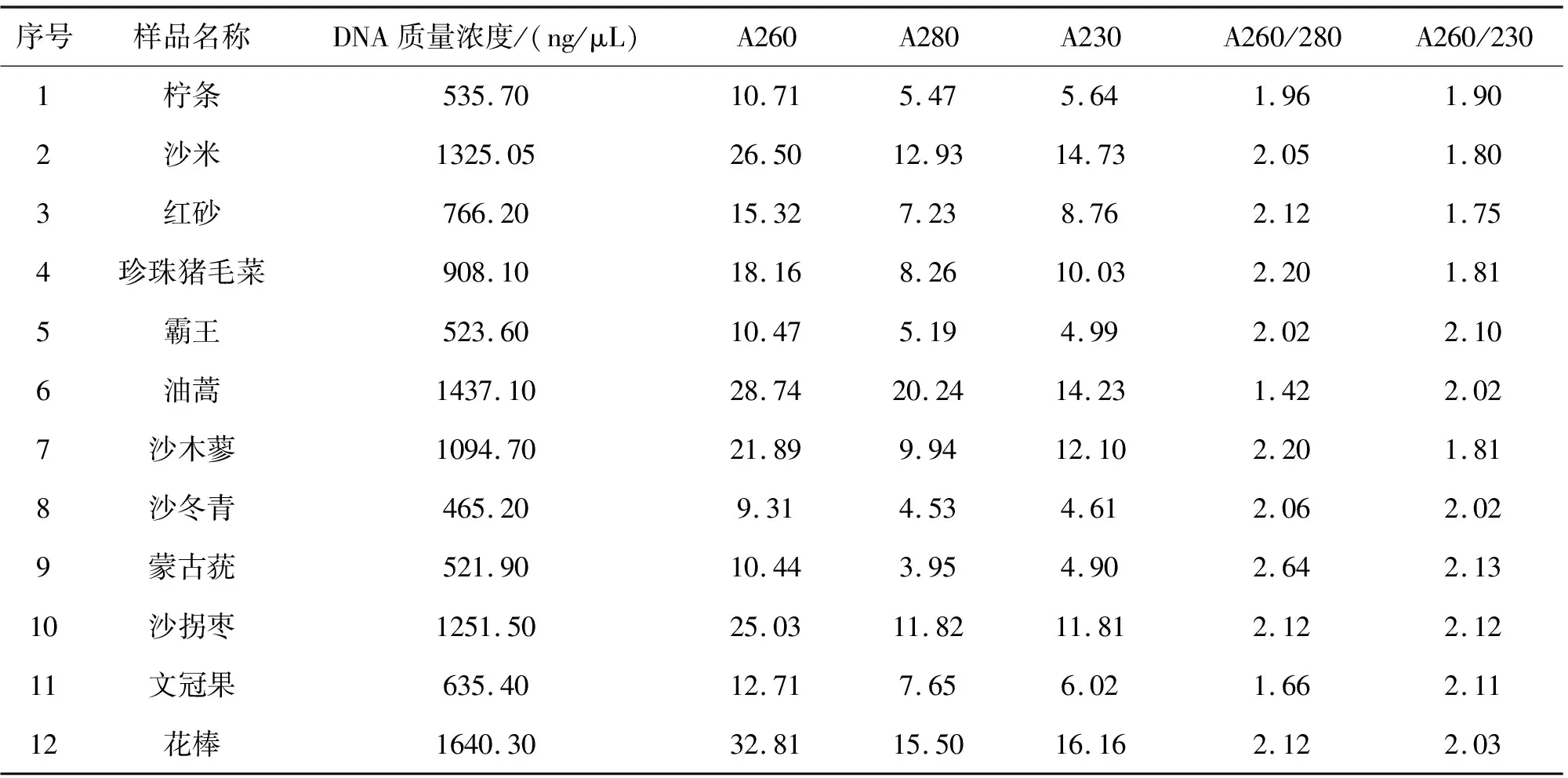
表1 改良法12种荒漠植物DNA产量和纯度测定结果
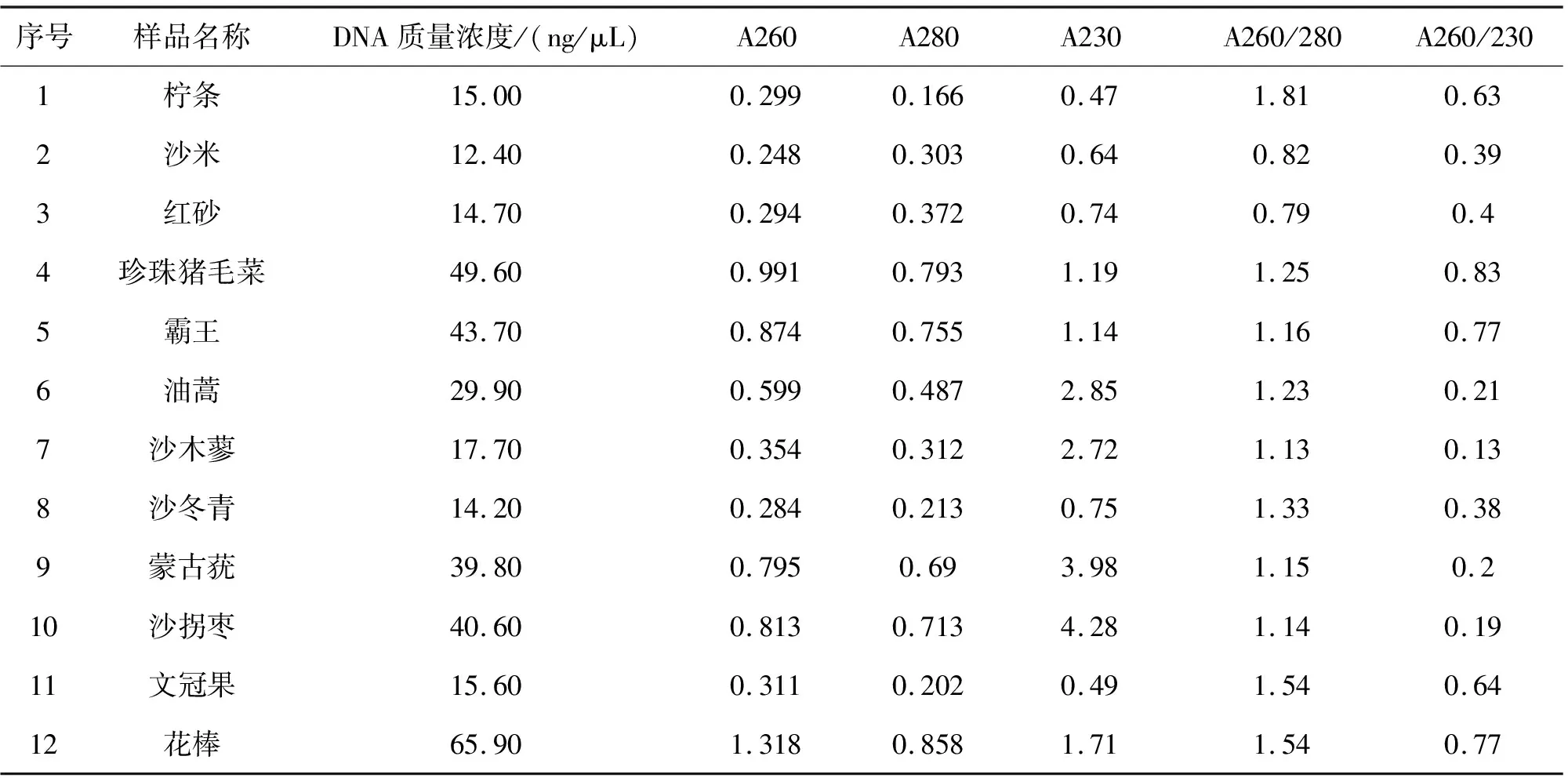
表2 普通植物DNA提取试剂盒12种荒漠植物DNA产量和纯度测定结果
对照试验中采用的试剂盒没有加入PVPP粉,因此导致DNA提取浓度低的原因是其采用聚乙烯吡咯烷酮(PVP).PVP水溶性好,可溶于各种有机溶剂,而PVPP是交联聚乙烯吡咯烷酮,是聚乙烯吡咯烷酮的交联聚合物,几乎不溶于任何溶剂.不溶性PVPP替代可溶性的PVP,可溶性PVP与酚的抽提不兼容而干扰DNA沉淀.不溶性PVPP在提取第一步的研磨时立即结合多酚,从而阻止核酸与多酚结合,可以避免DNA产量减少.而且PVPP不影响萃取纯化过程,因此提高了DNA的产量和纯度.
4 结论
本方法操作简单,耗时少,操作过程大约2~3 h.DNA损失少,产量高,DNA质量浓度大于500 ng/μL.
本方法提取的荒漠植物DNA纯度高.荒漠植物富含多酚、多糖、蛋白质等次级代谢物,为了使提取的DNA纯度高,操作过程中首先在材料研磨时使用PVPP粉充分结合多酚进而通过氯仿/异戊醇抽提彻底去除多酚.通过使用高盐的前处理缓冲液去除大部分多糖.
本方法提取的荒漠植物DNA完整性好.由于改良CTAB法能彻底去除多糖、多酚、蛋白质、RNA及其它污染物,所提的DNA适合分子生物学的下游试验,如反转录及基因扩增等,所以改良CTAB法是提取荒漠植物总DNA的最理想方法,为后续开展荒漠植物分子克隆和基因表达分析等分子生物学试验奠定了基础.
本技术不仅能从常见荒漠植物中提取出高质量的DNA,同时也适合于其它富含多糖、多酚以及大量次级代谢物的植物DNA的高效提取,如提取水果果实、百合鳞茎中DNA,具有广泛的应用价值.

