绵羊繁殖轴相关组织TPH1和TPH2基因表达分析及TPH2基因多态性与产羔数的关系
李华振 狄 冉 郭晓飞 张金龙 张效生 马 琳 刘武军 储明星*
(1.中国农业科学院 北京畜牧兽医研究所/农业部动物遗传育种与繁殖重点实验室,北京 100193;2.新疆农业大学 动物科学学院,乌鲁木齐 830052;3.天津市畜牧兽医研究所,天津 300381)
大多数绵羊品种(Ovisaries)具有季节性发情的特点,该类品种仅在秋、冬季节等短日照条件下出现发情行为。少数绵羊品种如小尾寒羊等可以四季发情配种产羔,显著提高繁殖效率。因此,研究绵羊季节性发情形成的生理和分子机制,可为提高绵羊繁殖效率提供科学依据。色氨酸羟化酶(Tryptophan hydroxylases, TPH)属于蝶呤依赖性芳香族氨基酸羟化酶家族的成员,作为褪黑激素(Melatonin, MEL)生物合成的第一个酶,在所有脊椎动物的松果体中大量表达[1]。已有研究表明褪黑激素是调控绵羊季节性发情的重要因子,因此TPH可能通过影响褪黑激素的合成,进而影响绵羊繁殖轴激素分泌进而调控动物发情行为[2]。
已发现的色氨酸羟化酶有TPH1和TPH2,这2 个基因分别位于绵羊的15号和3号染色体上。TPH1主要在胃肠道和松果体等周围组织表达;TPH2主要在大脑和下丘脑的5-羟色胺能神经元以及肠神经系统的神经元中表达[3]。TPH能催化L-色氨酸向5-羟基-L-色氨酸(5-Hydroxytryptamine, 5-HT)的转化,该反应是5-HT生物合成中的初始和限速步骤,而5-HT是MEL的前体产物[4]。5-HT 能神经元是胚胎最早产生的神经元之一,参与调节脑回路的结构和可塑性,并且在常规突触建立之前通过发育的轴突释放5-HT[5]。最初药理学研究表明,5-HT可以调节许多发育过程,包括细胞分裂、细胞分化、神经元迁移及突触发生[6]。5-HT在下丘脑内侧视前区中能神经元突出连接GnRH神经元,能直接负调控GnRH的分泌[2]。增加内源性局部或者外周血液中5-HT水平导致促黄体素(Luteinizing hormone, LH)分泌减少[7],并在母羊、大鼠[2]等中得到类似的结果。由于5-HT由TPH催化产生,证实TPH在上游组织中可通过调控5-HT分泌影响繁殖轴(Hypothalamic-pituitary-gonadal axis, HPGA)轴激素表达[2]。已有研究发现去卵巢母猴在雌激素(E)和孕酮(P)处理下,下丘脑局部区域TPH2mRNA表达增加[9]。人类注射雌激素后,发现E能诱导5-HT神经元中的孕激素受体(PR)和雌激素受体(ER)表达,表明TPH(尤其TPH2)可能也受到HPGA中的E影响[10]。
已有研究表明TPH能参与调控繁殖生理过程,是繁殖通路中的重要组成部分[10]。但对TPH基因在不同繁殖状态下绵羊性腺轴相关组织中表达差异和参与季节性发情和繁殖时期转换方面的研究鲜有报道。因此,本试验拟以卵泡期和黄体期的成年小尾寒羊母羊(常年发情品种)和长光照和短光照条件下的苏尼特羊母羊(季节性发情品种)为研究对象,采用qPCR法检测TPH基因在不同繁殖状态下绵羊繁殖轴10 种不同组织中的表达情况;并利用MassARRAY飞行质谱技术(Time-of-flight mass spectrometer, TOF-MS)[11]检测6个绵羊品种TPH2基因多态性,通过统计学将TPH2基因多态性与绵羊2 个繁殖性状(季节性发情和产羔数)进行关联分析。旨在揭示或完善绵羊繁殖分子调控机制,以期提高季节性发情绵羊的繁殖效率。
1 材料与方法
1.1 试验羊选择及处理
选择6 只健康状态良好的空怀小尾寒羊母羊(采样地点:山东省,郓城县),在其阴道内放置孕酮阴道栓(Controlled intcmal drug release device,CIDR,InterAg公司,新西兰)进行同期发情,12 d后撤栓,分别采集卵泡期(撤栓后第3天)和黄体期(撤栓后第9天)性腺轴相关组织备用。
选择天津市畜牧兽医研究所畜禽繁育基地人工控光条件下饲养的6 只健康状态良好的苏尼特羊母羊,首先在短光照(Short day, SD)条件下(光照/黑暗:8 h/16 h,人工模拟发情季节)饲养42 d后,转至长光照(Long day, LD)条件下(光照/黑暗:16 h/8 h,人工模拟休情季节)饲养49 d,并根据文献报道,分别在SD 21和LD 492 个时间点采集性腺轴相关组织;
分型样品选择:小尾寒羊(山东省郓城县)27 只、湖羊(江苏省徐州市)101只、策勒黑羊(新疆维吾尔自治区和田市)52只、苏尼特羊(内蒙古自治区乌拉特中旗)21只、滩羊(宁夏回族自治区盐池县)22只、草原型藏羊(西藏自治区当雄县)161只,以及带有产羔记录的小尾寒羊(山东省郓城县)384 只。采抗凝血送北京康普森生物技术有限公司进行基因型检测。
1.2 组织样品采集
采集下丘脑、垂体、松果体、大脑、小脑、卵巢、输卵管、子宫、肾脏、肾上腺等10种组织样。样品要在屠宰后迅速采集完成装入2 mL RNase-Free冻存管中,立刻放进液氮中保存,所有样品采集并保存完成后一并转入干冰带回实验室,整理并保存于-80 ℃专用冰箱中。
1.3 试验相关试剂及仪器
试验中相关试剂主要有RNA提取试剂盒(天根生化科技有限公司, 北京)、反转录试剂盒(TakaRa,宝生物工程(大连)有限公司)和荧光定量染料(SYBR®Premix ExTaqTMII) (TaKaRa, 宝生物工程(大连)有限公司)等,相关仪器有NanoDrop 2000超微量分光光度(Thermo, 美国)、PCR仪(Eppendorf, 德国)和罗氏荧光定量仪480II(罗氏, 美国)等。
1.4 引物设计
参考GenBank绵羊TPH1和TPH2基因mRNA序列(登录号:ENSOARG00000001345和ENSOARG00000014686)及公开文献发表的引物信息,采用Premier 3.0在线软件进行引物设计,由北京天一辉远生物科技有限公司合成。以β-ACTIN(登录号:NM_001009784.1)作为参照基因。qPCR引物相关信息见表1。
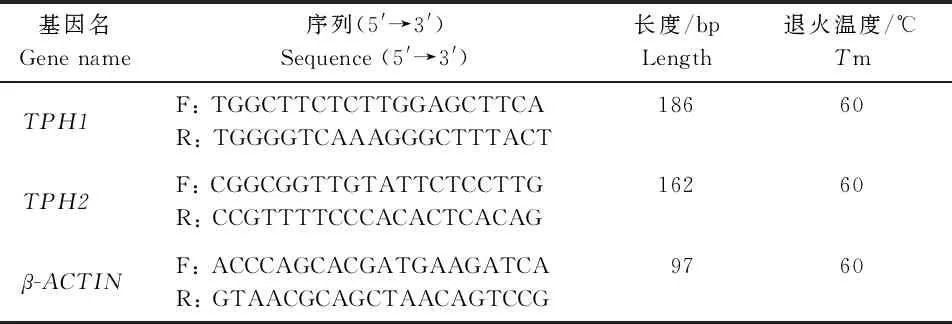
表1 本研究所用RT-PCR引物信息Table 1 Primers used in this study
1.5 总RNA提取及cDNA合成
将采集的组织用RNA提取试剂盒提取总RNA,通过cDNA快速合成试剂盒反转录总RNA获得cDNA。反应条件为:37 ℃ 15 min,85 ℃ 5 s,获得cDNA第一条链。5 倍稀释反转录产物后,用β-ACTIN(qPCR引物,见表1)做参照基因进行PCR检测,质量合格后0 ℃保存以备检测基因mRNA表达。
1.6 荧光定量PCR体系及标准曲线建立
用罗氏PCR仪检测组织表达,每个样品技术重复为3次,用β-ACTIN作为内参基因,以模板为H2O设空白对照。qPCR反应体系和反应程序相关试剂参照使用说明,标准曲线的建立体系和步骤方法参考文禹粱等(2019),绘制TPH2 基因以及β-ACTIN基因的标准曲线[12],反应结束后进行熔解曲线分析。
1.7 基因分型
对TPH2基因g.107854166 C>T和g.1078541669C>T 2个SNP位点在不同绵羊品种中进行分型,采用Sequenom MassARRAY®SNP技术(康普森生物技术有限公司,北京)进行基因型检测。分型样品选择:常年发情品种(小尾寒羊、湖羊和策勒黑羊)和季节性发情品种(苏尼特羊、滩羊和草原型藏羊)。分型样品为DNA(绵羊抗凝血提取),每个样品DNA需要量为20 μL,DNA浓度为40~80 ng/μL。
1.8 数据统计及分析
采用2-ΔΔCt法[13]计算TPH基因在各组织中的相对表达量,数据用统计学软件SPSS 22.0进行单因素方差分析,用最小显著差异法(Least significant difference,LSD)进行多重比较。
2 结果与分析
2.1 TPH1和TPH2基因在绵羊HPGA 10种组织中的表达分析
采用qPCR技术对2 个基因在绵羊HPGA各组织中的差异表达情况进行定量分析,结果发现TPH1基因在2 个绵羊品种各组织广泛表达(图1):
图1(a)中,TPH1基因在苏尼特羊下丘脑和松果体中短光照表达量极显著高于长光照(P<0.01),在苏尼特羊垂体中短光照表达量显著高于长光照(P<0.05);图1(b)中,TPH1基因在小尾寒羊垂体和卵巢中卵泡期表达量显著低于黄体期(P<0.05)。

*代表差异显著(P<0.05);**代表差异极显著(P<0.01)。下同。*indicates the difference is significant (P<0.05).**indicates the difference is highly significant (P<0.01). The same below.图1 TPH1基因在苏尼特羊(a)和小尾寒羊(b)的相对表达量Fig.1 Relative expression of levels TPH1 gene in sunite sheep (a) and Small Tail Han sheep (b)
2.2 TPH2基因的表达水平
检测TPH2基因在不同繁殖状态下苏尼特羊和小尾寒羊性腺轴相关组织中表达量发现:TPH2基因在苏尼特羊松果体以及肾脏中表达量较高,图1(a)中卵巢组织中长光照下的表达量显著高于短光照(P<0.05);图2(b)中TPH2基因在小尾寒羊下丘脑组织中卵泡期的表达量极显著高于黄体期(P<0.01)。

图2 TPH2基因在苏尼特羊(a)和小尾寒羊(b)的相对表达量Fig.2 Relative expression levels of TPH2 gene in sunite sheep (a) and Small Tail Han sheep (b)
2.3 TPH2基因多态性分析
通过MassARRAY飞行质谱技术(Time-of-flight mass spectrometer, TOF-MS)[11]检测6个绵羊品种,得到绵羊3号染色体TPH2基因第1外显子存在2处突变:g.107854166C>T和g.1078541669C>T,并发现g.107854166C>T为错义突变S/L(密码子TCG/TTG),位于TPH2基因cDNA的第149个碱基,蛋白质的第50个氨基酸;g.1078541669C>T也属于错义突变P/L(密码子:CCG/CTG),位于TPH2基因cDNA的第152个碱基,蛋白质的第51个氨基酸。同时对6 个绵羊品种TPH2基因进行基因分型,并发现TPH2基因2 个SNP位点在单羔季节性发情和多羔常年发情品种中均存在3 种基因型,并且g.107854166C>T和g.1078541669C>T位点的CC型均为优势基因型。
通过统计学比较单羔季节性发情和多羔常年发情组间6 个绵羊品种g.107854166 C>T和g.1078541669C>T的基因型和等位基因频率差异,从表2可知,TPH2基因g.107854166C>T等位基因频率在季节性、常年发情品种间差异达到显著水平(P<0.05),但其他的基因型频率和等位基因频率均没有达到显著差异水平。且CC为优势基因型,C为优势等位基因。

表2 TPH2基因不同SNP位点在季节性、常年发情品种中的基因型频率和等位基因频率Table 2 Genotype and allele frequencies of different SNPs of TPH2 gene in seasonal and non-seasonal reproduction sheep
通过统计学分析TPH2基因不同SNP位点在不同绵羊品种中的群体遗传学(表3)可知,TPH2基因的g.107854166C>T和g.107854169C>T位点在滩羊、苏尼特羊、草原型藏羊、小尾寒羊、湖羊以及策勒黑羊6个品种中均表现为低度多态(PIC<0.25)。另外,卡方适合性检验结果表明,g.107854166C>T在多羔常年发情品种组间均为野生型,该位点没有发生突变,单羔季节性发情品种间g.107854169C>T位点均处于哈代温伯格平衡状态(P>0.05)。
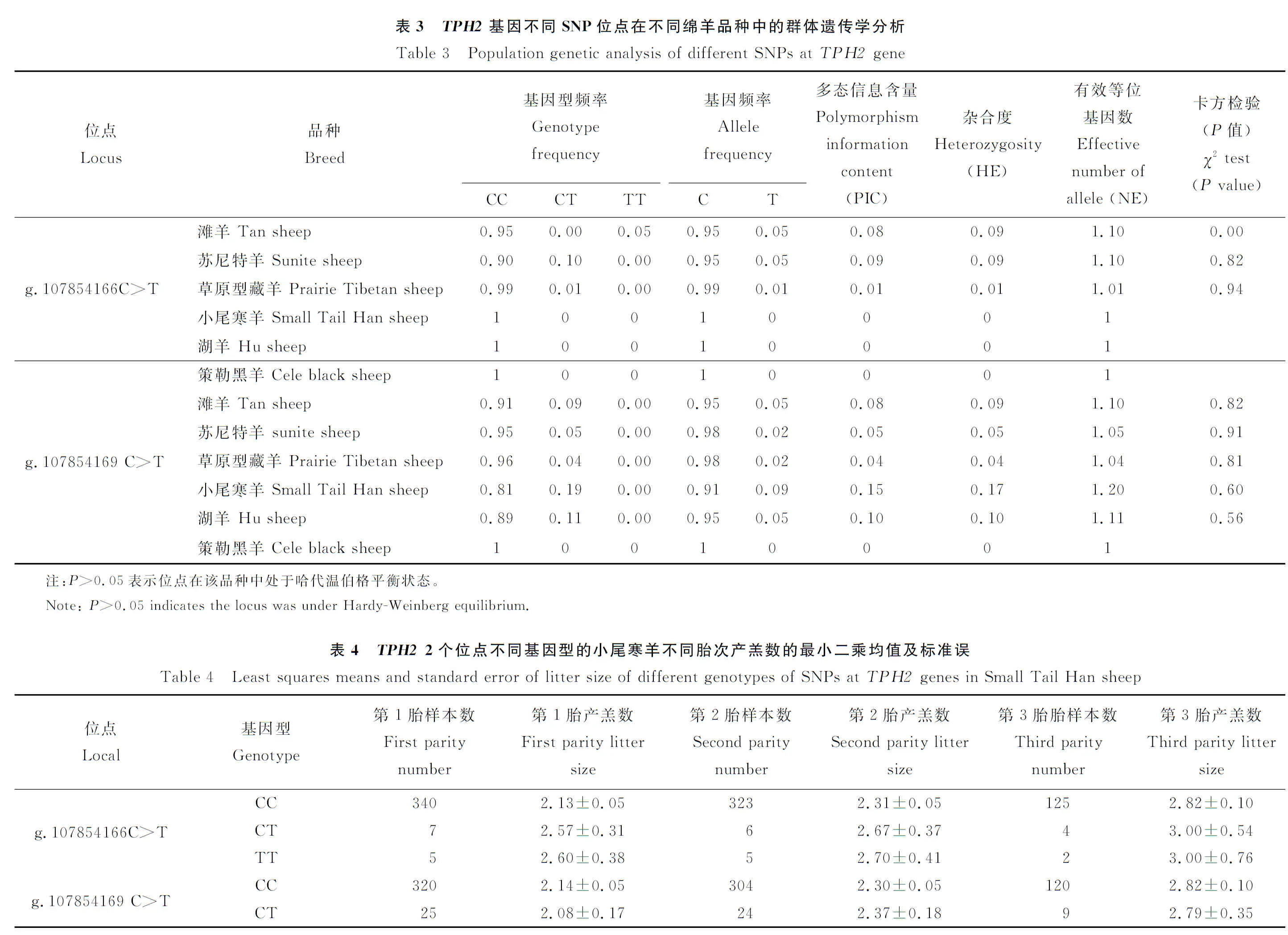
用ANOVA将候选基因的基因型与384只小尾寒羊产羔数进行关联分析,从表4中可知,TPH2基因g.107854166C>T和g.107854169C>T位点不同基因型与小尾寒羊3 个胎次产羔数关联后无显著差异。
3 讨 论
3.1 季节性变化对TPH基因表达的影响
TPH1是MEL生物合成第1个限速酶,在所有脊椎动物的松果体中大量产生[14]。松果体细胞中MEL的生物合成是多步骤反应,其起始于TPH将色氨酸羟基化为5-HTP,并受到色氨酸羟化酶1(TPH1)的限制[15]。本研究发现TPH1基因在苏尼特羊松果体中的差异表达(图1),也验证了上述结果[16]。在大鼠[16]和鸟[17]等动物中检测到TPH1 mRNA呈昼夜节律表达。在温带鸟类的季节性发情的研究中也发现TPH1mRNA在下丘脑乳头状前核(Premammillary)表达,进而控制鸟类季节性发情[17],本研究TPH1mRNA在苏尼特羊下丘脑和松果体中短光照表达量极显著高于长光照(P<0.01),受到季节性信号强烈的选择,与Kang等[17]的研究结果一致。
TPH2基因的昼夜节律已经被多项研究证明:大鼠视网膜[16]和叙利亚仓鼠(Syrianhamster)下丘脑[18]中的TPH2转录本显示出明显的光周期依赖性昼夜节律变化。然而,在鸟类下丘脑PMM中没有检测到TPH2mRNA表达[17]。苏尼特羊TPH2转录研究中仅在卵巢组织发现差异表达。究其原因可能是TPH2mRNA表达在苏尼特母羊中季节性节律较弱或不存在季节性节律。
3.2 类固醇激素负反馈对TPH-GnRH通路的影响
卵巢切除后在猕猴(Rhesusmacaques)[19]、恒河猴(Rhesusmonkey)[9]和大鼠[20]下丘脑中注射E,均发现丘脑局部区域TPH2mRNA表达增加。在使用E处理后的母猴5-HT神经元中TPHmRNA和TPH蛋白单细胞水平都显著升高,证明E可诱导5-HT神经元中的PR和ER进而参与调控5-HT的分泌,表明TPH(尤其TPH2)可能受到HPGA中的E负反馈调控[10]。在下丘脑内侧视前区(Medial preoptic area)中5-HT神经元突出连接GnRH神经元,能直接负调控GnRH的分泌[2],在雌性大鼠的GnRH神经元中发现大量的5-HT受体,其中HTR2参与调控排卵,并介导5-HT间接或者直接抑制LH分泌[2],也证明了GnRH受到5-HT/HTR2影响[21]。研究表明大鼠中存在TPH/5-HT/5-HT受体2(5-Hydroxytryptamine receptor 2)/GnRH通路调控性腺轴激素分泌[2]。
本研究qPCR检测结果暗示小尾寒羊下丘脑TPH表达受到雌激素正反馈和负反馈的影响。绵羊发情进入卵泡期后,孕酮浓度急剧下降,孕酮的负反馈消失,在排卵前(卵泡最大时)出现平行的LH峰和E峰,当E大量分泌时,可以通过负反馈作用于下丘脑和垂体[22]。小尾寒羊卵泡期存在E反馈,作用于HPGA,调节GnRH和LH释放分泌[23]。综上所述并结合本研究(图2)中TPH2基因在小尾寒羊下丘脑组织中卵泡期的表达量极显著高于黄体期(P<0.01)的研究结果,推测绵羊下丘脑中同样存在通路E/TPH2/5-HT/HTR2/GnRH通路。本研究小尾寒羊卵泡期组织是在卵泡达到最大时采的样,此时正处于雌激素峰,E大量分泌,反馈作用于下丘脑5-HT神经元的TPH2,使其表达量增加,导致5-HT分泌增多,并通过5-HT神经元末端突出作用于GnRH神经元,从而调控GnRH分泌[2]。
3.3 TPH在垂体中的作用
已有研究表明增加内源性5-HT水平导致LH分泌减少[2,24],证明TPH可以通过5-HT调控LH水平。通过注射5-HT神经毒素破坏5-HT神经元后,在大鼠中后发现抑制5-HT合成对LH分泌的促进作用[2]。在去势大鼠脑室注射小剂量5-HT后,LH释放减少[25],同时也有研究报道了全身注射5-HT对阉割大鼠LH水平的抑制作用[26]。本研究发现TPH1在小尾寒羊垂体和卵巢中卵泡期显著低于黄体期(P<0.05)结果与上述小鼠中的研究基本一致[26]。
3.4 TPH2基因多态性与绵羊产羔数之间的关系
TPH2基因的g.107854166C>T和g.107854169C>T位点在滩羊、苏尼特羊、草原型藏羊、小尾寒羊、湖羊以及策勒黑羊6 个品种中均表现为低度多态(PIC<0.25),表明2 个位点在6 个绵羊品种中的遗传多样性较少。前者在多羔常年发情组没有突变型,可能由于突变致死或突变型适应性差导致死亡。从表2可知这2 个位点与绵羊季节性发情无关,因此推断这2 个位点不是影响绵羊季节性发情的关键位点。与小尾寒羊产羔数关联分析也表明,g.57842893C>T位点与小尾寒羊第1、2以及第3胎产羔数均无显著关联(P>0.05),不是影响小尾寒羊产羔数的关键基因。
4 结 论
本研究发现,TPH1和TPH2基因在绵羊繁殖相关组织中呈中等丰度表达,在HPGA各组织中的生理功能不重叠。在苏尼特羊中TPH1基因呈季节光照依赖性节律表达,可能参与绵羊季节性发情调控和繁殖时期转换。TPH2基因可能在小尾寒羊下丘脑中受到E的反馈调控,参与发情时期的转换。TPH2基因g.107854166C>T和g.107854169C>T位点不是季节性发情关键位点,也不参与小尾寒羊产羔数调控。

